浙江饮用水源地浮游动物体积多样性及水质响应
2017-04-12徐杭英于海燕俞建韩明春徐智焕李共国黄
徐杭英于海燕俞 建韩明春徐智焕李共国黄 艺
(1. 浙江省环境监测中心, 杭州 310000; 2. 浙江万里学院, 浙江省生物工程重中之重学科, 宁波 315100; 3. 北京大学环境科学与工程学院, 北京 100871)
浙江饮用水源地浮游动物体积多样性及水质响应
徐杭英1,3于海燕1俞 建1韩明春1徐智焕2李共国2黄 艺3
(1. 浙江省环境监测中心, 杭州 310000; 2. 浙江万里学院, 浙江省生物工程重中之重学科, 宁波 315100; 3. 北京大学环境科学与工程学院, 北京 100871)
为了解浙江饮用水源地浮游动物体积多样性及对水体综合营养状态(TLIc值)的响应特征, 对16个饮用水源地(H1-H8为河网型, K1-K8为水库型)展开了水质参数、浮游动物群落生物体积及其多样性指数的季节调查。结果表明, 生物体积密度的季节变化以1月(0.681 mL/L)>4月(0.443 mL/L)>10月(0.252 mL/L)>7月(0.229 mL/ L), 各季的第一优势种分别为汤匙华哲水蚤(Sinocalanus dorrii)(1月)、晶囊轮虫(Asplanchna sp.)(4月)、粗壮温剑水蚤(Thermocyclops dybowskii)(7月)和长额象鼻溞(Bosmina longirostris)(10月)。河网浮游动物生物体积以轮虫(44.6%)和枝角类(23.4%)为主, 水库则以哲水蚤(39.5%)和轮虫(29.0%)为主。夏秋季浮游动物体积多样性指数(P<0.01)和物种多样性指数(P<0.05)与lg(浮游动物/浮游植物生物量比率)[lg (ZB∶PB)]之间均有显著的相关性, 水库中仅浮游甲壳动物体积多样性指数与lg (ZB∶PB)之间有极其紧密的相关性(R2=0.77)。与物种多样性指数响应环境效应相比, 甲壳动物的体积多样性指数(P<0.01)能更好地指示夏秋季河网的TLIc值, 这归因于甲壳动物个体数(ind./L)转换成了生物体积密度(mL/L)过程中有效信息的放大。
河网; 水库; 浮游动物; 体积多样性指数; TLIc值
生物多样性的生态系统功能一直是生态学研究的热点, 由于微型生物群落对环境的敏感变化是有机体连接许多生态系统的基本特征之一, 利用浮游动物生物多样性评价水体环境质量引起了一些研究者的兴趣[1,2], 在营养水平较高的水域, 浮游动物群落多样性与水体营养水平呈现相反的变化趋势[3—5], 在营养水平较低的水域, 它们两者之间则呈现相同的变化趋势[6]。实际上, 浮游动物群落会受到许多环境因子如温度、光周期、溶解营养物、水流速快慢等的影响, 这种群落内正常的季节性或日变化与人类活动引起的污染效果还难以区分[7]。因此, 利用浮游动物群落多样性评价水质还存在诸多限制因子。近年来, 生物体积已被广泛认为是一个决定生态系统群落结构的关键因素, 因为它会影响系统内食物网的结构、稳定性和动态, 浮游动物体积多样性与水体中悬浮物的过滤效率、抑制藻类生长和水体透明度等密切相关[8—10]。因此, 研究浮游动物体积多样性及其对水体营养状态的响应特征, 对促进水质生态学监测工作具有重要意义。
浙江饮用水水库占全省51%城乡饮用水源地,供水人口达62%, 但库区污染源和人类活动已对水库水源地水质安全构成威胁, 溪、江、河流型饮用水源地的水质更易受到富营养化和突发污染事件的影响[11]。为了解浙江饮用水源地浮游动物体积多样性及对水质的响应, 本文于2011年1月至10月,对全省两类水体16个饮用水源地展开了水质理化参数、浮游动物群落优势种和体积多样性的季节调查, 探讨群落体积多样性与水体营养水平之间的关系, 以期为浮游动物群落监测水质奠定基础。
1 材料与方法
1.1 站位布设与采样方法
根据浙江省饮用水源地主要由大江、大溪、河流和水库等组成特点, 将由大江、大溪、河流等流速较大的水源地归为河网型, 选取8个采样站(H1—H8); 水流速较缓的水库(型)也选取8个采样站(K1—K8), 16个浮游动物采样站分布见图 1。于2011年的1月、4月、7月和10月, 由全省各地方监测站定点、定时(上午9:00—11:00时)分别采样与送样, 采样和计数按《淡水浮游生物研究方法》[12]进行, 定量样品用2.5 L采水器分别于该样站上、下水层, 各采10 L水样, 用25号筛绢制成的浮游生物网(网孔孔径64 μm)过滤浓缩, 当即用5%甲醛溶液固定, 带回实验室镜检。同时测定水体pH (玻璃电极法GB/T6920-1986)、DO (电化学探头法HJ506-2009)、TN (碱性过硫酸钾消解紫外分光光度法HJ636-2012)、TP (钼酸铵分光光度法GB/T11893-1989)、(纳氏试剂分光光度法HJ535-2009)和Chl.a (丙酮紫外分光光度法比色法)等水质参数。
图 1 浙江饮用水源地浮游动物采样点分布Fig. 1 Localization of sampling stations for zooplankton from the drinking water sources in Zhejiang
1.2 标本鉴定与计算方法
轮虫、枝角类和桡足类分别按王家楫[13]、蒋燮治和堵南山[14]、沈嘉瑞[15]鉴定。浮游动物的体长、宽度和厚度采用(显微镜)目镜测微尺测量, 生物体积主要参照章宗涉和黄祥飞[12]、陈雪梅[16]的体积法和体长-体重回归方程法计算。桡足幼体和成体数量按该种桡足类成体或幼体出现频率乘以样本总数计算。群落物种多样性指数按Shannon-Wiener方法[3]统计; 体积多样性(Size diversity)指数计算是基于Shannon-Wiener多样性的表达方式[9,10],即将每种浮游动物的不同体积作为连续变量, 而并非仅仅考虑某一物种的种群数量。为便于计算, 将浮游动物体长的连续变量以每增长200 μm作为一个体积等级分别统计其体积密度, 然后将群落内各种浮游动物不同体积等级的密度分布集合起来, 统计成该群落的体积多样性。同时, 以Chl.a浓度代替浮游植物生物量[17], 计算浮游生物的营养结构[lg(浮游动物/浮游植物生物量比率)][9], 记作lg (ZB∶PB); 计算水体综合营养状态指数(Comprehensive of trophic level index, TLIc)[18]。
1.3 统计分析
以lg (ZB: PB)、TLIc为因变量, 以群落物种或体积多样性指数为自变量的相关回归分析应用DPS数据处理系统[19]完成。
2 结果
2.1 饮用水源地理化参数
在16个饮用水源地中, 以河网型的H7、H8站TN、TP和含量为最高(表 1), 均显著高于其他各站, 其中, 尤以河网各站的TP含量显著高于水库各站(P<0.05); 而H8站的DO含量显著低于水库各站(P<0.05)。pH以H5、H6和K8站较高, Chl.a含量以K7站最高。河网水体综合营养指数(TLIc)显著高于水库(P<0.05)。相关回归分析表明: 饮用水源地TLIc值分别与TP、和TN含量均呈极显著的正相关性, 与DO含量呈极显著的负相关性(P<0.01)。
2.2 浮游动物生物体积的组成及其季节变化
浮游动物体积密度的组成, 1月以哲水蚤0.391 mL/ L(占57.1%)为主, 主要为水库中的汤匙华哲水蚤(Sinocalanus dorrii)大量繁殖, K4、K6和K7站分别达2.411、0.589和1.256 mL/L(图 2); 4月则以轮虫0.346 mL/L(占78.1%)为主, H2、K5站萼花臂尾轮虫(Brachionus calyciflorus)体积密度分别达1.394和0.655 mL/L, K1站晶囊轮虫(Asplanchna sp.)生物体积密度为1.350 mL/L; 7月份的枝角类和剑水蚤体积密度分别达0.083(占36.2%)和0.075 mL/L(占32.8%), 河网以H4站广布中剑水蚤(Mesocyclops leuckarti)(0.188 mL/L)、H6站长额象鼻溞(Bosmina longirostris)(0.288 mL/L)较高, 水库以K5站的台湾温剑水蚤(Thermocyclops taihokuensis)(0.182 mL/L)和K6站的角突臂尾轮虫(Brachionus angularis) (0.251 mL/L)的体积密度较高; 10月份的剑水蚤和枝角类体积密度分别达0.116 (占46.0%)和0.081 mL/ L (占32.1%), 其中H5站的广布中剑水蚤和长额象鼻溞的体积密度分别为0.232和0.420 mL/L, H8站的粗壮温剑水蚤(Thermocyclops dybowskii)、广布中剑水蚤和微型裸腹溞(Moina micrura)的体积密度分别为0.499、0.299和0.235 mL/L, 水库以K4站的粗壮温剑水蚤(0.141 mL/L)较高。
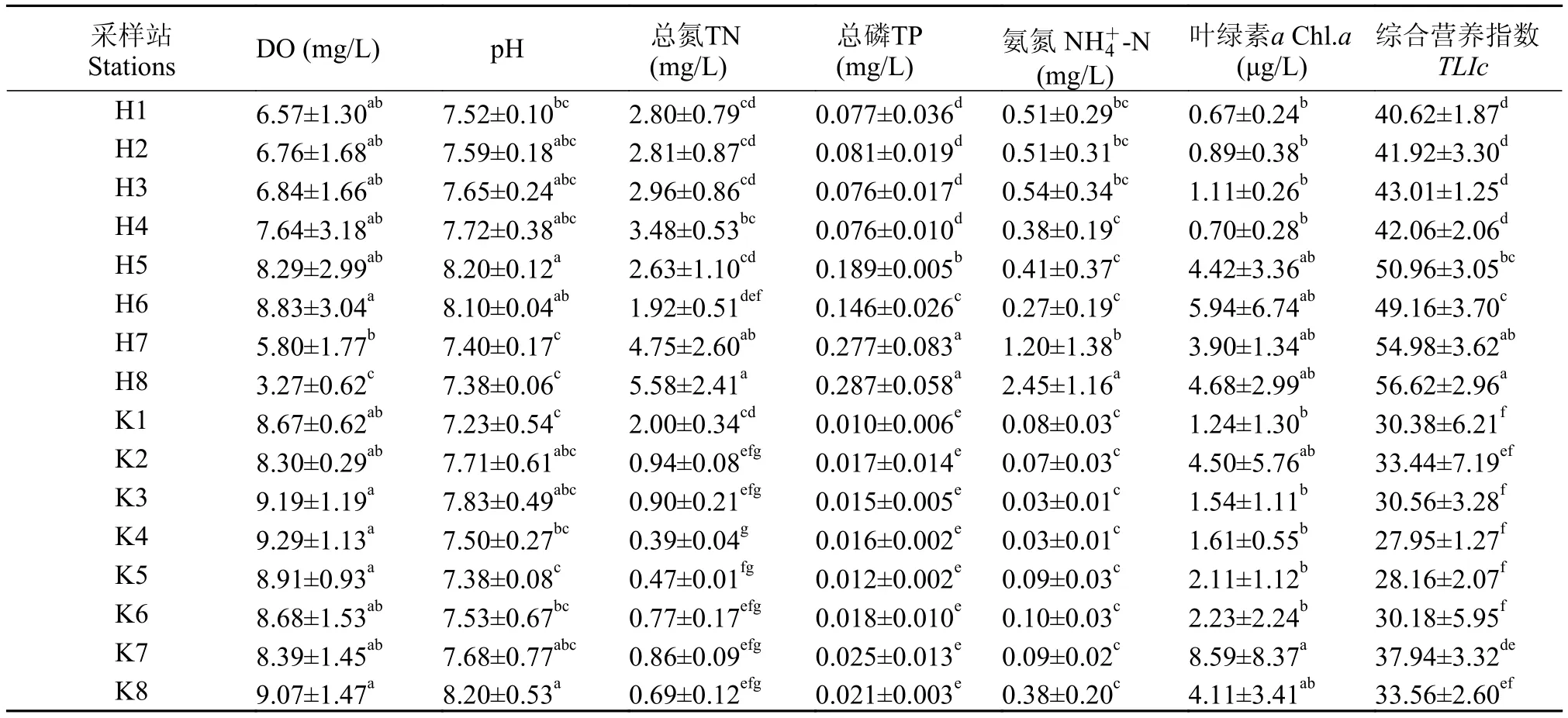
表 1 2011年饮用水源地水质参数(平均值±标准差)Tab. 1 Water quality parameters in the sampling stations of the drinking water sources during 2011 (mean±SD)
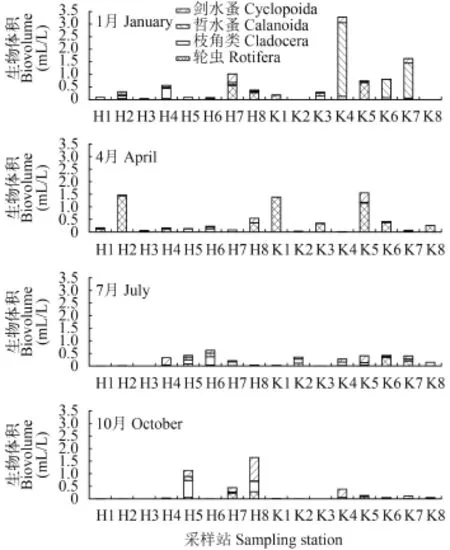
图 2 各类浮游动物生物体积的季节变化Fig. 2 The seasonal biovolume of each group of zooplankton in the drinking water sources
总浮游动物体积密度的季节变化, 以1月(0.681 mL/L)>4月(0.443 mL/L)>10月(0.252 mL/L)>7月(0.229 mL/L)。水库1月份浮游动物平均体积密度最高, 达1.169 mL/L; 10月份最低, 仅0.108 mL/L。
2.3 浮游动物体积多样性及其与lg (ZB∶PB)之间的关系
饮用水源地浮游动物体积多样性指数平均值1.88, 河网(2.02)>水库(1.74), 除H8 (2.87)站显著大于K8 (1.15)(P<0.05)站外, 其余各站之间无显著差异;甲壳动物体积多样性指数平均值1.66, 河网(1.78)>水库(1.55), 除H8 (2.38)站显著大于K3 (0.84)(P<0.05)站外, 其余各站之间无显著差异。轮虫体积多样性指数平均值1.10, 河网(1.21)>水库(1.00), 除H7 (2.13)站显著大于H1—H3、K1 (0.35—0.72)(P<0.05)站外, 其余各站之间无显著差异。相关分析表明, 夏秋季浮游动物多样性指数与lg (ZB∶PB)之间呈极显著(体积多样性指数, P<0.01)或显著(物种多样性指数, P<0.05)的正相关性, 并以甲壳动物体积多样性指数与lg (ZB∶PB)之间相关性最紧密, 相关系数达0.803 (图 3); 而冬春季两者之间则无明显的相关性。
水库甲壳动物体积多样性指数与lg (ZB∶PB)之间相关性比河网更紧密, 相关系数达0.877, 而河网轮虫体积多样性指数与lg (ZB∶PB)之间的相关性比水库更紧密, 相关系数达0.763(图 4)。
2.4 浮游动物体积多样性与环境之间的关系
河网夏秋季水体综合营养指数(TLIc)与浮游动物体积多样性指数(n=16, r=0.737, P<0.01)和物种多样性指数(n=16, r=0.635, P<0.05)之间均呈显著的正相关性。其中, TLIc值与甲壳动物的体积多样性指数(P<0.01)之间相关性比物种多样性指数(P<0.05)之间的相关性更紧密(图 5), 而轮虫物种多样性指数与TLIc值之间的相关性更好。水库夏秋季TLIc值与该两种浮游动物多样性指数之间均无相关性(P>0.05)。
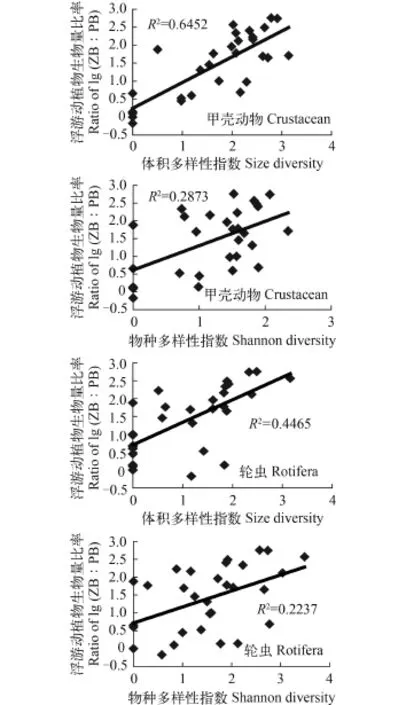
图 3 夏秋季饮用水源地浮游动物多样性指数与浮游动/植物生物量比率之间的关系Fig. 3 Relationships between biomass ratio of lg (ZB∶PB) and size or species diversities of zooplankton in the drinking water sources during summer and autumn
3 讨论
3.1 浮游动物生物体积特征
在贫营养水体中, 浮游动物生物体积通常由体型大的哲水蚤和枝角类占优势, 而在富营养水体中则由较小的剑水蚤和轮虫占优势[20], 饮用水源地河网浮游动物生物量以轮虫(44.6%)和枝角类(23.4%)为主, 水库则以哲水蚤(39.5%)和轮虫(29.0%)为主。各季节的第一优势种, 1月为汤匙华哲水蚤(水库), 4月晶囊轮虫(水库), 7月长额象鼻溞(河网), 10月粗壮温剑水蚤(河网)。另外, 饮用水源地一些具富营养化指示功能的数量优势种, 如萼花臂尾轮虫、短尾秀体溞(Diaphanosoma brachyurum)、网纹溞(Ceriodaphnia)、长额象鼻溞、裸腹溞(Moina)等[21], 也是浮游动物生物体积(特别是河网)的重要组成者(图 2), 它们与浅的栖息水体、高浓度的磷和人类活动密切相关[22], 受有毒微囊藻的影响也较小[23]。
另外, 浮游动物体积密度的季节变化还受到了鱼类捕食强度的影响, 如K3站(部分水域)2010年底首次开展渔业资源增养殖放流, 投放约9000 kg滤食性的花白鲢后, 在还是鱼苗的冬春季, 浮游动物的体积密度较大(0.375 mL/L); 随着鱼类的生长, 捕食强度不断增大, 夏秋季浮游动物的体积密度仅0.003 mL/L, 哲水蚤种群已消失。
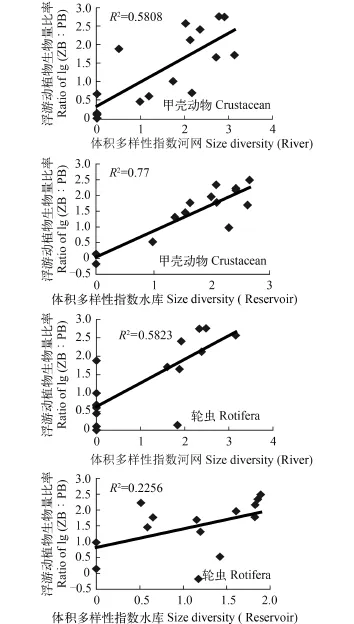
图 4 夏秋季河网、水库浮游动物体积多样性与浮游动/植物生物量比率之间的关系Fig. 4 Relationships between biomass ratio of lg (ZB∶PB) and size diversities of zooplankton in the rivers and reservoirs during summer-autumn

图 5 河网夏秋季浮游动物多样性与水体综合营养状态指数之间的关系Fig. 5 Relationships between water body TLIc values and size diversities or species diversities of zooplankton in the rivers during summer-autumn
3.2 浮游动物体积多样性对浮游生物营养结构的影响
在温带低营养水平湖泊中, 甲壳动物对叶绿素a牧食率随着溞属(Daphian)和枝角类生物量的增大而增大[24]。Ye等[9]假设了浮游动物的每个体积等级都有适合自己摄食的浮游植物最佳尺寸, 并可通过优化的浮游动物/浮游植物生物量比率, 即lg (ZB∶PB)作为“抑藻强度”描述之, 提高浮游动物平均体长或浮游动物体积多样性(两者之间呈显著的正相关性)均可增强对浮游植物的抑制强度, 从而使浮游动物体积多样性成为决定东海“自上而下”控制浮游植物的最重要因素。在计算体积多样性指数过程中, 个体数(ind./L)被转换成了体积密度(mL/L),这放大了大型浮游动物(如溞类、桡足类)“过滤效能”的有效信息, 并使夏秋季饮用水源地浮游动物的“抑藻强度”以体积多样性指数的指示性较物种多样性指数更好(图 3)。河网的轮虫、甲壳浮游动物体积多样性与“抑藻强度”均有显著的正相关性,而水库仅表现为浮游甲壳动物(图 4), 这可能与后者在水库生存竟争上更胜于轮虫[25], 以及进入水库(流域面积小)的外源有机物较河网(流域面积大)少[26], 甲壳动物的营养只能以牧食链为主等有关。
3.3 浮游动物体积多样性指数对水体富营养化的响应特征
河网TLIc值显著高于水库(表 1), 但该两种饮用水源地的浮游动物体积多样性指数差异并不显著。可见, 在不同类型的水体中, 不宜用浮游动物体积多样性指数来指示水质。在水质较好的千岛湖轮虫、枝角类多样性与营养水平呈现相同的变化趋势[6], 认为千岛湖的营养水平还没有达到影响浮游动物群落多样性的程度。同样的情形也发生在饮用水源地, 河网夏秋季的TLIc值随着轮虫、甲壳动物多样性指数的增大而增大(图 5)。在生态系统中碎屑食物链对物质和能量流动中起着重要的作用, 林群等[27]研究发现, 长江口及毗邻水域生态系统中通过碎屑链传递的能流达47%, 并在三峡工程蓄水3年后下降到41%。宁加佳等[26]发现一个由两条较大河流形成的水库颗粒有机物与浮游动物的碳、氮稳定同位素之间有相似的变化趋势, 认为雨季浮游动物的食物来源主要来自外源有机物。因此, 流域面积大的河网水能通过降雨(特别是夏秋季)接纳更多来自流域内的有机物, 致使水体中的有机物以外源性为主, 甲壳动物和轮虫的营养获得除牧食食物链外, 还有较多的有机碎屑链补充,在温度较高的夏秋季, 浮游动物生长繁殖快, 对水体中营养物质的利用度更高, 这使浮游动物体积多样性与TLIc值呈现显著的正相关性。在镜检过程中, 河网采样站发现有较多的有机碎屑。而水库由于其流域面积远小于河网型, 外源有机物进入少,且温带低营养水平中甲壳动物对Chl.a的牧食率较低, 可利用藻类(体长<30 μm)牧食率随着Chl.a浓度的增大而下降[23]。因此, 水库浮游动物的食物显得较为贫乏, 这可能是夏秋季水库浮游动物体积多样性指数与TLIc值无显著相关性的主要原因。
与物种多样性相比较, 体积多样性包涵了物种不同体积分布的信息, 对于体型大、生长过程中又经历了多个不同发育期的浮游甲壳动物, 通过统计体积多样性更能反映其对水体营养物质的利用、转化与积累, 从而贮存更多的信息。这可能是夏秋季河网水体TLIc值与甲壳动物体积多样性指数(P<0.01)之间的相关性较物种多样性指数(P<0.05)更紧密的原因(图 5), 而个体小的轮虫在统计体积多样性的过程中, 会因体积数值小而舍弃部分物种信息,导致轮虫体积多样性与水体TLIc值的相关性(P>0.05)反而不如物种多样性(P<0.05)。可见, 浮游动物营养物来源和多样性指数计算方式的不同, 决定了群落对饮用水源地营养水平的响应特征。
综上所述, 不同营养水体、季节变化条件下浮游动物生物多样性存在较大的差异。夏秋季河网和水库中浮游生物营养结构主要受到浮游动物体积多样性的影响, 响应夏秋季河网水体富营养最敏感的是甲壳动物体积多样性指数。冬春季饮用水源地、夏秋季水库的水体营养状态对浮游动物生物多样性的影响均不显著, 可推测其营养水平较低、且波动不大, 但还需要进一步的论证。因此, 应寻求一种更为灵敏的生物多样性指数或其他拓展性指标, 以适应于更宽阔生态范围内的水质监测。
[1]Vandysh O I. Zooplankton as an indicator of the state of lake ecosystems polluted with mining wastewater in the Kola Peninsula [J]. Russian Journal of Ecology, 2004, 35(2): 110—116
[2]Paturej E, Goździejewska A. Zooplankton-based assessment of the trophic state of three coastal lakes - Łebsko, Gardno, and Jamno [J]. The Bulletin of the Fisheries Institute, 2005, 166(3): 7—25
[3]Li G G, Bao W H , Xu S L, et al. Seasonal change of zooplankton communities and its relationship with aquatic environments in the Yongjiang River, Ningbo [J]. Acta Hydrobiologica Sinica, 2015, 39(1): 1—12 [李共国, 包薇红, 徐石林, 等. 甬江干流浮游动物群落结构季节动态与水环境的关系. 水生生物学报, 2015, 39(1): 1—12]
[4]Zeng Y, Fu X E, Miao M S, et al. Water quality assessment of Wenyuhe River based on the cross-correlation analysis on the diversity of macro-zooplankton and water parameters [J]. Asian Journal of Ecotoxicology, 2012, 2(7): 162—170 [曾阳, 付秀娥, 苗明升, 等. 基于大型浮游动物多样性与水质参数相关性分析的温榆河水质评价. 生态毒理学报, 2012, 2(7): 162—170]
[5]Ji Y, Zhang J, Ma X, et al. Space-time distribution characteristics of zooplankton and water quality assessment in the Fuhe River [J]. Journal of Henan Agricultural Sciences, 2013, 42(3): 66—70 [计勇, 张洁, 麻夏, 等. 抚河干流浮游动物生物多样性调查及水质评价. 河南农业科学, 2013, 42(3): 66—70]
[6]Li G G, Yu Z M. Community structure of zooplankton in Lake Qiandaohu [J]. Acta Ecologica Sinica, 2002, 22(2): 156—162 [李共国, 虞左明. 千岛湖浮游动物群落结构研究. 生态学报, 2002, 22(2): 156—162]
[7]Guo P Y, Lin Y Z. Application of micro-biological monitoring of water pollution [J]. Shandong Environment, 1998, 82(1): 19—20 [郭沛涌, 林育真. 应用微型生物监测水质污染, 山东环境, 1998, 82(1): 19—20]
[8]Ordonez J, Armengol J, Moreno-Ostos E, et al. On non-Eltonian methods of hunting Cladocera, or impacts of the introduction of planktivorous fish on zooplankton composition and clear-water phase occurrence in a Mediterranean reservoir [J]. Hydrobiologia, 2010, 653(1): 119—129
[9]Ye L, Chang C Y, Carmen G C, et al. Increasing zooplankton size diversity enhances the strength of top-down control on phytoplankton through diet niche partitioning [J]. Journal of Animal Ecology, 2013, 82(5): 1052—1061
[10]Quintana X D, Arim M, Badosa A, et al. Predation and competition effects on the size diversity of aquatic communities [J]. Aquatic Sciences, 2015, 77(1): 45—57
[11]Wang D Y, Zhang Y. Statistical analysis on drinking water source and supply system contamination threats and incidents for urban areas in China during 2006 [J]. Journal of Safety and Environment, 2007, 7(6): 150—155 [王东宇, 张勇. 2006年中国城市饮用水源突发污染事件统计及分析. 安全与环境学报, 2007, 7(6): 150—155]
[12]Zhang Z S, Huang X F. Methods for Study on Freshwater Plankton [M]. Beijing: Science Press. 1991, 358—371 [章宗涉, 黄祥飞. 淡水浮游生物研究方法. 北京: 科学出版社. 1991, 358—371]
[13]Wang J J. Fauna Sinica of Chinese Freshwater Rotifera [M]. Beijing: Science Press. 1961, 69—254 [王家楫. 中国淡水轮虫志. 北京: 科学出版社. 1961, 69—254]
[14]Jiang X Z, Du N S. Fauna Sinica, Crustacea, Freshwater Cladoceran [M]. Beijing: Science Press. 1979, 86—171 [蒋燮治, 堵南山. 中国动物志(淡水枝角类). 北京: 科学出版社. 1979, 86—171]
[15]Fauna Editorial Committee, Academia Sinica. Fauna Sinica, Crustacea, Freshwater Copepoda [M]. Beijing: Science Press. 1979, 60—420 [中国科学院动物研究所甲壳动物研究组编. 中国动物志(淡水桡足类) . 北京: 科学出版社. 1979, 60—420]
[16]Chen X M. Biomass calculation of freshwater Copepoda [J]. Acta Hydrobiologica Sinica, 1981, 7(3): 397—408 [陈雪梅. 淡水桡足类生物量的测算. 水生生物学集刊, 1981, 7(3): 397—408]
[17]Brucet S, Boix D, Lopez-Flores R, et al. Size and species diversity of zooplankton communities in fluctuating Mediterranean salt marshes [J]. Estuarine, Coastal and Shelf Science, 2006, 67(3): 424—432
[18]Wang M C, Liu X Q, Zhang J H. Evaluate method and classification standard on lake eutrophication [J]. Environmental Monitoring in China, 2002, 18(5): 47—49 [王明翠, 刘雪芹, 张建辉. 湖泊富营养化评价方法及分级标准. 中国环境监测, 2002, 18(5): 47—49]
[19]Tang Q Y, Feng M G. DPS Data Processing System-Experimental Design, Statistical Analysis and Data Mining [M]. Beijing: Science Press. 2002, 636—644 [唐启义, 冯明光. DPS数据处理系统-实验设计、统计分析及数据挖掘. 北京: 科学出版社. 2002, 636—644]
[20]Wang X H, Wang T, Lin Q Q, et al. Specific composition and structure of meta-zooplankton community in a pumbped storage reservoir, South China [J]. Acta Ecologica Sinica, 2009, 29(1): 456—465 [王晓辉, 望甜, 林秋奇, 等. 华南地区典型抽水型水库后生浮游动物群落的种类组成与结构. 生态学报, 2009, 29(1): 456—465]
[21]Xu H Y, Yu H Y, Han M C, et al. Characteristics of zooplankton community and their association with environmental factors in the drinking water sources, Zhejiang Province, China [J]. Acta Ecologica Sinica, 2015, 35(21): 7219—7228 [徐杭英, 于海燕, 韩明春, 等. 浙江饮用水源地浮游动物群落特征及环境响应. 生态学报, 2015, 35(21): 7219—7228]
[22]Van Egeren S J, Dodson S I, Torke B, et al. The relative significance of environmental and anthropogenic factors affecting zooplankton community structure in Southeast Wisconsin Till Plain lakes [J]. Hydrobiologia, 2011, 668(1): 137—146
[23]Zhu J Y, Lu K H, Pan J H. Progress in the effect of Microcystis bloom on freshwater zooplankton rotifer and cladoceran [J]. Journal of Fishery Sciences of China, 2008, 15(2): 367—375 [朱津永, 陆开宏, 潘洁慧. 微囊藻水华对淡水浮游动物轮虫和枝角类影响的研究进展.中国水产科学, 2008, 15(2): 367—375]
[24]Symons C C, Arnott S E, Sweetman J N. Grazing rates of crustacean zooplankton communities on intact phytoplankton communities in Canadian Subarctic lakes and ponds [J]. Hydrobiologia, 2012, 694(1): 131—141
[25]Luis M B, Leo C F, Luiz F M. Zooplankton assemblage concordance patterns in Brazilian reservoirs [J]. Hydrobiologia, 2008, 598(1): 247—255
[26]Ning J J, Liu H, Gu B H, et al. Carbon and nitrogen stable isotope characteristics of particulate organic matter and zooplankton in Liuxihe Reservoir [J]. Acta Ecologica Sinica, 2012, 32(5): 1502—1509 [宁加佳, 刘辉, 古滨河,等. 流溪河水库颗粒有机物及浮游动物碳、氮稳定同位素特征. 生态学报, 2012, 32(5): 1502—1509]
[27]Lin Q, Jin X S, Guo X W, et al. Study on the structure and energy flow of theYangtze River Estuary and adjacent waters ecosystem based on ecopath model [J]. Journal of Hydroecology, 2009, 2(2): 28—36 [林群, 金显仕,郭学武, 等. 基于Ecopath模型的长江口及毗邻水域生态系统结构和能量流动研究. 水生态学杂志, 2009, 2(2): 28—36]
A PRELIMINARY STUDY ON SIZE DIVERSITY OF ZOOPLANKTON AND THEIR ASSOCIATION WITH TROPHIC LEVEL IN THE DRINKING WATER SOURCES, ZHEJIANG PROVINCE
XU Hang-Ying1,3, YU Hai-Yan1, YU Jian1, HAN Ming-Chun1, XU Zhi-Huan2, LI Gong-Guo2and HUANG Yi3
(1. Zhejiang Environment Monitoring Center, Hangzhou 310000, China; 2. Zhejiang Provincial Top Key Discipline of Biological Engineering, Zhejiang Wanli University, Ningbo 315100, China; 3. College of Environmental Sciences and Engineering, Peking University, Beijing 100871, China)
In order to understand the size diversities of the zooplankton community and response characteristics of the comprehensive water bodies by trophic level index (TLIc value), a seasonal investigation was conducted on zooplankton size diversities from two types of 16 drinking water sources (H1-H8 for rivers, K1-K8 for reservoirs) from January to October 2011 in Zhejiang Province. The results showed that seasonal variations in the biovolume density of zooplankton from high to low were January (0.681 mL/L), April (0.443 mL/L), October (0.252 mL/L), and July (0.229 mL/L). The first dominant species of January, April, July, and October were Sinocalanus dorrii, Asplanchna sp., Thermocyclops dybowskii, and Bosmina longirostris respectively. Zooplankton were mainly Rotifera (44.6%) and Cladocera (23.4%) in the rivers by their biological volume, while Calanoida (39.5%) and Rotifera (29.0%) in the reservoirs. There were significant relationships between lg 10 transformed zooplankton/phytoplankton biomass ratio [lg (ZB∶PB)] and size diversities (P<0.01) or species diversities (P<0.05) of zooplankton in the drinking water sources during summer and autumn, and crustacean zooplankton size diversity index was significantly positive correlated with lg (ZB∶PB) (R2=0.77) in the reservoirs. Crustaceans size diversity (P<0.01) were more reliable to TLIc value of the rivers than the species diversity during summer and autumn, supported by the useful information amplification from the numbers of crustaceans (ind./L) converting into biovolume density (mL/L).
Rivers; Reservoirs; Zooplankton; Size diversity index; TLIc value
Q145+.2
A
1000-3207(2017)02-0407-07
10.7541/2017.50
2015-08-03;
2016-06-28
浙江省自然科学基金青年基金(Q13C030015); 浙江省重中之重学科开放基金(KF2016003)资助 [Supported by the Zhejiang Province Science Foundation for Youths (Q13C030015); the Open Foundation of Zhejiang Provincial Top Key Discipline (KF2016003)]
徐杭英(1985—), 女, 浙江杭州人; 硕士研究生, 工程师; 主要从事水域环境保护研究。E-mail: xinxinxhy@163.com
李共国, E-mail: ligongguo@tom.com; 黄艺, E-mail: yhuang@pku.edu.cn
