有氧运动训练和摄食对中华倒刺鲃幼鱼力竭运动后代谢特征的影响
2017-04-12李秀明袁建明张耀光付世建
李秀明袁建明,张耀光付世建
(1. 重庆师范大学进化生理与行为学实验室, 重庆市动物生物学重点实验室, 重庆 401331; 2. 西南大学淡水鱼类资源与生殖发育教育部重点实验室, 重庆 400715; 3. 重庆市水产技术推广站, 重庆 400020)
有氧运动训练和摄食对中华倒刺鲃幼鱼力竭运动后代谢特征的影响
李秀明1,2袁建明2,3张耀光2付世建1
(1. 重庆师范大学进化生理与行为学实验室, 重庆市动物生物学重点实验室, 重庆 401331; 2. 西南大学淡水鱼类资源与生殖发育教育部重点实验室, 重庆 400715; 3. 重庆市水产技术推广站, 重庆 400020)
为了探讨有氧运动训练和摄食对中华倒刺鲃(Spinibarbus sinensis)幼鱼力竭运动后代谢特征的影响, 在(25±0.5)℃条件下, 将120尾实验鱼[体重(21.35±0.05) g, 体长(10.21±0.03) cm]随机分成4组, 即: 对照组、1、2和4 BL/s (体长/秒, body length/s)训练组, 分别放置于不同流速下处理8周。随后测定各实验组心脏和鳃指数以及禁食或摄食(轻度麻醉灌喂体重1.5%的饵料)状态下的力竭运动后过量耗氧。结果发现: 4 BL/s训练组的心脏和鳃指数都显著高于其他实验组(P<0.05); 无论摄食与否, 3个训练组运动前代谢率都显著高于对照组(P=0.001), 而各实验组过量耗氧均没有显著差异; 在禁食状态下, 仅4 BL/s训练组的运动代谢峰值和代谢率增量显著高于对照组, 而在摄食状态下, 3个训练组的运动代谢峰值和代谢率增量均显著高于对照组(P<0.005)。与禁食组相比, 摄食导致各处理组的运动前代谢率显著上升(P<0.001), 但对运动代谢峰值没有显著影响; 另外, 摄食对照组代谢率增量和力竭运动后过量耗氧显著低于禁食对照组(P<0.05)。研究表明: (1)有氧运动训练显著提高了中华倒刺鲃幼鱼的有氧代谢能力, 这可能与其呼吸和循环系统功能的改善有关; (2)力竭运动能够诱导出中华倒刺鲃幼鱼的最大有氧代谢率; (3)摄食削弱了中华倒刺鲃幼鱼无氧代谢能力。
有氧运动训练; 摄食; 运动后过量耗氧; 代谢率; 中华倒刺鲃
由于鱼类具有逆流游泳的习性, 因此是运动训练研究的理想对象[1]。根据对氧气的需求与否, 鱼类的运动训练可以分为持续的有氧运动训练和间歇性的无氧运动训练两种类型[2]。鱼类在剧烈运动期间通过增加耗氧率来满足其能量需求, 为了偿还“氧债”其运动后耗氧率往往显著高于运动前水平,这种运动后恢复期间超过运动前耗氧水平的耗氧量称之为运动后过量耗氧(Excess post-exercise oxygen consumption, EPOC)[3,4]。力竭运动后的EPOC大小(EPOC magnitude)是鱼类暴发游泳和无氧代谢能力的重要评价指标, 而EPOC峰值能够反映某些鱼类的最大有氧代谢能力[5,6], 这些能力与其捕食和避敌等生命活动密切相关。因此, 鱼类EPOC特征一直受到广泛的关注[3,4,7,8]。研究发现,鱼类EPOC特征不仅与其种类相关, 而且还受到各种生态因素的显著影响[9,10]。由于受到季节交替和人类活动干预等因素的影响, 鱼类经常会面临水流速度变动的环境, 进而形成各种相应的生理生态适应策略。摄食和运动都是鱼类重要的生理活动, 由于呼吸和循环系统功能的限制, 当两者同时进行时可能会出现对氧气需求的竞争[11,12]。目前, 有关水流变动和摄食对鱼类有氧运动能力及其代谢特征的影响有较多报道[11—13], 但对其无氧运动代谢能力影响的研究报道相对较少[9]。
中华倒刺鲃(Spinibarbus sinensis)属于鲤形目,鲤科, 是一种长江中上游重要的经济鱼类, 喜欢生活在江河底层的激流环境中[14]。目前其生长、运动和繁殖等方面的研究已有大量报道[13,15,16], 但其EPOC及其影响因素的研究还未见报道。本研究以中华倒刺鲃幼鱼为实验对象, 探讨了不同流速下有氧运动训练和摄食消化过程对其EPOC的影响, 揭示其运动生理适应策略以及摄食和运动的代谢竞争模式, 为其资源保护和生产实践提供必要的基础数据。
1 材料与方法
1.1 实验材料
实验对象中华倒刺鲃幼鱼购买于重庆市合川鱼种场。在实验室室内水泥池(2000 L)中暂养4周,用浮性颗粒饲料[通威公司, 饲料粗脂肪、粗蛋白质、碳水化合物和灰分比例分别为: (8.5±0.5)%、(41.2±0.9)%、(25.7±1.2)%和(12.3±0.4)%]每天饱食投喂两次(09:00和18:00), 每天用曝气24h后的自来水更换10%左右的养殖用水, 养殖水体温度控制在(25±0.5)℃左右, 养殖水体溶氧控制在接近饱和(8 mg/L左右), 采用12L∶12D光周期制度。
1.2 实验方案
在暂养期结束后, 随机挑选健康且大小相当的实验鱼120尾[体重(21.35±0.05) g, 体长(10.21±0.03) cm]放置于自制“鱼类游泳运动训练仪”(仪器描述详见文献[16])中进行不同水流速度下的有氧运动训练处理。将MS-222(3-氨基苯甲酸乙酯甲基磺酸盐, 50 mg/L)轻度麻醉后的实验鱼随机分成4个实验组,即: 对照组、1、2和4 BL/s (体长/秒, body length/s)训练组, 并分别放置于微水流 (约3 cm/s左右)、1 BL/s (约10 cm/s)、2 BL/s (约20 cm/s)和4 BL/s (约40 cm/s)流速的水道(每个水道30尾实验鱼)中。有氧运动训练处理历时8周。每隔2周测定一次鱼体体长, 并据此调整一次水流速度。其他实验条件如投喂制度、水体溶氧和水温等与暂养期间相同。
在训练周期结束后, 从每个实验组中随机挑选10尾实验鱼进行心脏指数和鳃指数的测定。另外再从各实验组中随机挑选16尾实验鱼(其中8尾作禁食处理, 另外8尾作摄食处理)单独放入鱼类代谢仪的呼吸室内驯化1d。禁食的实验鱼用溶氧仪(HQ30d, HACH, USA)测定其耗氧率作为其运动前代谢率(耗氧率测定方法见后)。由于实验鱼在鱼类代谢仪的呼吸管中不会主动摄食, 且我们先前的研究表明, 轻度麻醉灌喂不会对中华倒刺鲃幼鱼的耗氧率测定产生显著影响[16], 因此本实验采用国内外鱼类研究广泛接受的麻醉灌喂方法进行摄食处理。摄食的实验鱼麻醉灌喂1.5%体重的糊状饵料(浮性颗粒饲料和水的混合比例为1∶1.5, 麻醉灌喂操作详见参考文献[16, 17])。灌喂后3.5h对实验鱼进行耗氧率测定(先前研究发现此时为实验鱼摄食代谢峰值出现时间[16]), 作为其运动前代谢率。随后对禁食或摄食处理的实验鱼进行力竭性运动并测定其运动恢复过程中耗氧率反应。EPOC测定具体操作如下[8]: 运动前代谢率测定结束后, 将单尾实验鱼放入环形水道(水体体积约120 L, 水流速度约65 cm/s)中用手进行追赶使其达到力竭状态(通常为失去平衡或触碰鱼体时不再有应激反应, 在追赶2—3min内达到力竭状态), 随后立即将实验鱼放回呼吸室(0.2 L)中并计时, 在力竭运动后1、2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、45、50、55和60min分别测定其耗氧率。呼吸室的流速设定为0.85 L/min左右, 据相关公式[18]计算, 呼吸室水体置换99%在1min内即可完成, 能够满足测定实验鱼的最大运动代谢水平的要求。
1.3 指标测量与参数计算
为了考察有氧运动训练对中华倒刺鲃幼鱼心脏和鳃指数的影响, 将实验鱼放入装有过量麻醉剂(MS-222, 200 mg/L)的容器中麻醉致死。待称量体重后将其心脏和鳃完整取出, 在鱼用生理盐水中漂洗干净后用吸水纸将其水分吸干, 用微量天平称量(精确至0.0001 g)。心脏和鳃指数计算公式如下[7]:
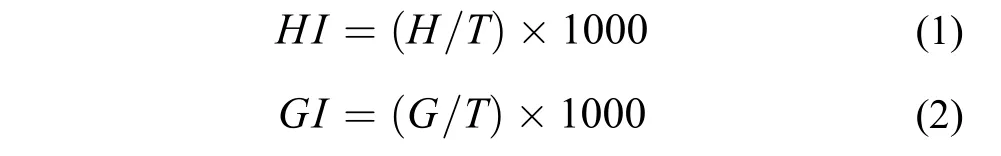
公式中HI表示心脏指数(‰), GI表示鳃指数(‰), H表示心脏重量(g), G表示鳃重量(g), T表示鱼体重量(g)。
实验鱼耗氧率(作为其代谢率指标)的测定采用自主研制的鱼类代谢仪[19]完成。实验鱼耗氧率计算公式如下:
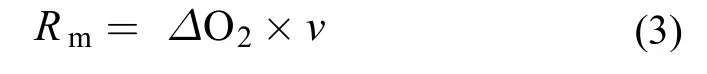
公式中Rm表示单尾鱼耗氧率(mg O2/h),ΔO2表示装有实验鱼呼吸室和没有实验鱼呼吸室(对照呼吸室)之间的溶氧差值(mg O2/L, 溶氧值用溶氧仪测量呼吸室出水口水中溶氧得到), v表示呼吸室的流速(L/h, 由呼吸室出水口1min内出水量称重得到)。为了消除个别鱼体重差异较大造成的影响, 用0.75作为体质量系数将单尾鱼耗氧率标准化为1 kg体质量[16,19]。校正后耗氧率计算公式如下:
44 Prevalence and risk factors of chronic kidney disease in high-risk population in Minhang District of Shanghai

公式中Rs表示标准体重耗氧率[mg O2/(kg·h)],Rm同(3)式, m表示鱼体体质量(kg)。
相关参数定义如下: (1)运动前代谢率[mg O2/ (kg·h)]是指实验鱼力竭运动前的代谢率; (2)运动代谢峰值[mg O2/(kg·h)]是指实验鱼在力竭运动后恢复过程中观察到的最大代谢率; (3)代谢率增量[mg O2/ (kg·h)]是指力竭运动前代谢率和力竭运动后代谢峰值之间的差值; (4)过量氧耗(mg O2/kg)是指实验鱼在力竭运动后恢复过程中各个时间点高于运动前代谢率的差值在时间上的积分。
1.4 数据处理和统计分析
所有实验数据用EXCELL (2007)进行常规计算, 用平均值±标准误(Mean±SE)表达, 显著性水平为P<0.05, 统计分析采用SPSS 17.0软件进行。有氧运动训练和摄食对EPOC参数的影响采用双因素方差分析(ANOVA)。有氧运动训练对所有参数的影响采用单因素方差分析, 若差异显著则进行多重比较(LSD法)。摄食对EPOC参数的影响采用T-Test分析。
2 结果
2.1 体重、心脏指数和鳃指数
实验鱼的体重在对照组和各个训练组之间没有显著性差异(表 1)。4 BL/s训练组的心脏指数(0.99‰)分别比对照组、1和2 BL/s训练组显著提高了10.7%、11.5%和12.5% (分别为0.89‰、0.88‰和0.87‰)(P<0.05)(图 1a)。4 BL/s训练组的鳃指数(11.1‰)分别比对照组、1和2 BL/s训练组显著提高了7.0%、9.2%和7.5%(分别为10.3‰、10.1‰和10.3‰)(P<0.05)(图 1b)。
2.2 力竭运动前代谢率
在禁食状态下, 1、2和4 BL/s训练组的运动前代谢率[分别为65.5、63.6和62.1 mg O2/(kg·h)]分别比对照组[52.1 mg O2/(kg·h)]显著提高了25.7%、22.1%和19.2%; 在摄食状态下, 1、2和4 BL/s训练组的运动前代谢率[分别为103.9、105.9和111.8 mg O2/(kg·h)]分别比对照组[87.4 mg O2/(kg·h)]显著提高了18.9%、21.2%和27.9%(P=0.001)(表 1); 摄食状态下对照组、1、2和4 BL/s训练组的运动前代谢率分别显著高于禁食状态下对照组、1、2和4 BL/s训练组(P<0.001)(表 1)。摄食和运动对力竭运动前代谢率没有交互作用(表 1)。
2.3 力竭运动后代谢率特征
在力竭运动后, 所有组的代谢率都迅速上升达到峰值, 随后急剧下降并逐步恢复到运动前水平(图 2)。在禁食状态下, 4 BL/s训练组的运动后代谢峰值[337.3 mg O2/(kg·h)]显著高于对照组[290.2 mg O2/(kg·h)]; 在摄食状态下, 1、2和4 BL/s训练组的运动后代谢峰值[分别为339.1、343.6和374.9 mg O2/(kg·h)]显著高于对照组[288.9 mg O2/(kg·h)] (P<0.001)(表 1); 摄食状态下对照组、1、2和4 BL/s训练组的运动后代谢峰值与禁食状态下对照组、1、2和4 BL/s训练组无显著性差异(表 1)。摄食和运动对运动后代谢峰值没有交互作用(表 1)。

表 1 有氧运动训练和摄食对中华倒刺鲃幼鱼力竭运动后代谢率的影响(平均值±标准误)Tab. 1 The effect of aerobic exercise and feeding on excess post-exercise oxygen consumption (EPOC) response in juvenile Spinibarbus sinensis (Mean±SE)

图 1 有氧运动训练对中华倒刺鲃幼鱼心脏和鳃指数的影响(平均值±标准误)Fig. 1 The effects of aerobic exercise on the heart and gill indexes in juvenile Spinibarbus sinensis (Mean±SE)
在禁食状态下, 4 BL/s训练组的代谢率增量[279.2 mg O2/(kg·h)]显著高于对照组[236.7 mg O2/(kg·h)]; 在摄食状态下, 1、2和4 BL/s训练组的代谢率增量[分别为235.2、237.3和263.3 mg O2/ (kg·h)]显著高于对照组[201.5 mg O2/(kg·h)](P= 0.002)(表 1); 在摄食状态下对照组的代谢率增量显著低于禁食状态下对照组(P=0.022)(表 1)。摄食和运动对代谢率增量没有交互作用(表 1)。
不论是禁食还是摄食状态, 对照组、1、2和4 BL/s训练组的过量耗氧之间都没有显著差异(表1); 在摄食状态下对照组的过量耗氧(73.7 mg O2/kg)显著降低于禁食状态下对照组(102.2 mg O2/kg) (P=0.001), 但在摄食状态下1、2和4 BL/s训练组的过量耗氧分别与禁食状态下1、2和4 BL/s训练组无显著性差异(表 1)。摄食和运动对过量耗氧没有交互作用(表 1)。
3 讨论
3.1 有氧运动训练对中华倒刺鲃幼鱼力竭运动后代谢特征的影响
在禁食状态下的运动前代谢率主要反映动物维持体液循环、蛋白质合成和渗透压调节等基本生命活动的最低能量需求, 在一些文献中也称为维持代谢率[20]。持续的有氧训练通常导致哺乳动物禁食状态下的运动前代谢率的显著上升[21]。不过有氧运动训练对鱼类禁食状态下的运动前代谢率的影响并没有得到一致性的结论。比如虹鳟(Oncorhynchus mykiss)[22]、黄尾(Seriola lalandi)[23]和斑马鱼(Danio rerio)[24]有氧运动训练后其在禁食状态下的运动前代谢率分别表现为下降、上升和不变。本研究发现, 不同强度的有氧运动训练都显著提高了中华倒刺鲃幼鱼的维持代谢耗能(表 1), 这与我们以往的研究结果相一致[16]。然而无氧运动训练并没有引起中华倒刺鲃幼鱼禁食状态下的运动前代谢率的显著变化[25]。因此, 运动训练对鱼类禁食状态下的运动前代谢率的影响可能不仅与其种类相关, 还受到训练方式的影响。
本研究发现, 通过力竭运动诱导的中华倒刺鲃幼鱼代谢峰值[大约290—330 mg O2/(kg·h)]与有氧运动(持续游泳)诱导的最大代谢率[大约300 mg O2/(kg·h)]相似[13], 因此可以作为其最大有氧代谢能力的评价指标。高强度有氧运动训练(4 BL/s)导致中华倒刺鲃幼鱼禁食状态下运动代谢峰值显著提高(表 1), 这种结果与虹鳟[26]和大鳞大马哈鱼(Oncorhynchus tshawytscha)[27]的研究结果相似。鱼类的有氧代谢能力与其呼吸和循环系统功能密切相关,心脏和鳃功能的改善将有利于鱼类对氧气的吸收和转运[27]。因此, 有氧运动训练后中华倒刺鲃幼鱼心脏和鳃功能的显著提高可能是促进其有氧代谢能力增加的重要原因(图 1a、1b)。这与运动训练后瓦氏黄颡鱼(Peltebagrus vachelli)的研究结果相似[7]。此外, 本研究还发现, 在摄食状态下, 不同强度的有氧运动训练都显著提高了中华倒刺鲃幼鱼的运动代谢峰值, 这可能与摄食导致运动前代谢率的显著提高有关(表 1)。
一般认为, 持续的有氧运动训练能够提高鱼类的有氧运动能力, 而无氧运动训练则有利于改善其无氧运动能力[1]。有氧运动训练能够影响鱼类磷酸肌酸的还原、儿茶酚胺和皮质醇等激素的释放以及乳酸清除速率, 这些因素与EPOC大小密切相关,进而可能影响鱼类无氧运动及其代谢能力[1,28]。不过有关有氧运动训练对鱼类无氧运动及其代谢能力的研究鲜有报道。本研究发现, 不同强度的有氧运动训练都没有对中华倒刺鲃幼鱼的EPOC大小产生显著影响, 表明其无氧代谢能力并没有改善。目前为止, 无氧运动训练对鱼类无氧运动能力的影响也没有得到一致的结论。比如无氧运动训练促进代谢产物的转化提高了锦鲫(Carassius auratus)的无氧运动能力[29], 但却没有对瓦氏黄颡鱼和南方鲇(Silurus meridionalis)的EPOC的大小产生显著影响[7,30]。由此表明, 运动训练对鱼类无氧运动能力的影响可能与其种类相关。更多有氧运动训练对不同习性鱼类EPOC大小的影响及其生理生化机制研究可能有利于揭示其内在原因。
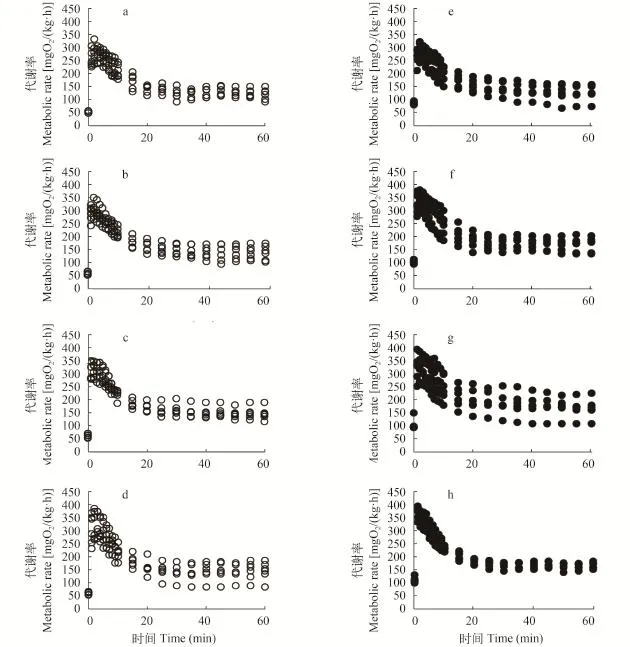
图 2 有氧运动训练和摄食对中华倒刺鲃幼鱼力竭运动后代谢反应的影响Fig. 2 The effect of aerobic exercise and feeding on excess post-exercise oxygen consumption response in juvenile Spinibarbus sinensis平均值±标准误, a. 对照禁食组; b. 1 BL/s训练禁食组; c. 2 BL/s训练禁食组; d. 4 BL/s训练禁食组; e. 对照摄食组; f. 1 BL/s训练摄食组; g. 2 BL/s训练摄食组; h. 4 BL/s训练摄食组Mean±SE, a. control group in the fasting treatment; b. 1 BL/s exercise group in the fasting treatment; c. 2 BL/s exercise group in the fasting treatment; d. 4 BL/s exercise group in the fasting treatment; e. control group in the fed treatment; f. 1 BL/s exercise group in the fed treatment; g. 2 BL/s exercise group in the fed treatment; h. 4 BL/s exercise group in the fed treatment
3.2 摄食对中华倒刺鲃幼鱼力竭运动后代谢特征的影响
由于消化、吸收和同化等生理过程的能量支出增加, 摄食通常会显著提高动物的代谢率[31]。本研究发现, 摄食导致中华倒刺鲃幼鱼运动前代谢率显著提高(表 1), 这与以往关于中华倒刺鲃等许多鱼类摄食后代谢的研究结果相似[9,16,19]。
从理论上来说, 由于循环和呼吸系统等的限制,每种动物都存在一个潜在的最大代谢率, 它是动物进行各种生理活动的有效代谢空间。在鱼类的生活史中, 摄食和运动这两种生理活动经常同时发生,因此, 不同鱼类表现出不同的代谢分配模式[11,12]。以往的研究发现, 摄食和运动同时发生才能诱导出鲤鱼(Cyprinus carpio)的最大代谢率, 表明其代谢空间能够在一定程度上同时满足摄食和运动两种生理功能的代谢需求, 表现为代谢“添加模式”[12]。本研究发现, 单独的运动诱导中华倒刺鲃幼鱼的最大代谢率[禁食状态下对照组的运动代谢峰值, 290.2 mg O2/(kg·h)]显著高于单独摄食诱导的最大代谢率[摄食状态下对照组的运动前代谢率, 87.4 mg O2/(kg·h)],与摄食和运动同时诱导的最大代谢率[在摄食状态下对照组的运动代谢峰值, 288.9 mg O2/(kg·h)]相当。由此表明, 当摄食和运动两种生理功能同时进行时, 二者在能量代谢水平上可能表现出“竞争模式”。这与草鱼(Ctenopharyngodon idellus)的研究结果相似, 可能与其鳃的摄氧能力以及循环系统的输氧能力的限制有关[9]。
以往的研究发现, 摄食导致南方鲇和鲇(Silurus asotus)等拥有较高消化代谢能力鱼类EPOC大小显著降低, 而没有对草鱼和瓦氏黄颡鱼等拥有较低消化代谢能力鱼类的EPOC大小产生显著影响,因此研究者认为摄食对鱼类无氧代谢能力的影响可能与其消化代谢能力的高低有关[8,9]。本研究发现, 中华倒刺鲃幼鱼最大摄食量(1.5%体重水平)和摄食代谢峰值[摄食状态下对照组的运动前代谢率, 87.4 mg O2/(kg·h)]都较低, 暗示其消化代谢能力较低。不过, 摄食对其EPOC大小却产生了负面影响(表 1)。由于EPOC的组成成分较为复杂, 不仅涉及到氧气的摄入与转运, 还与乳酸和糖原代谢以及渗透压调节等因素相关[5], 因此, 摄食对中华倒刺鲃幼鱼EPOC产生显著影响的具体原因有待进一步研究。
[1]Davison W. The effects of exercise training on teleost fish, a review of recent literature [J]. Comparative Biochemistry and Physiology, 1997, 117(1): 67—75
[2]Pearson M P, Spriet L L, Stevens E D. Effect of sprint training on swim performance and white muscle metabolism during exercise and recovery in rainbow trout (Salmo gairdneri) [J]. Journal of Experimental Biology, 1990, 149(1): 45—60.
[3]Børsheim E, Bahr R. Effect of exercise intensity, duration and mode on post-exercise oxygen consumption [J]. Sports Medicine, 2003, 33(14): 1037—1060
[4]Gaesser G A, Brooks G A. Metabolic bases of excess post-exercise oxygen consumption: a review [J]. Medicine and Science in Sports and Exercise, 1984, 16(1): 29—43
[5]Kieffer J D, Wakefield A M, Litvak M K. Juvenile sturgeon exhibit reduced physiology responses to exercise [J]. Journal of Experimental Biology, 2001, 204(24): 4281—4289
[6]Cutts C J, Metcalfe N B, Taylor A C. Juvenile Altantic salmon (Salmo salar) with relatively high standard metabolic rates have small metabolic scopes [J]. Functional Ecology, 2002, 16(1): 73—78
[7]Liu Y, Cao Z D, Fu S J, et al. The effect of exhaustive chasing training and detraining on swimming performance in juvenile darkbarbel catfish (Peltebagrus vachelli) [J]. Journal of Comparative Physilolgy B, 2009, 179(7): 847—855
[8]Li K G, Cao Z D, Fu S J. Effect of feeding on excess post-exercise oxygen consumption in juvenile Chinese catfish (Silurus asotus Linnaeus) [J]. Acta Hydrobiologica Sinica, 2012, 36(6): 1036—1040 [李可贵, 曹振东,付世建. 摄食对鲇鱼幼鱼力竭性运动后过量耗氧的影响. 水生生物学报, 2012, 36(6): 1036—1040]
[9]Fu S J, Zeng L Q, Li X M, et al. Effect of meal size on excess post-exercise oxygen consumption in fishes with different locomotive and digestive performance [J]. Journal of Comparative Physiology B, 2009, 179(4): 509—517
[10]Zeng L Q, Zhang Y G, Cao Z D, et al. Effect of temperature on excess post-exercise oxygen consumption in juvenile southern catfish (Silurus meridionalis Chen) following exhaustive exercise [J]. Fish Physiology and Biochemistry, 2010, 36(4):1243—1252
[11]Li X M, Cao Z D, Peng J L, et al. The effect of exercise training on the metabolic interaction between digestion and locomotion in juvenile darkbarbel catfish (Peltebagrus vachelli) [J]. Comparative Biochemistry and Physiology A, 2010, 156(1): 67—73
[12]Pang X, Cao Z D, Fu S J. The effects of temperature on metabolic interaction between digestion and locomotion in juveniles of three cyprinid fish (Carassius auratus, Cyprinus carpio and Spinibarbus sinensis) [J]. Comparative Biochemistry and Physiology A, 2011, 159(3): 253—260
[13]Pang X, Yuan X Z, Cao Z D, et al. The effects of temperature and exercise training on swimming performance in juvenile qingbo (Spinibarbus sinensis) [J]. Journal of Comparative Physiology B, 2013, 183(1): 99—108
[14]Cai Y Z, He C R, Cai Y Q, et al. A primary study of biology of Spinibarbus sinensis Bleeker [J]. Freshwater Fisheries, 2003, 33(3): 16—18 [蔡焰值, 何长仁, 蔡烨强,等. 中华倒刺鲃生物学初步研究. 淡水渔业, 2003, 33(3): 16—18]
[15]Cai Y Z, Cai Y Q, He C R. Experiments on artificial propagation of Spinibarbus sinensis [J]. Freshwater Fisheries, 2005, 35(1): 35—38 [蔡焰值, 蔡烨强, 何长仁. 中华倒刺鲃人工繁殖技术研究. 淡水渔业, 2005, 35(1): 35—38]
[16]Li X M, Yu L J, Wang C, et al. The effect of aerobic exercise training on growth performance, digestive enzyme activities and postprandial metabolic response in juvenile qingbo (Spinibarbus sinensis) [J]. Comparative Biochemistry and Physiology A, 2013, 166(1): 8—16
[17]Li X M , Yuan J M , Zeng L Q, et al. The effects of aerobic exercise on gut evacuation of juvenile qingbo (Spinibarbus sinensis) and the associated mathematical models [J]. Acta Hydrobiologica Sinica, 2015, 39(5): 1012—1018 [李秀明, 袁建明, 曾令清, 等. 有氧运动训练对中华倒刺鲃幼鱼肠道排空及其数学模型选择的影响. 水生生物学报, 2015, 39(5): 1012—1018]
[18]Steffensen J F. Some errors in respirometry of aquatic breathers: how to avoid and correct for them [J]. Fish Physiology and Biochemistry, 1989, 6(1): 49—59
[19]Fu S J, Cao Z D, Peng J L. Effect of meal size on postprandial metabolic response in Chinese catfish (Silurus asotus Linnaeus) [J]. Journal of Comparative Physiology B, 2006, 176(5): 489—495
[20]Johnston I A. Growth and metabolism in Antarctic fish [J]. Antarctic Special Topic, 1993, 141—150
[21]Speakman J R, Selman C. Physical activity and resting metabolic rate [J]. Proceedings of the Nutrition Society, 2003, 62(3): 621—634
[22]Skov P V, Larsen B K, Frisk M, et al. Effects of rearing density and water current on the respiratory physiology and haematology in rainbow trout, Oncorhynchus mykiss at high temperature [J]. Aquaculture, 2011, 319(3—4): 446—452
[23]Brown E J, Bruce M, Pether S, et al. Do swimming fish always grow fast? Investigating the magnitude and physiological basis of exercise-induced growth in juvenile New Zealand yellowtail kingfish, Seriola lalandi [J]. Fish Physiology and Biochemistry, 2011, 37(2): 327—336
[24]Bagatto B, Pelster B, Burggren W W. Growth and metabolism of larval zebrafish: effects of swim training [J]. Journal of Experimental Biology, 2001, 204(24): 4335— 4343
[25]Li X M, Yu L J, Cao Z D, et al. The effects of exhaustive chasing training on the growth performance and postprandial metabolic response in juvenile qingbo (Spinibarbus sinensis) and rock carp (Procypris rabaudi) [J]. Freshwater Fisheries, 2013, 43(1): 63—68 [李秀明, 于丽娟,曹振东, 等. 力竭追赶训练对两种鲤科鱼类生长和摄食代谢的影响. 淡水渔业, 2013, 43(1): 63—68]
[26]McKenzie D J, Höglund E, Dupont-Prinet A, et al. Effects of stocking density and sustained aerobic exercise on growth, energetics and welfare of rainbow trout [J]. Aquaculture, 2012, 338: 216—222.
[27]Gallaugher P E, Thorarensen H, Kiessling A, et al. Effects of high intensity exercise training on cardiovascular function, oxygen uptake, internal oxygen transport and osmotic balance in chinook salmon (Oncorhynchus tshawytscha) during critical speed swimming [J]. The Journal of Experimental Biology, 2001, 204(16): 2861—2872
[28]Young P S, Cech J J. Effects of exercise conditioning on stress responses and recovery in cultured and wild youngof-the-year striped bass, Morone saxatilis [J]. Canadian Journal of Fisheries and Aquatic Sciences, 1993, 50(10): 2094—2099
[29]Xia W, Fu S J, Peng J L, et al. The effect of exhaustive exercise training on the anaerobic metabolism for juvenile crucian carp [J]. Journal of Chongqing Normal University (Natural Science), 2011, 28(4): 16—22 [夏伟, 付世建, 彭姜岚, 等. 力竭运动训练对锦鲫幼鱼无氧代谢能力的影响. 重庆师范大学学报(自然科学版), 2011, 28(4): 16—22]
[30]Cao Z D, Fu S J. The Effect of exhaustive exercise training and fasting on post-exercise oxygen consumption rate in southern catfish (Silurus meridionalis Chen) [J]. Acta Hydrobiologica Sinica, 2009, 33(5): 837—843
[31]McCue M D. Specific dynamic action: a century of investigation [J]. Comparative Biochemistry and Physiology A, 2006, 144(4): 381—394
THE EFFECT OF AEROBIC EXERCISE TRAINING AND FEEDING ON EXCESS POST-EXERCISE OXYGEN CONSUMPTION IN JUVENILE QINGBO (SPINIBARBUS SINENSIS)
LI Xiu-Ming1,2, YUAN Jian-Ming2,3, ZHANG Yao-Guang2and FU Shi-Jian1
(1. Laboratory of Evolutionary Physiology and Behavior, Chongqing Key Laboratory of Animal Biology, Chongqing Normal University, Chongqing 401331, China; 2. Key Laboratory of Freshwater Fish Reproduction and Development, Ministry of Education, Southwest University, Chongqing 400715, China; 3. Fisheries Technology Extension Station in Chongqing, Chongqing 400020, China)
To investigate the effects of aerobic exercise and feeding on excess post-exercise oxygen consumption (EPOC) in juvenile qingbo (Spinibarbus sinensis), 120 fish [(21.35±0.05) g, (10.21±0.03) cm] were exercised at 25℃under four water velocities, i.e., nearly still water (control), 1 body length (BL)/s, 2 BL/s and 4 BL/s for eight weeks to measure the heart index, gill index and EPOC. The results showed that the heart and gill indexes significantly increased in 4 BL/s training group compared to those in other three groups (P<0.05). Aerobic exercise resulted in a significant increase in the pre-exercise metabolic rate under both feeding and fasting status (P=0.001). There were no differences in the EPOC magnitude of S. sinensis between the exercise groups and control group under both feeding and fasting status. Peak post-exercise metabolic rate and increment of metabolic rate were significantly higher in the 4 BL/s training group than those of the control group under fasting status. Peak post-exercise metabolic rates and increment of metabolic rates were significantly higher in the three exercise groups than those of the control group under feeding status (P<0.005). Feeding resulted in a significantly higher pre-exercise metabolic rate compared to fasting fish under the same water velocity (P<0.001). Peak post-exercise metabolic rate is similar between the feeding and fasting treatment groups with the same water velocity. Feeding led to a significant decrease in the increment of metabolic rate and EPOC magnitude in the control group (P<0.05). Our results suggest that aerobic exercise significantly increased aerobic capacity, which may be related to the improvement of respiratory and circulatory system function, and that exhaustive exercise can induce maximum oxygen consumption rate, and that feeding reduced the anaerobic capacity in juvenile S. sinensis.
Aerobic exercise training; Feeding; Excess post-exercise oxygen consumption; Metabolic rate; Spinibarbus sinensis
Q493
A
1000-3207(2017)02-0277-08
10.7541/2017.34
2015-12-29;
2016-04-17
国家自然科学基金(31302160, 31172096); 高等学校学科创新引智计划(111计划)建设项目(B14037); 中国博士后科学基金(2014M562271); 重庆市科委重大项目(cstc2014yykfC80001); 重庆市基础与前沿研究计划项目(cstc2015jcyjA80007); 重庆市教育委员会科学技术研究项目(KJ1400506); 重庆师范大学基金项目(14XLB001)资助 [Supported by the National Natural Science Foundation of China (31302160, 31172096); the 111 Project (B14037); China Postdoctoral Science Foundation (2014M562271); the Major Projects of Chongqing Science and Technology Committee (cstc2014yykfC80001); the Basic and Frontier Research Project of CQ (cstc2015jcyjA80007); Science and Technology Research Project of Chongqing Education Committee (KJ1400506); the Foundation Project of Chongqing Normal University (14XLB001)]
李秀明(1979—), 男, 重庆市人; 博士; 研究方向为鱼类生理生态和水产养殖。E-mail: lixiuming_441188@126.com
付世建, 教授; E-mail: shijianfu9@hotmail.com
