狂犬病病毒G蛋白的原核表达及反应原性分析
2017-04-12刘运超柴书军陈玉梅张改平
王 攀,刘运超,魏 蔷,柴书军,陈玉梅,张改平,3*
(1.西北农林科技大学 动物医学院,陕西 杨凌 712100; 2.河南省农业科学院 动物免疫学重点实验室/河南省动物免疫学重点实验室/农业部动物免疫学重点实验室,河南 郑州 450002;3.河南农业大学 牧医工程学院,河南 郑州 450002)
狂犬病病毒G蛋白的原核表达及反应原性分析
王 攀1,2,刘运超2,魏 蔷2,柴书军2,陈玉梅2,张改平1,2,3*
(1.西北农林科技大学 动物医学院,陕西 杨凌 712100; 2.河南省农业科学院 动物免疫学重点实验室/河南省动物免疫学重点实验室/农业部动物免疫学重点实验室,河南 郑州 450002;3.河南农业大学 牧医工程学院,河南 郑州 450002)
为优化狂犬病病毒G蛋白的原核表达条件,探究其反应原性,参照狂犬病病毒CTN-1V10株编码G蛋白基因序列,采用生物工程合成的方法合成编码G蛋白的基因片段,并将该片段命名为G5F。将该片段与pET-28a原核表达载体连接,构建重组表达质粒pET-G5F,并将重组质粒进行诱导表达,在IPTG浓度为0.2 mmol/L、温度为20 ℃、诱导12 h时,重组蛋白表达量最高。SDS-PAGE电泳及Western blot分析表明, G5F重组蛋白可溶性表达量高,且可以被抗狂犬病病毒单克隆抗体识别,反应原性良好。
狂犬病病毒; G蛋白; 可溶性表达; 反应原性
狂犬病(rabies)是由狂犬病病毒(rabies virus,RABV)引起的,是最致命的传染病之一,死亡率接近100%[1]。RABV是狂犬病毒属(Lyssavirusgenus)弹状病毒科(Rhabdoviridae family)的单股负链RNA病毒,可引起人类、家畜及野生动物急性脑膜炎而导致死亡,并可在大多数哺乳动物中广泛传播[2]。狂犬病主要通过被RABV感染动物的撕咬、抓挠受伤而感染。我国狂犬病的主要传播源是被RABV感染的狗和猫等[3]。当前,尚无有效的狂犬病治疗方法,及时接种相关的各类狂犬病疫苗可在很大程度上有效控制狂犬病[4]。狂犬病病毒基因组全长约12 kb,编码核蛋白(N)、磷蛋白(P)、基质蛋白(M)、糖蛋白(G)、RNA依赖的RNA聚合酶(L)结构蛋白[5]。其中,RABV G蛋白存在于病毒囊膜内外两侧,形成跨膜结构,在RABV表面形成一些纤突(spikes)[6-8], G 蛋白是RABV唯一暴露在病毒表面的蛋白质及唯一糖基化的蛋白质,同时也是唯一诱导机体产生中和抗体的蛋白质[9]。 研究表明,该蛋白质的抗原区域有8 个抗原结合簇,这8个表位依次是Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ、a和 G1[10]。其中,除Ⅵ和 G1 抗原结合簇外,其他抗原结合簇在RABV灭活后仍然可被检测到。G蛋白具有与细胞表面受体结合以及决定病毒亲嗜神经组织特性等的功能,G蛋白大约含 524 个aa,其N端是由19 个aa组成的信号肽段,这个序列在RABV转录过程中被切去。因此,成熟的G蛋白中不含该区域[11]。成熟的G蛋白含有 505 个aa,其分子质量约为62 ku。G蛋白含3个中和抗原表位,在 RABV 吸附过程中起到重要作用,其通过与细胞表面受体的相互作用而促进快速吸附。G蛋白能激活特异性辅助性T细胞(helper T cells,Th)和细胞毒性T淋巴细胞(cytotoxiclymphocyte,CTL)。研究证实,G蛋白上存在T细胞线性和空间依赖性表位[12]。综上可知,G蛋白可有效诱发机体的免疫反应,尤其是细胞免疫反应。这个特性是后续针对该蛋白质开展相关研究和新型亚单位疫苗研发的重要理论依据。
基因工程亚单位疫苗(subunit vaccine),又称重组亚单位疫苗(recombinat subunit vaccine),是利用现代分子生物学技术和生物工程的方法,将某病毒特定的所需基因片段克隆重组到相应的表达载体中,制备相应的重组质粒,并将其导入特定的所需细胞培养,使目的蛋白大量表达,可将佐剂加入优化表达后的目的蛋白,经乳化设备乳化,制得相应的疫苗。由于此类疫苗只含有病毒的某种或某几种特定抗原,不含其他遗传物质,理论上可以使动物获得保护性免疫。且不含有病毒的感染性组分,无需灭活,致病性风险低,安全性很高[13]。可见,G蛋白既是RABV中最有效的保护性抗原,也是研究基因工程亚单位疫苗的首选抗原。
为了探究G蛋白的相关特性,本研究拟采用大肠杆菌表达系统对狂犬病病毒G蛋白进行优化表达。大肠杆菌是目前应用最广泛的蛋白质表达系统,具有培养操作简单、转化效率高、价格相对经济、生长培养速度快、可大量生产所需蛋白质等优点[14], 一般状况下,其针对外源基因的表达产物水平远远高于其他生物表达系统[15]。本研究中选用的大肠杆菌pET-28a载体,自带6×His标签。His标签基本不改变蛋白质的生物结构及蛋白质的溶解性,同时可以简化蛋白质纯化步骤[16]。鉴于此,本研究在大肠杆菌中表达RABV G蛋白,以期获得具有活性的重组G蛋白,旨在为RABV基因工程亚单位疫苗的研发奠定基础。
1 材料和方法
1.1 载体和目的片段的合成
表达重组载体pET-28a购自Life Seneors公司;大肠杆菌感受态细胞JM109和BL21 (DE3) 购自大连宝生物公司。狂犬病病毒G蛋白基因序列参照大肠杆菌密码子偏爱性进行优化,由生工生物工程(上海)股份有限公司合成,并将该片段命名为G5F。
1.2 主要试剂
NdeⅠ和XholⅠ DNA限制性内切酶购自美国新英格兰生物公司;抗His标签单克隆抗体、辣根过氧化物酶标记的羊抗鼠二抗、RABV单克隆抗体均购自美国Abcam公司;AEC(3-Amino-9ethylcar-bazole)显色试剂盒购自北京中杉金桥公司;IPTG购自INALCO公司;质粒抽提试剂盒购自Omega公司;T4 DNA连接酶、DNA纯化回收试剂盒、Primestar Max DNA聚合酶均购自TaKaRa公司;标准分子质量蛋白质Marker购自索莱宝公司。
1.3 RABV G蛋白基因序列的优化及其表达引物的设计与合成
根据GenBank中公布的狂犬病病毒G蛋白基因序列(AEV43285),按照大肠杆菌密码子偏爱性及mRNA结构等信息优化RABV病毒G蛋白的基因序列,设计表达用引物(表1),由生工生物工程(上海)股份有限公司进行合成。
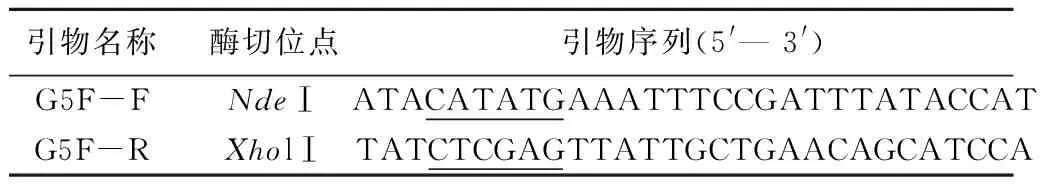
表1 G5F片段的PCR扩增引物
注:下划线为酶切位点。
1.4 原核表达载体的构建
以合成的G5F片段为模板、G5F-F/G5F-R为引物进行PCR扩增,反应条件为:95 ℃预变性3 min; 95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸90 s,共30个循环;72 ℃充分延伸10 min,取PCR产物10 μL进行核酸电泳,并观察结果。紫外灯下切胶回收目的片段,用DNA限制性内切酶NdeⅠ、XholⅠ 酶切消化G5F片段和pET-28a载体。将消化后的载体和基因片段按照1︰5的比例用T4 DNA连接酶连接,16 ℃水浴6 h进行连接。将连接产物转化入感受态细胞DH5α,挑取单克隆菌落接种于含卡那霉素(Kan+)的LB液体培养基中培养,取菌液PCR结果为阳性的重组质粒,送生工生物(上海)股份有限公司进行测序鉴定。将测序正确的阳性菌株命名为pET-G5F,然后将该阳性质粒转化入感受态细胞BL21(DE3)中,经菌液PCR鉴定成功后用于后续的蛋白质表达试验。
1.5 重组蛋白G5F的诱导表达与Western blot鉴定
将pET-G5F重组质粒按照1︰1 000比例接种于含有100 μg/mL Kan+的LB液体培养基中,于37 ℃、220 r/min培养过夜。第2天以1︰100比例将此菌液再接种于含有100 g/mL Kan+的100 mL LB液体培养基中,37 ℃、220 r/min培养至OD450值约为0.6时,加入诱导剂IPTG使诱导菌液终浓度为1.0 mmol/L,继续诱导12 h。收集菌液,10 000 r/min离心10 min,倒去上层液体培养基,加入10 mL PBS Buffer重悬瓶底菌体沉淀。将重悬后的菌体用超声破碎仪进行超声破碎:φ2变幅杆,工作3 s,间歇5 s,工作时间20 min。破碎后将液体分装,10 000 r/min离心15 min,分离上清和沉淀,进行SDS-PAGE电泳检测。电泳结束后取出凝胶,将分离胶转移到用甲醇和转膜缓冲液浸泡好的硝酸纤维膜上,将膜置于5%脱脂奶中,4 ℃封闭过夜。一抗为1︰5 000稀释的抗His标签单克隆抗体,37 ℃孵育1 h,然后用PBST洗膜3次,每次5 min;二抗为1︰1 000稀释的羊抗鼠二抗,37 ℃孵育45 min,PBST洗膜3次,每次5 min,双蒸水洗净后再用AEC显色试剂盒进行显色。
1.6 重组蛋白的诱导表达条件优化
取pET-G5F阳性菌液加入含Kan+的液体LB培养基中,置于37 ℃、220 r/min培养至OD600为0.6时,加入IPTG进行诱导表达。分别对IPTG诱导温度、诱导时长、IPTG诱导浓度进行优化。在诱导时长优化试验中,分别选择诱导4、8、12、16、20 h收集菌液(IPTG终浓度为1.0 mmol/L、温度37 ℃);在IPTG诱导浓度优化试验中,分别选择0.1~1.0 mmol/L共10个浓度梯度(温度37 ℃、诱导时长12 h);诱导温度的优化试验分别选择15、20、25、37 ℃温度梯度(IPTG终浓度为0.2 mmol/L、诱导时长12 h)。收集菌液,表达产物分别用SDS-PAGE电泳检测,以确定重组蛋白的最佳诱导条件。
1.7 Western blot检测重组蛋白G5F的反应原性
将含有目的蛋白的SDS-PAGE胶转移至硝酸纤维膜上,5%脱脂奶封闭,洗膜后加入1︰2 500稀释的RABV单克隆抗体为一抗,37 ℃孵育1 h,洗膜3次,再加入1︰5 000稀释的羊抗鼠二抗,37 ℃孵育45 min,PBST洗膜3次,双蒸水洗净后用AEC显色。
2 结果与分析
2.1 G5F片段的扩增与原核表达质粒鉴定
从图1可以看出,扩增得到约1 884 bp的条带,与预期目的条带大小相符。经NdeⅠ和XholⅠ双酶切的G5F片段和载体pET-28a用T4 DNA连接酶连接,将重组质粒转化至大肠杆菌JM109。随机挑取单克隆菌落,用菌液PCR方法进行验证,结果显示,在1 884 bp处出现条带(图2)。经PCR鉴定为阳性的菌液,提取其质粒DNA后,进行测序鉴定。测序结果与合成的序列一致,表明重组质粒pET-G5F构建成功。

M.DL2000 DNA Marker; 1.G5F 扩增产物图1 G5F片段的PCR扩增结果
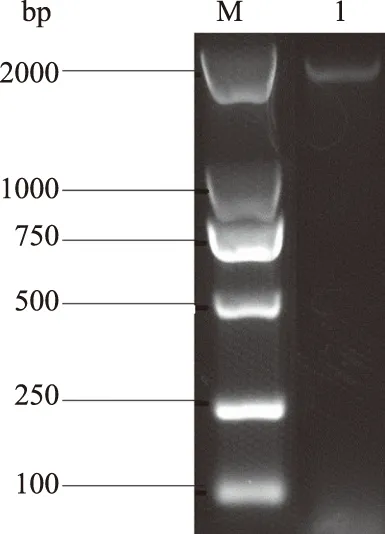
M.DL2000 DNA Marker; 1.pET-G5F重组质粒图2 重组质粒pET-G5F的菌液PCR鉴定
2.2 G5F重组蛋白的诱导表达及可溶性分析结果
SDS-PAGE结果(图3)表明,经IPTG诱导后,分子质量约为65 ku的蛋白质大量表达,且大部分以可溶性形式存在,大小与G5F重组蛋白的理论分子质量相符。表明目的蛋白G5F能够在大肠杆菌中表达,且大部分以可溶性形式存在。
Western blot结果(图4)显示,65 ku处条带能够与His单抗特异性结合。进一步表明,G5F重组蛋白成功表达。
2.3 重组蛋白G5F的诱导表达条件优化结果
分别对pET-G5F菌液的诱导温度、诱导时间、IPTG浓度进行优化,结果(图5)显示,诱导12 h和16 h时,目的蛋白表达量并无太大差异,16 h以后,无关蛋白质表达量开始增加,故选择12 h作为诱导时长。

M.蛋白质Marker; 1、2分别为pET-G5F在20 ℃未诱导时的超声上清、沉淀; 3、4分别为pET-G5F在20 ℃诱导表达时的超声上清、沉淀图3 重组蛋白G5F的SDS-PAGE分析

M.蛋白质Marker; 1、2分别为pET-G5F在20 ℃ 未诱导时的超声上清、沉淀; 3、4分别为 pET-G5F在20 ℃诱导表达时的超声上清、沉淀图4 重组蛋白G5F诱导表达的Western blot分析

M.蛋白质Marker; 1—5分别为经4、8、12、16、20、24 h 诱导表达的pET-G5F图5 pET-G5F经不同时间诱导的表达结果
通过对IPTG诱导浓度进行优化发现,当IPTG浓度为0.1 mmol/L时,目的蛋白表达量较低,明显低于0.2 mmol/L IPTG时的诱导表达量;同时,当IPTG浓度高于0.2 mmol/L时,目的蛋白表达量并无显著提高(图6)。因此,选择0.2 mmol/L作为IPTG诱导浓度。

M.蛋白质Marker; 1.未诱导菌液; 2—11分别为用终浓度0.1、0.2、 0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0 mmol/L 的IPTG诱导表达的G5F重组蛋白图6 pET-G5F经不同IPTG浓度诱导的表达结果
通过对诱导表达温度进行优化发现,37 ℃诱导时,上清中重组蛋白含量不高;当温度降至15 ℃时,目的蛋白表达量较20 ℃时低(图7)。因此,选择20 ℃作为诱导温度。

M.蛋白质Marker; 1.未诱导菌液上清; 2—5分别为在15、20、25、 37 ℃时表达的G5F重组蛋白图7 pET-G5F经不同温度诱导的表达结果
2.4 Western blot鉴定重组蛋白的反应原性
从图8可以看出,在65 ku处出现相应的特异条带,与预期的G5F重组蛋白大小一致。可见,表达的G5F重组蛋白能被抗RABV单克隆抗体识别,具有良好的反应原性。

M.蛋白质Marker; 1.pET-G5F在20 ℃诱导表达时的超声上清; 2.pET-G5F在20 ℃诱导表达时的超声沉淀图8 重组蛋白G5F的反应原性分析
3 结论与讨论
RABV G蛋白是多年来针对狂犬病研究的热点,同时也是新型基因工程亚单位疫苗的研究热点。His标签带有6个组氨酸残基(咪唑基),有利于重组蛋白诱导表达后的进一步纯化。由于His标签是若干个AA残基的多肽,一般对蛋白质的结构不会改变过多[17]。目前,His标签已经广泛应用于多种表达系统重组蛋白的表达和纯化,如大肠杆菌、酵母、哺乳动物细胞等。其纯化条件有时可以跨越很大的pH值范围,甚至可以在如尿素、盐酸胍、非离子型变性剂等严苛环境中正常进行[18]。此外,有研究结果表明,带有His标签的融合蛋白在进行SDS-PAGE分析时会出现分子质量比实际值偏大的情况,这种情况可能是由于His融合标签中的His为碱性氨基酸,含较多的正电荷,导致目的重组蛋白在电泳过程中速度降低[19]。在本研究中,SDS-PAGE 电泳结果表明,重组G蛋白分子质量比理论值略大,试验结果符合预期。G5F重组蛋白具有较好的水溶性。
本研究利用pET-28a表达载体在大肠杆菌感受态细胞BL21 (DE3)中成功表达了 RABV G蛋白,通过优化表达条件,重组蛋白可溶性表达效果较好,且该重组蛋白与RABV单克隆抗体有良好的反应原性,为进一步研究RABV G蛋白的功能及进行新型基因工程亚单位疫苗的制备奠定了基础。
[1] Fontana D,Kratje R,Etcheverrigaray M,etal.Immunogenic virus-like particles continuously expressed in mammalian cells an a veterinary rabies vaccine candidate[J].Vaccine,2015,33(35):4238-4246.
[2] Li X,Luo J,Wang S,etal.Engineering,expression,and immuno-characterization of recombinant protein comprising multi-neutralization sites of rabies virus glycoprotein[J].Protein Expression and Purification,2010,70(2):179-183.
[3] Davis A,Jarvis J,Pouliott C,etal.Susceptibility and pathogenesis of little brown bats(Myotislucifugus) to heterologous and homologous rabies viruses[J].Journal of Virology,2013,87(16):9008-9015.
[4] 李露,王化磊,赵国星,等.3株我国狂犬病病毒街毒株在细胞和乳鼠脑内的培养及生长特性[J].中国生物制
品学杂志,2014,27(5):612-616.
[5] Johnson N,Cunningham A,Fooks A.The immune response to rabies virus infection and vaccination[J].Vaccine,2010,28(23):3896-3901.
[6] Coulon P,Rollin P,Flamand A.Molecular basis of rabies virus virulence.Ⅱ.Identification of a site on the CVS glycoprotein associated with virulence[J].The Journal of General Virology,1983,64(Pt3):693-696.
[7] Wunner W,Reagan K,Koprowski H.Characterization of saturable binding sites for rabies virus[J].Journal of Virology,1984,50(3):691-697.
[8] Delagneau J F,Perrin P,Atanasiu P.Structure of the rabies virus:Spatial relationships of the proteins G,M1,M2 and N[J].Ann Inst Pasteur Virol,1981,132:473-493.
[9] 罗金燕,马志永.狂犬病病毒G蛋白的结构和功能[C]//中国畜牧兽医学会.中国畜牧兽医学会2009学术年会论文集(下册).北京:[出版者不详],2009.
[10] Nagaraja T,Madhusudana S,Desai A.Molecular characterization of the full-length genome of a rabies virus isolate from India[J].Virus Genes,2008,36(3):449-459.
[11] Lentz T,Burrage T,Smith A,etal.Is the acetylcholine receptor a rabies virus receptor[J].Science,1982,215:182-184.
[12] Dietzschold B,Li J,Faber M,etal.Concepts in the pathogenesis of rabies[J].Future Virology,2008,3(5):481-490.
[13] 殷相平.动物狂犬病基因工程亚单位疫苗研究[D].兰州:甘肃农业大学,2011:32-33.
[14] Nuc P,Nuc K.Recombinant protein production inEscherichiacoli[J].Postepy Biochem,2006,52(4):448-456.
[15] Dong X,Tang B,Li J,etal.Expression and purification of intact and functional soybean(Glycinemax) seed ferritin complex inEscherichiacoli[J].Journal of Microbiology and Biotechnology,2008,18(2):299-307.
[16] Hochuli E,Bannwarth W,Dobeli H,etal.Genetic approach to facilitate purification of recombinant proteins with a novel metal chelate adsorbent[J].Biotechnology,1988,6(11):1321-1325.
[17] 崔超,呼延霆,尹大川.重组标签蛋白在蛋白质纯化中的研究进展[J].现代生物医学进展,2014,14(32):6372-6378.
[18] Chaga G.Twenty-five years of immobilized metal ion affinity chromatography:Past,present and future[J].Journal of Biochemical and Biophysical Methods,2001,49(1/2/3):313-334.
[19] 唐威华,张景六,王宗阳.SDS-PAGE法测定His-tag融合蛋白分子量产生偏差的原因[J].植物生理学报,2010,33(1):65-69.
Prokaryoticexpression and Immunoreactivity Analysis of Rabies G Protein
WANG Pan1,2,LIU Yunchao2,WEI Qiang2,CHAI Shujun2,CHEN Yumei2,ZHANG Gaiping1,2,3*
(1.College of Veterinary Medicine,Northwest A&F University,Yangling 712100,China; 2.Key Laboratory of Animal Immunology,Henan Academy of Agricultural Sciences/Henan Provincial Key Laboratory of Animal Immunology/Key Laboratory of Animal Immunology of Ministry of Agriculture,Zhengzhou 450002,China;3.College of Animal Husbandry and Veterinary Medicine,Henan Agricultural University,Zhengzhou 450002,China)
To optimize the prokaryotic expression condition and the immunoreactivity of the rabies virus G protein(RABV G protein).Herein G protein coding genes section G5F was successfully synthesized with biological engineering synthesis method,using the rabies virus CTN-1V10 strain as a template.The recombinant plasmid was constructed by cloning the G5F gene into pET-28a,and then the plasmid was transformed intoE.coliBL21(DE3)competent cells.Highest protein expression level was achieved when induced with 0.2 mmol/L IPTG at 20 ℃ for 12 h.The results of SDS-PAGE and Western blot showed that RABV G protein was expressed as a soluble recombinant protein,and it could be recognized by anti-RABV monoclonal antibody,which revealed a good immunoreactivity of this protein.
RABV; G protein; soluble protein expression; immunoreactivity
2016-11-06
河南省重大科技专项(141100110100)
王 攀(1988-),男,河南郑州人,在读硕士研究生,研究方向:兽医免疫学。E-mail:dennis1999@126.com
*通讯作者:张改平(1960-),男,河南内黄人,研究员,博士,主要从事动物免疫学及重大疫病快速检测技术研究。 E-mail:zhanggaiping2003@163.com
S855.3
A
1004-3268(2017)04-0108-05
