N离子束注入与DES复合诱变选育腺苷高产菌株
2017-04-12刘国生李金鑫谷艳昌
刘国生,李金鑫,刘 磊,谷艳昌,许 航
(1.河南师范大学 生命科学学院,河南 新乡 453007; 2.资源微生物与功能分子河南省高校重点实验室培育基地,河南 新乡 453007; 3.新乡拓新生化科技有限公司,河南 新乡 453000)
N离子束注入与DES复合诱变选育腺苷高产菌株
刘国生1,2,李金鑫1,刘 磊1,谷艳昌3,许 航1
(1.河南师范大学 生命科学学院,河南 新乡 453007; 2.资源微生物与功能分子河南省高校重点实验室培育基地,河南 新乡 453007; 3.新乡拓新生化科技有限公司,河南 新乡 453000)
为了获得腺苷高产菌株,以肌苷产生菌枯草芽孢杆菌(Bacillussubtilis)HSD1206(Ade-、Thi-、SGr)为出发菌株,通过硫酸二乙酯(DES)处理、N离子束注入进行单因子和复合诱变。参照菌种致死率曲线,确定N离子束注入250 s与DES处理10 min为最佳诱变时间。经过多轮诱变和筛选,获得了黄嘌呤、硫胺素、组氨酸三重缺陷型,腺嘌呤脱氨酶活性缺失及磺胺胍抗性菌株DI4-24和DI4-182,其遗传标记为Xan-、Thi-、His-、Deam-、SGr,连续传代后性状稳定,在优化的发酵培养基中发酵后腺苷产量可分别达到18.56 g/L和17.13 g/L。由此证明,通过物理、化学复合诱变,阻断枯草芽孢杆菌营养缺陷型菌株产肌苷途径,打通合成腺苷途径的诱变思路在实验室环境下是可行的。
腺苷; 枯草芽孢杆菌; 离子束注入; 硫酸二乙酯; 复合诱变; 黄嘌呤缺陷型
腺苷(adenosine)即腺嘌呤核苷,化学名为9-β-D-呋喃核糖基腺嘌呤,在临床医学上常被用作血管扩张剂,诱导冠脉血管达到最大舒张状态,同时它是合成多种核苷类药物如阿糖腺苷、8-氮腺苷、腺苷酸等的医药中间体[1-2]。目前,工业上采用代谢控制发酵法生产腺苷,生产菌株为枯草芽孢杆菌(Bacillussubtilis)营养缺陷菌株,该菌经过诱变可生产肌苷、鸟苷或腺苷[3]。产腺苷菌株的诱变通常采用单一物理或化学方法,由于突变谱窄或菌种死亡率高,很难获得目标菌株[4]。N离子束注入诱变育种具有损伤轻、突变率高、突变谱宽、易于获得理想变异菌株等特点[5-9],与化学诱变剂相结合进行复合诱变处理,能有效地提高正变频率,更有效地筛选出目的菌株[10-11]。为此,利用产肌苷菌株作为出发菌株,通过多重复合诱变和多轮筛选,选育出具有产腺苷能力且遗传性状稳定的高产菌株,为将来实验室育种或工业化生产提供设计思路。
1 材料和方法
1.1 仪器
Titan80离子注入机由俄罗斯科学院西伯利亚分院强电研究所生产,1200型高效液相色谱仪购自美国Agilent公司。
1.2 菌株
B.subtilisHSD1206为资源微生物与功能分子河南省高校重点实验室培育基地选育的肌苷产生菌,其遗传标记为腺嘌呤缺陷型(Ade-)、硫胺素缺陷型(Thi-)、磺胺胍抗性(SGr),以此为出发菌株,通过诱变选育腺苷产生菌;B.subtilisAS106来自中国科学院北京微生物研究所,为野生型菌株,作为对照菌株,没有核苷代谢产物。
1.3 培养基
种子培养基、基本培养基及测量腺苷产量用的发酵培养基的具体配制方法参照文献[12];完全培养基为加入琼脂20 g/L的种子培养基;补充培养基为加入相应营养因子的基本培养基。
1.4 方法
1.4.1 菌悬液的制备 取在斜面培养基上活化的B.subtilisHSD1206菌种接种于种子培养液,于34 ℃、150 r/min条件下培养至对数生长期,取菌液在4 ℃、5 000 r/min条件下离心收集菌细胞,然后用生理盐水洗涤细胞2次并制成菌悬液,菌体浓度调整到106或108cfu/mL。
1.4.2 N离子束注入诱变处理 取106cfu/mL菌悬液,均匀涂布在光洁培养皿底部,每皿菌悬液用量300 μL,无菌风干;将涂菌平皿置于离子注入机靶室内进行诱变处理,处理条件为反射电流30 μA、能量35 keV、真空压力3×10-3Pa。处理时间设为0、40、80、250、583、832 s。不同照射时间与照射剂量关系如表1所示。

表1 N离子束照射时间与照射剂量对照情况
1.4.3 硫酸二乙酯(DES)诱变处理 取108cfu/mL菌悬液10 mL于250 mL三角瓶中,加入DES溶液使其终质量浓度为1 mg/L,在摇床上分别振荡2、4、6、8、10、12、14、16 min,处理结束后立即加入250 g/L的硫代硫酸钠终止反应。
1.4.4 复合诱变 将涂菌平皿进行不同时间离子束照射后,用3 mL生理盐水洗下平板上的菌细胞,加入30 μL DES,振荡温育不同时间,处理结束后立即加入250 g/L的硫代硫酸钠终止反应,稀释后涂布完全培养基平板筛选突变株。
1.4.5 摇瓶发酵 将菌种接种于完全培养基试管斜面上,34 ℃培养12 h后,用无菌接种环将整个斜面上长满的菌落接种于装有20 mL发酵培养液的500 mL三角瓶中,34 ℃、150 r/min培养48 h。
1.4.6 分析方法 腺嘌呤脱氨酶(Deam)和琥珀酰腺苷酸合成酶(SAMP)活性测定参照文献[13-14];发酵液中肌苷、腺苷的测定参照文献[15-16]。
2 结果与分析
2.1 诱变处理时间的选择
将B.subtilisHSD1206的涂菌平皿置于离子注入机靶室内,分别进行0、40、80、250、583、832 s照射处理,平板菌落法测定各处理样品活菌总数,计算致死率(图1)。由图1可见,随照射时间延长,致死率快速增加,在250 s时致死率达到97.8%,照射时间进一步延长到583 s、832 s时致死率不再有明显增加。
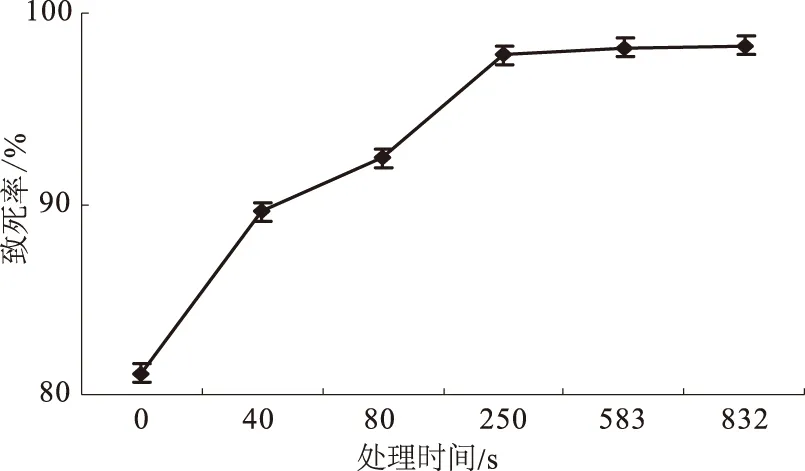
图1 N离子束注入处理B.subtilisHSD1206的时间与致死率关系
将B.subtilisHSD1206菌细胞用终质量浓度为1 mg/L的DES分别处理2、4、6、8、10、12、14、16 min,终止反应后测定各处理样品活菌总数,计算致死率(图2)。由图2可见,处理10 min时致死率达到92.5%。根据以上试验数据,在后续的诱变处理中,分别采用表2条件进行单因子和复合诱变处理。
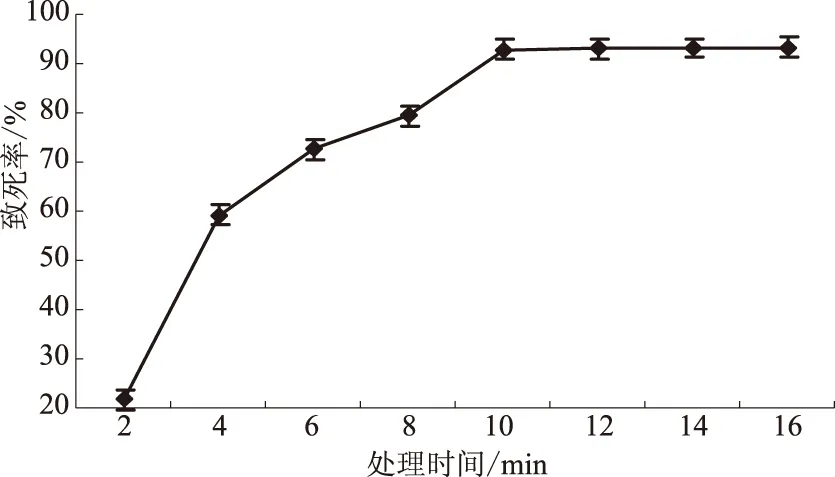
图2 DES处理B.subtilis HSD1206的时间与致死率关系

表2 单因子及复合诱变处理条件
2.2 诱变处理后突变株的筛选
2.2.1 Deam活性缺失突变株的筛选 将诱变处理的菌悬液涂布在完全培养基上,37 ℃培养24~36 h待其长出单菌落,用无菌牙签依次挑单菌落接种于添加有150 μg/L 8-氮杂鸟嘌呤(8-AG)的完全培养基上,挑选在8-AG平板上不能生长的菌落。将挑出的菌落依次接种于基本培养基、补充培养基(50 mg/L腺嘌呤、10 mg/L硫胺素)以及含200 μg/L磺胺胍(SG)的完全培养基上,挑选在基本培养基上不生长、在补充培养基和SG培养基上生长的菌落。将筛选出的菌落培养后,收集细胞测定其Deam活性,从中筛选Deam活性很低或无的菌株。将筛选的菌株连续5次传代后,测定其遗传稳定性和Deam活性,有3株(D1-3、D1-21、DI1-72)比较符合选种的要求,其酶活性测定以及发酵结果如表3所示。

表3 突变菌株的Deam活性及发酵产苷情况
注:Deam活性用次黄嘌呤生成量表示。
其中,DI1-72菌株无Deam活性,进入下一轮诱变育种,其遗传标记为Ade-、Thi-、Deam-、SGr。
2.2.2 SAMP活性恢复突变株的筛选 对DI1-72菌株进行诱变处理后,将细胞涂布在完全培养基上待菌落长出,挑单菌落依次接种于基本培养基(含10 mg/L硫胺素)、补充培养基(在基本培养基中补加50 mg/L腺嘌呤)上,37 ℃培养24~48 h后挑选在基本培养基上不生长、在补充培养基上生长的菌落。将挑选出的腺嘌呤原养型菌落划线接种于SG平板和8-AG平板上,根据生长情况,淘汰抗性降低或消失的菌落,将筛选得到的菌落纯化后测定其SAMP活性,并连续传代5次考察其遗传稳定性及摇瓶发酵产苷能力。经过筛选得到3株符合要求的突变株(D2-91、I2-121、DI2-527)如表4所示,其遗传标记为Ade+、Thi-、Deam-、SGr,这些菌株几乎不再产肌苷。其中的D2-91菌株产肌苷途径被切断、SAMP活性较高,符合要求,因此进入下一轮诱变育种。

表4 SAMP活性恢复菌株筛选结果
注:SAMP活性以次黄嘌呤核苷酸(IMP)减少量表示。
2.2.3 黄嘌呤营养缺陷型突变株的筛选 将D2-91菌细胞进行诱变处理后涂布在完全培养基上,37 ℃培养长出单菌落后,挑单菌落接种于基本培养基、补充培养基(含50 mg/L黄嘌呤)上,培养后挑选在基本培养基上不生长、在补充培养基上生长的菌落,即为黄嘌呤缺陷型,再通过检测其SG和8-AG抗性、Deam和SAMP活性进行复筛,选出5株符合要求的突变株(D3-52、DI3-243、DI3-499、DI3-652、I3-10),其遗传标记为Xan-、Thi-、Deam-、SGr。经5次连续传代后菌株遗传性状较稳定,对其进行摇瓶发酵,经高效液相色谱分析表明其产物为腺苷。其中,DI3-243的产腺苷量最高(9.52 g/L),嘌呤副产物含量低(0.031 g/L)(表5)。

表5 黄嘌呤缺陷型菌株摇瓶发酵结果
2.2.4 组氨酸营养缺陷型突变株的筛选 将DI3-243菌细胞进行诱变处理后涂布在完全培养基上,37 ℃培养长出单菌落后,挑单菌落接种于基本培养基、补充培养基(含30 mg/L组氨酸)上,从补充培养基平板挑选单菌落,进一步测定其抗性和酶活性,淘汰不符合要求的菌株,最后得到遗传标记为His-、Xan-、Thi-、Deam-、SGr的菌株,摇瓶发酵测定其腺苷产量,其中腺苷产量较高的5株菌(D4-3、DI4-24、DI4-91、DI4-182、I4-107)发酵结果如表6所示。菌株DI4-24和DI4-182产苷性能比较突出,通过对发酵培养基和发酵条件进行优化,其产苷能力可进一步提高到18.56 g/L和17.13 g/L。

表6 组氨酸缺陷型菌株摇瓶发酵结果
3 结论与讨论
本试验证明,以产肌苷菌株为出发菌株,根据代谢控制理论,通过多次诱变有步骤地选育高产腺苷菌株的方案是可行的。在试验中获得了5株黄嘌呤缺陷型菌株,平均产腺苷7.33 g/L,考虑到5-磷酸核糖-1-焦磷酸是合成腺苷的重要中间体,它有一个代谢旁支合成组氨酸,将此路径切断会显著提高腺苷产量,因此,又诱变选育出5株黄嘌呤和组氨酸双重缺陷型菌株,其平均产腺苷量达14.94 g/L,此与以往的设计思路[13]不同。
在诱变处理方法上,通过复合诱变处理获得不同突变株较单因子诱变处理更为有效,例如,采用N离子束注入处理80 s与DES处理10 min的复合诱变比较有利于突变株的获得,这在His-和Xan-突变型菌株选育过程中表现更为突出。此外,通过复合诱变获得的突变株其稳定性更好,在传代过程中遗传标记不易丢失。一些通过单因子诱变获得的突变体存在遗传性状不稳定现象,例如I4-107的His-遗传型在传代过程中比较容易发生回复突变,表现为在黄嘌呤培养基上菌落呈红色,故随着传代次数增多,其产苷能力急剧下降,这种突变株不稳定的现象在其他的研究工作中也有报道[17-18]。
[1] Berne R M.The role of adenosine in the regulation of coronary blood flow[J].Circulation Research,1980,47(6):807-813.
[2] 刘国生,李学梅,李用芳,等.六种金属离子对Bacillussubtilis肌苷产率的影响[J].中国医药工业杂志,2003,34(8):385-388.
[3] 蔡显鹏,储炬,庄英萍,等.芽胞杆菌生产嘌呤核苷研究进展[J].中国生物工程杂志,2002,22(5):9-14.
[4] 宋云,张怀渝,畅志坚.离子束用于诱变育种的研究进展[J].分子植物育种,2004,2(2):301-305.
[5] 余增亮,王纪,袁成凌,等.微生物油脂花生四烯酸产生菌离子束诱变和发酵调控[J].科学通报,2012,57(11):883-890.
[6] 慈志敏,赵国芬,陈剑,等.产CLA植物乳杆菌P8的离子束诱变与筛选[J].内蒙古农业大学学报(自然科学版),2011,32(3):207-210.
[7] 顾鹏飞,吴刚,胡永红,等.低能N+注入选育凝结芽孢杆菌高效生防菌株[J].河南农业科学,2016,45(5):87-90.
[8] 凌帅,刘咏,姚建铭,等.紫外线与N+注入复合诱变选育曲酸高产菌株[J].食品科学,2013,34(1):234-238.
[9] 辛培尧,唐军荣,孙正海,等.离子注入诱变技术在木本植物育种中的应用[J].河南农业科学,2014,43(4):17-20.
[10] Qian J,Cai X,Chu J,etal.Nucleotide mutations inpurAgene and pur operon promoter discovered in guanosine and inosine-producingBacillussubtilisstrains[J].Biotechnology Letters,2006,28(12):937-941.
[11] Qin Y,Xue Z,Su Y,etal.Breeding of high producing nosiheptide strain through irradiation ofStreptomycesactuosusprotoplast by UV-microwave compound[J].Food and Fermentation Technology,2011,3:10-11.
[12] 刘国生,赵婷,王秀强,等.N+注入诱变筛选阿拉伯糖缺陷型肌苷高产菌株[J].中国医药工业杂志,2008,39(7):504-506.
[13] 施庆珊,林小平,许虹,等.腺苷的微生物合成研究[J].发酵科技通讯,2005,34(2):11-14.
[14] Chu J,Zhang S,Zhuang Y,etal.Correlation between key enzyme activities in the inosine synthetic pathway and inosine production[J].Process Biochemistry,2005,40(2):891-894.
[15] 卢端萍,蒋婷婷,陈硕,等.高效液相色谱法测定灵芝提取物中尿苷和腺苷含量[J].中国药业,2013,22(14):17-19.
[16] 申进文,孙晓萍,赵旭,等.人工蛹虫草核苷类成分超声提取工艺优化及HPLC定量分析[J].河南农业大学学报,2011,45(4):391-394.
[17] 柏建新,张一平,朱晓宏,等.微生物发酵生产腺苷的研究[J].食品与发酵工业,2001,27(3):16-20.
[18] 孙谦.腺苷生产菌株的回复突变和性质检验[J].曲靖师范学院学报,2013,32(6):40-44,70.
Breeding of High-yield Adenosine Strains Using N Ion Beam Injection and DES Compound Mutagenesis
LIU Guosheng1,2,LI Jinxin1,LIU Lei1,GU Yanchang3,XU Hang1
(1.College of Life Sciences,Henan Normal University,Xinxiang 453007,China; 2.Key Laboratory for Microorganisms and Functional Molecules,University of Henan Province,Xinxiang 453007,China;3.Xinxiang Tuoxin Biochemical and Technology & Science Co.,Ltd.,Xinxiang 453000,China)
The inosine producing bacteriumBacillussubtilisHSD1206(Ade-Thi-SGr) was selected as parent strain and treated with diethyl sulfate (DES) and N ion beam injection for single factor or compound mutagenesis to select adenosine producing strain after several rounds of mutation and breeding.Results showed that the best mutagenesis time was 250 s by N ion beam injection or 10 min by DES treatment according to the strain lethality curve.The strains which showed xanthine,thiamine,histidine triple defect type,lacked adenine deaminase activity and resisted sulfaguanidine were named DI4-24 and DI4-182,and the genetic markers were Xan-Thi-His-Deam-and SGr.They could steadily accumulated adenosine in the optimization fermentation medium to 18.56 g/L and 17.13 g/L respectively after consecutive culture.In conclusion,the thought of blocking the way to product inosine and inducing the way to synthesize adenosine ofBacillussubtilisauxotroph strain by physical and chemical mutagenesis is feasible in the laboratory environment.
adenosine;Bacillussubtilis; ion beam injection; diethyl sulfate; compound mutation; xanthine deficient type
2016-12-26
河南省高校科技创新团队支持计划项目(13IRTSTHN009);河南省教育厅自然科学基金项目(2011B180032)
刘国生(1964-),男,河南舞阳人,教授,博士,主要从事应用微生物学研究。E-mail:hnliugs@163.com
TQ920.1
A
1004-3268(2017)04-0143-04
