浓香型白酒酒糟中淀粉的提取
2017-04-11刁冲李丽王祥余郭玉柳游齐宗绪岩
刁冲,李丽,王祥余,郭玉柳,游齐,宗绪岩,*
(1.四川理工学院,四川自贡643000;2.诺维信(中国)投资有限公司,北京100085;3.黑龙江大学,黑龙江哈尔滨150080;4.四川郎酒集团有限责任公司,四川泸州646523)
浓香型白酒酒糟中淀粉的提取
刁冲1,李丽1,王祥余2,郭玉柳3,游齐4,宗绪岩1,*
(1.四川理工学院,四川自贡643000;2.诺维信(中国)投资有限公司,北京100085;3.黑龙江大学,黑龙江哈尔滨150080;4.四川郎酒集团有限责任公司,四川泸州646523)
以浓香型白酒酒糟为原料,研究了酶法、碱法、SDS法对淀粉纯度的影响。研究表明:酶法提取的酒糟淀粉纯度最高;同时在单因素试验的基础上,根据Box-Behnken中心组合试验设计原理,采用三因素三水平响应面分析法对酒糟淀粉提取工艺进行优化研究,确定酶法提取酒糟淀粉的最佳工艺参数:酶添加量为2%,pH3.5,酶解温度40℃。该条件下得到酒糟淀粉纯度为70.23%。酶法制得的酒糟淀粉理化特性为:扫描电镜图片显示该提取方法未对淀粉颗粒造成损伤;与原淀粉相比,晶体类型从A型变为A+V型,这可能与酿酒工艺有关,而与提取方法无关。
浓香型白酒酒糟;淀粉;提取;响应面法;理化性质
酒糟是酒醅在窖内发酵完后再经蒸馏出酒后残留的混合固形物,结合浓香型白酒的酿造特点来看,浓香型白酒酒糟中含有很多未利用完的淀粉、蛋白质、脂肪和多种酸性物质,这些成分主要来自于酿造原料中。酒糟中主要成分含量为粗淀粉的含量在5.71%~11.34%,粗蛋白的含量5.0%~13.84%,以及粗脂肪1.31%~3.24%[1]。现在对白酒酒糟的研究主要集中在对酒糟的利用问题上。比如:生产饲料、培养食用菌、提取化学物质、作为发酵原料[2-5]。这些酒糟主要针对的是发酵完成之后丢弃的酒糟。由于浓香型白酒酿造工艺的特点之一是续糟发酵,因此一部分酒糟会循环利用,而当今对酿造过程中酒糟成分的研究较少。尤其是酒糟中的淀粉类物质,因为这部分淀粉对后续的生产以及丢糟的再利用有显著的影响。要对酒糟中的淀粉进行研究,首先需要提取出一定纯度的淀粉。
淀粉的提取方法主要有稀碱液提取法、表明活性剂法、酶法。3种方法主要将蛋白质视为主要杂质,这适用于酒糟中淀粉的提取。碱法提取依据为碱液能使包裹在淀粉颗粒外的蛋白质体结构变疏松,同时对蛋白质分子间的次级键特别是氢键有破坏作用,可使某些极性基团发生解离,从而对蛋白质分子有增溶作用,促进淀粉和蛋白质的分离[6]。表面活性剂法是利用烷基苯磺酸钠等表面活性剂与蛋白质结合,使蛋白质形成络合物变性,从而有利于打断蛋白分子间的氢键,使蛋白展开,暴露极性基团,SDS和蛋白形成类似项链结构的SDS-蛋白复合物,展开的蛋白被SDS胶素团包围,阴离子表面活性剂中的离子基团可以形成更多的静电引力而有利于蛋白和淀粉的分离[7]。酶法的原理是利用蛋白酶将包裹在大米淀粉外层的蛋白质水解,使淀粉与蛋白质体的结合变疏松,从而在水解过程中逐步释放蛋白质,实现大米淀粉与蛋白的分离[6]。而酒糟中淀粉的提取,还鲜见有报道,因此本试验先在3种方法中选择一种,选择依据是提取淀粉的纯度,然后在对其进行优化,从而得到适合酒糟中淀粉提取的方法。
鉴于此,本文将响应面分析法应用于发酵过程酒糟中淀粉提取条件的优化,以提高淀粉的纯度,确立酒糟中淀粉的最佳提取条件。并对提取的淀粉进行相关的性质研究。以期为后续酒糟淀粉的研究提供一定的参考,以及为酒糟后续的再利用提供一定的基础理论。
1材料与方法
1.1材料与试剂
出窖酒糟:四川绵阳丰谷酒厂提供;酸性蛋白酶:北京奥博星生物技术有限责任公司;乙醇、苯酚、3,5-二硝基水杨酸、酒石酸钾钠、氢氧化钠、氢氧化钾、葡萄糖,均为分析纯:购于成都市科龙化工试剂厂。
1.2仪器与设备
Lynx6000高效落地高速离心机:美国Thermo公司;DHG-9075A电热恒温鼓风干燥箱:上海一恒科学仪器有限公司;UV2400紫外可见分光光度计:北京普析通用仪器有限责任公司;SHD-Ⅲ型循环水式多用真空泵:常州普天仪器制造有限公司;S4EXPLORER X射线荧光分析仪、Bruker/D2PHASER X射线衍射仪:德国Bruker AXS公司;VEGA 3SBU扫描电子显微镜:捷克TESCAN公司;Alpha1-2LDplus冷冻干燥机:德国Marin Christ;搅拌机:广东美的精品电器制造有限公司。
1.3酒糟淀粉提取方法
1.3.1碱法
参照芦鑫[8]的方法并做一定的变化。先将酒糟与蒸馏水按质量比为1∶6的料液比混合磨碎过40目筛,除去糠壳、高粱皮等杂质;水洗离心多次,将过筛液调成中性,然后制备0.2%的NaOH溶液浸泡酒糟,料液比按质量比为1∶6,每小时搅拌一次,处理10 h,排除混浊的上清液,反复更换浸泡溶液。浸泡处理结束之后,过80目筛;得到初步的淀粉溶液,多次离心(3 000 r/min×20min)洗涤淀粉,直至用酚酞检查上清液不再显示粉红色,将调节pH为中性,最后收集淀粉冷冻干燥,研磨并过100目筛。装袋并在4℃的条件下保存备用。
1.3.2 SDS法
参照郭晓冬[9]的方法并做一定的修改。先将酒糟与蒸馏水按质量比1∶6的料液比混合磨碎过40目筛,除去糠壳、高粱皮等杂质,水洗离心多次,将过筛液调成中性,然后制备1%十二烷基硫酸钠(SDS)溶液,使用前加0.1%亚硫酸钠(Na2SO3)浸泡酒糟,按质量比为1:4的料液比浸泡;每小时搅拌一次,处理12 h,排除混浊的上清液,反复更换浸泡溶液。浸泡处理结束之后,过80目筛;得到初步的溶液,3 000 r/min离心20min,收集沉淀得到酒糟淀粉,然后通过离心的方法用蒸馏水水洗酒糟淀粉洗去SDS溶液;最后收集淀粉冷冻干燥,研磨并过100目筛。装袋并在4℃的条件下保存备用。
1.3.3酶法
参照郭晓冬[9]的方法并做一定的修改。将酒糟与蒸馏水按质量比1∶6的料液比混合磨碎过40目筛,去除糠壳等杂质;水洗离心多次,将过筛液调成中性;配制pH为4的柠檬酸-磷酸氢二钠缓冲液浸泡过筛液;加入一定量的酸性蛋白酶,在40℃的条件下酶处理10 h,酶解时间结束之后,过80目筛;得到初步的溶液,3 000 r/min离心20min,收集沉淀得到酒糟淀粉,然后通过多次离心的方法用蒸馏水水洗酒糟淀粉为中性;最后收集淀粉冷冻干燥,研磨并过100目筛。装袋并在4℃的条件下保存备用。
1.4酶法提取酒糟淀粉工艺参数的优化试验
通过对3种方法的对比试验,以淀粉纯度为参考指标可以知道酶法的提取效果较好,因此,选择酶法来进行单因素响应面优化试验;3种方法对比试验结果在结果与分析中体现。同时为了更好的提高淀粉纯度,重新对酶法的提取工艺做一定的改进。
将酒糟与蒸馏水按质量比为1∶6的料液比混合,搅拌0.5 h,用搅拌机磨5min;接着过40目筛,去除糠壳等杂质;过筛液体3 000 r/min离心15min,弃上清液,离心3次;沉淀物用70%酒精溶液浸泡处理3 h,浸泡液3 000 r/min离心15min,弃上清液,离心5次;最后淀粉沉淀物用酸性蛋白酶处理10 h(用柠檬酸-磷酸氢二钠缓冲液配制成不同pH值的浸泡液);过80目筛然后用蒸馏水洗涤沉淀物4次~6次,直到中性,冷冻干燥粉碎、过100目筛,装袋并在4℃的条件下保存备用。
以提取淀粉的纯度为参考指标,优化酶法提取酒糟淀粉工艺参数和试验参数如表1所示。固定料液比为质量比1∶6,酶解时间为10 h。
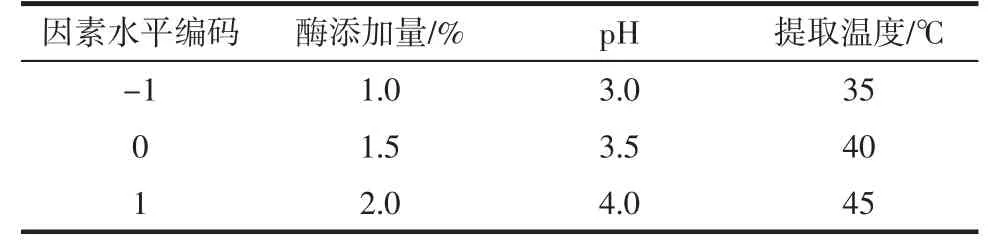
表1 响应面试验因素与水平Table1 Variablesand levels in Box-Benhnken experimental design
1.5淀粉理化性质测定方法
1.5.1淀粉含量的测定
参照翁忠岚[10]的方法并稍作改变。称取5 g提取得到的淀粉到烧瓶中,然后加入100mL浓度为体积比为4∶1的盐酸溶液(蒸馏水:浓盐酸)和沸石。安装好回流装置,加热至沸腾,沸腾之后计时1 h。加入碘液检测是否水解完全。水解完毕之后,冷却水解液至室温。过滤、洗涤水解液定容到500mL容量瓶中;取50mL定容之后的水解液调节pH到6~7;接着定容到100mL容量瓶中。取一定量的水解液用DNS试剂检测,对比标准曲线得到还原糖的含量,试验结果乘以0.9得到淀粉含量。
1.5.2微观形态的观察
参照高群玉[11]等的方法。将适量待测样品用导电双面胶固定于载物台上,在真空条件下进行镀金处理,然后将样品台放入扫描电子显微镜中观察,并拍摄具有代表性的样品颗粒形貌照片。
1.5.3晶体结构分析
在高群玉[11]等的方法基础下做一定的改进,将淀粉样品在相对湿度为100%的条件下平衡水分24 h,然后进行X-射线衍射分析。测定条件:靶型:Cu;扫描范围为4°~70°;扫描速度为10°/min;管压为40 kV,管流为40mA;扫描步长为0.02°。相对结晶度的计算参照陈翠兰[12]等的方法。
1.6数据分析处理
各组数据均为3次重复测定求平均值,结果表示为平均值±标准差。并采用Excel和origin 8.5作图,图表中字母或者数字的不同代表差异显著(P<0.05)。采用Excel对数据进行统计分析,并用SPSSStatstics Version 20进行显著性分析(P<0.05)和多重比较。X射线衍射数据采用MDIJade5.0进行分析。
2结果与分析
2.1提取方法的选择
采用不同方法对浓香型白酒酒糟中淀粉进行提取,其提取结果见表2。

表2 不同提取方法试验结果Table2 Experimental resultby differentm ethods %
从提取的试验的淀粉纯度来看,酶法的提取效果最佳。通常淀粉的提取方法都是碱法或者SDS法,比如何义萍[13]等利用碱法提取燕麦淀粉,提取率能够达到85.62%;张兆丽[14]等利用碱法提取花生淀粉,其纯度能够达到95.72%;Beta[15]等利用超声波处理并结合0.5%的SDS和0.5%的NaOH溶液浸泡高粱籽粒再经离心洗涤后可萃取出蛋白质质量分数仅为0.06%的高粱淀粉。
而碱法和SDS法提取酒糟中的淀粉却没有得到较为满意的效果,这可能与酒糟成分的复杂有关;酒糟中含有蛋白质、脂肪、纤维素、矿物元素及少量的淀粉等营养物质[16];另外由于整个发酵酿酒过程中产生了各种各样复杂的生物化学变化,所以其中也产生了相当多的新成分,如核糖核酸、嘌呤、嘧啶和其他一些次级代谢产物[17];同时,浓香型白酒酒糟在生产过程中反复蒸煮、发酵,原料粮食和辅料稻壳中的纤维、半纤维结构破坏,性质与淀粉相似,提取时混入难于分离。
碱法和SDS法对蛋白质的分解作用极有可能受到各种物质的影响,从而使得提取的效果不理想。淀粉纯度也无法达到一个较高的程度。而酶法却具有单一性的作用机制,因此其他物质对其影响较小。酶法能够使蛋白质网状结构逐渐被破坏,使其对淀粉的束缚力变小[18],从而使得蛋白质能够被分解成小分子的多肽和氨基酸。这也是酶能够高效的与底物接触,促进了酒糟中淀粉和蛋白质的分离以及蛋白质的分解,因而使得淀粉纯度逐渐增加。这也是酶法能够较高纯度酒糟淀粉的原因。
2.2响应面试验设计与结果分析
2.2.1 Box-Behnken试验回归模型的建立及显著性检验
以淀粉纯度为响应值,利用Design-Expert软件优化酒糟淀粉提取工艺参数。通过17次试验得到酒糟淀粉提取的最佳工艺条件,响应面试验设计及结果见表3。固定料液比为1∶6(质量比)、酶解时间10 h。

表3 响应面试验设计与结果Table3 Box-Benhnken responsesurface design and resu lts
2.2.2回归模型的有效性及显著性分析
利用Design-Expert8.0软件对表3数据进行多元回归拟合,获得酶添加量、pH、酶解温度与酒糟淀粉纯度之间的二次多项回归方程:

该模型的方差分析结果见表4。
由表4可知,回归模型的P值小于0.01即模型高度显著,失拟检验大于0.05即失拟检验不显著。这两点可以看出回归模型与实际情况拟合很好,实验误差小。模型中一次项A、B、C均高度显著,证明酶添加量、pH、酶解温度对淀粉纯度都有显著的影响;交互项AB显著,说明酶添加量和pH交互作用对淀粉纯度有显著影响;二次项A2、B2、C2均极其显著。

表4 回归方程的方差分析Table4 Analysisofvarianceof regression equation
根据方差分析可以知道交互项AC、BC项的P值都大于0.05,说明在此试验条件下两者之间的交互作用不显著。AB的P值小于0.05,说明两者的交互作用显著。为了更直观地反映酶添加量、pH交互作用对淀粉纯度的影响,绘制出相应的等高线图和三维曲面图。如图1表示。
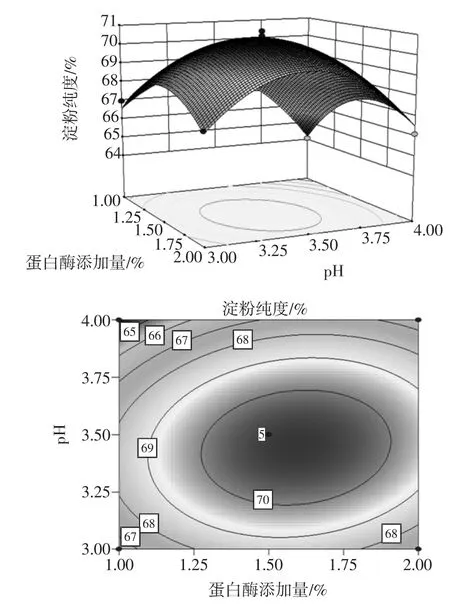
图1 酶添加量与pH对淀粉纯度影响的3D图和等高线图Fig.1 Responsesurfaceand contour plots for the interaction effectsof pH and enzym edosageon extraction purity of the starch
由方差分析表4和图1可以看出酶添加量和pH值交互作用对淀粉纯度影响显著,从等高线图可以看出等高线层次较多,且呈椭圆状,说明交互作用明显。当酶添加量在1.0%~1.5%,pH在3.0~3.5范围内,两者随着彼此的增加而呈现出增效的作用。当pH在3.5~5.0时,酶添加量在1.5%~2.0%的范围内,淀粉纯度随着两个因素的增大有一定的下降趋势,从而出现事倍功半的效果。
产生这种变化的原因可能是在低酶浓度的情况下,酶用量的增加,酶与底物接触面积增大,而蛋白酶活性受pH值的影响,在适宜pH的条件下促进了酒糟中淀粉和蛋白质的分离以及蛋白质的分解,因而使得淀粉纯度逐渐增加。而两者数值的继续增加使得当酶浓度达到过饱和时,酶与底物产生竞争,对蛋白酶产生一定的抑制作用,一部分酶分子没有与底物接触的机会,导致蛋白质酶解率降低,淀粉纯度下降[19]。而pH的逐渐提高使得酶活性受到影响,破坏了酶的反应环境,两者条件不利因素的持续恶化,造成了淀粉纯度下降。
酶解温度与两者的交互作用不显著,极有可能是在单因素试验中选择了合适的3个温度梯度,在这个温度梯度内,酶的活性都没有受到失活或者抑制的影响。因此这与酶添加量和pH值无明显的交互作用。假如温度梯度选择过大,极有可能出现极显著相关的结果。因此并不代表酶解温度与pH值和酶添加量无交互作用。因为温度对于酶促反应以及酶的活性有重要的影响,反之若找到一个合适的温度范围,那么其影响也相对的减小。
由Design-Expert8.0软件分析可知,最大响应值对应的因素条件为:酶添加量为1.99%,pH3.48,酶解温度39.57℃,酒糟淀粉纯度预测值为69.59%。
2.2.3验证试验
对响应面分析得到的最佳工艺参数进行验证试验,同时验证回归模型预测值的准确性。考虑的验证试验的可操作性,将最佳工艺条件修正为:酶添加量为2.0%,pH3.5,酶解温度40℃。验证试验进行3次平行重复试验,得到酒糟淀粉纯度平均值为70.23%,该值落在预测值的95%预测区间[68.51,70.68]内,说明优化得到的淀粉提取工艺条件参数准确可靠,该回归模型具有较好的预测效果。
2.3酒糟淀粉的微观形态
对经过优化后提取出来的淀粉样品进行扫描电镜微观结构观察,如图2。

图2 酒糟淀粉的扫描电镜图(×2 000、×5 000)Fig.2 SEM im agesofspirit-based distillers’grainsstarch(×2 000,×5 000)
从放大2 000、5 000倍的扫描电镜图可以看出,提取的酒糟淀粉表面结构较为完整、表面附着了一定的杂质、无裂痕、整体结构呈现出椭球型。证明利用酸性蛋白酶进行酶法提取酒糟淀粉,未对淀粉颗粒造成不良的影响。酒糟中的淀粉来自于高粱等禾谷类物质,比如高粱、小麦、玉米、大米等。这类物质的颗粒形态基本形状为球形、椭球型等[20]。
对于酿酒工艺来说,反复的蒸煮糊化,以及入窖发酵,这对于淀粉颗粒的影响都是巨大的,而本试验得到的酒糟淀粉呈现出与原始淀粉接近的形态,这可能是取样的问题,本试验酒糟取的是出窖底层酒糟,这层酒糟经过蒸煮糊化、低温入窖的次数较少。而站在整个窖池不同层次的角度来看,越接近上层的酒糟,面糟、红糟、丢糟中的淀粉颗粒形态可能会发生巨大的变化。其微观形态可能与原粮的颗粒形态不同。但是从提取方法的视角来看,酶法对其微观形态的影响较小。这与芦鑫[8]和姜绍通[21]等的研究结论一致。
2.4酒糟淀粉的晶体结构
对经过优化后提取出来的淀粉样品进行晶体结构观察,如图3。

图3酒糟淀粉的X射线衍射图Fig.3 X-ray diffraction patternsof spirit-based distillers’grains starch
图3 为酒糟淀粉的X射线衍射图,根据寻峰报告得出表5。
根据X衍射图谱的差异,可将淀粉的晶型结构分为A、B、C和V 4种晶型。谷物淀粉大多数为A型[22],提取的酒糟淀粉的晶型为A+V型,与原始高粱淀粉的A型不同。产生这种变化的原因有两种可能,其一是酶法提取方法的因素,造成了淀粉晶型的改变。其二是酒糟淀粉特殊性造成。由于酿酒工艺的特殊性,使得酒糟淀粉晶型的改变。因为酿酒过程的反复蒸煮以及降温无异于是通过物理或化学的方法处理淀粉,这极有可能使淀粉结构发生变化从而得到具有A+V型衍射图样的淀粉。其原因在于淀粉糊化后与脂类物质及有关化合物所形成的复合物的图谱为V型,而这种图谱在天然的淀粉中是不存在的[23]。鉴于此,产生的原因更加倾向于第二种可能。表示酶法提取酒糟淀粉对淀粉晶体结构并未产生显著的影响。

表5 X射线衍射结果分析Table5 X-Ray diffraction analysis results
3结论
通过对碱法、酶法、SDS法对酒糟淀粉进行提取,以淀粉纯度为主要参考依据,得出酶法对酒糟淀粉的提取效果较好。然后通过响应面试验优化酶法提取的主要影响参数,从而获得了酶法提取酒糟淀粉的最佳工艺参数:即酶添加量为2.0%,pH3.5,酶解温度40℃。该条件下得到酒糟淀粉纯度平均值为70.23%,建立的回归模型具有较好的预测效果。
制得的酒糟淀粉颗粒细小、较为细滑,从扫描电镜图显示该方法对淀粉颗粒未造成不良影响。从结晶性质来看,淀粉的晶型从原粮A型变为了A+V型,这极有可能与酿酒工艺的特殊性有关,而与提取方法无关,因此可以得出酶法并未对淀粉晶型造成不良的影响。酶法提取酒糟中的淀粉是可行的。
[1]沈怡芳.白酒生产技术全书[M].北京:中国轻工业出版社,2009: 284-286
[2]薛松堂,王红英,樊增绪,等.酒糟菌体蛋白饲料加工技术的应用研究[J].农业工程学报,1997(s1):143-145
[3]朱元弟.酒糟代麸皮栽金针菇试验[J].食用菌,1992(6):23
[4]张云鹏,刘军,陈娟.白酒糟植酸提取条件的优化[J].中国酿造, 2010(3):125-127
[5]王玉美,卢红梅.茅台酒糟食醋的研制[J].食品科技,2009,34(3): 249-253
[6]于泓鹏,高群玉,曾庆孝.大米淀粉制备及其综合利用研究进展[J].粮食与油脂,2004(4):14-16
[7]Shirahama K,Tsujii K,Takagi T.Free-boundary electrophoresis of sodium dodecyl sulfate-protein polypeptide complexeswith special reference to SDS-polyacrylamide gel electrophoresis.[J].Journal of Biochemistry,1974,75(75):309-319
[8]芦鑫,张晖,姚惠源.不同提取方法对粳米淀粉结构的影响[J].食品科学,2008,29(1):102-106
[9]郭晓冬,李颖.小米淀粉提取方法的比较[J].中国粮油学报,2011, 26(5):26-29
[10]翁忠岚.DNS比色法测定酿酒原料高粱中的淀粉含量[J].酿酒, 2004,31(3):67-68
[11]高群玉,叶营,王琳.湿热处理对不同晶型淀粉理化性质及消化性的影响[J].现代食品科技,2015(3):60-65
[12]陈翠兰,张本山,陈福泉.淀粉结晶度计算的新方法[J].食品科学, 2011,32(9):68-71
[13]何义萍,韩小贤,赵亚娟,等.碱法和超声辅助酶法分离燕麦淀粉的比较研究[J].食品与机械,2011,27(6):95-97
[14]张兆丽,熊柳,孙高飞,等.花生淀粉的提取及性质研究[J].中国粮油学报,2009,24(2):77-81
[15]Beta T,Corke H,Taylor JRN,etal.Effectofsteeping treatmenton pastingand thermalpropertiesofsorghum starches[J].CerealChemistry,2001,78(3):303-306
[16]王贵荣.酒糟利用情况调研报告[J].酿酒,1998(2):1-5
[17]李建,叶翔.酒糟综合利用多元化研究[J].中国酿造,2013,32(12): 121-124
[18]李大峰,贾冬英,姚开,等.白芷淀粉的提取工艺研究[J].现代食品科技,2011,27(2):203-205
[19]韩伟,马婉婉,骆开荣.酶法提取技术及其应用进展[J].现代制造, 2010(17):15-18
[20]Tester R F,Karkalas J,QiX.Starch-composition,fine structureand architecture[J].JournalofCereal Science,2004,39(2):151-165
[21]姜绍通,殷嘉忆,王华林,等.响应面法优化酶法提取芋头淀粉工艺参数[J].食品科学,2014,35(6):24-29
[22]Zhang G,Venkatachalam M,Hamaker B R.Structural basis for the slow digestion property of native cereal starches[J].Biomacromolecules,2006,7(11):3259-3266
[23]张玉玉.青稞淀粉的提取及特性研究[D].郑州:河南工业大学, 2010:39-40
Extraction Conditions of Starch from Spirit-based Distillers'Grains of Luzhou-flavor Liquor
DIAOChong1,LILi1,WANGXiang-yu2,GUOYu-liu3,YOUQi4,ZONGXu-yan1,*
(1.Sichuan University ofScience&Engineering,Zigong 643000,Sichuan,China;2.Novozymes(China)InvestmentCo.,Ltd.,Beijing100085,China;3.HeilongjiangUniversity,Harbin 150080,Heilongjiang,China;4.Sichuan Langjiu Group Co.,Ltd.,Luzhou 646523,Sichuan,China)
The effects of the alkaline,enzyme,SDS extraction methods on the purity of starch from Spiritbased distillers'grains of Luzhou-flavor liquor.The results showed that,the highest purity of distillers'grains starch was enzyme extractionmethods.Based on single factor experiments,according to the principles of Box-Behnken centralcomposite design,three factorsand three levels response surfacemethod wasemployed to optimize the distillers'grains extraction conditions.The results revealed that the optimum enzymatic extraction pa rametersofdistillers'grainsstarchwereas following:enzyme dosage2%,pH 3.5,enzymatic temperature 40℃. Under this condition,the purity of distillers'grains starch was 70.23%.The physicochemical indexes of prepared distillers'grainsstarchwere revealed that:scanning electronmicroscopy figure revealed that the extractionmethod caused no damage to starch granule.Compared with native starch,the original A-type structure of native starch changed to(A+V)-type structure of distillers'grains.Perhaps it is not related to the extraction methodsbut theproduction techniquesof Luzhou-flavor liquor.
distillers'grains of Luzhou-flavor liquor;starch;extraction;response surface methodology;physicochemicalproperty
10.3969/j.issn.1005-6521.2017.05.014
2016-11-02
固态酿造关键技术研究四川省院士(专家)工作站开放基金项目(GY2014-01);酿酒生物技术及应用四川省重点实验室开放基金项目(NJ2014-07);泸州老窖科研奖学金项目(13ljzk6)
刁冲(1990—),男(汉),硕士研究生,研究方向:发酵工程。
*通信作者:宗绪岩(1976—),男,副教授,博士,主要从事食品生物化学、酶学应用及发酵过程控制的研究。
