肢体缺血后处理对大鼠慢性脑缺血后脑内LINGO-1的表达及神经功能的变化*
2017-04-11陈本宏滕素玲王福文
梁 辰, 陈本宏, 滕素玲, 王 燕, 王福文△
(1济南大学, 山东省医学科学院医学与生命科学学院,山东 济南 250200; 2山东省医学科学院药物研究所,国家卫生部生物技术药物重点实验室,山东省罕少见病重点实验室,山东 济南 250062; 3平阴县中医医院,山东 济南 250400)
肢体缺血后处理对大鼠慢性脑缺血后脑内LINGO-1的表达及神经功能的变化*
梁 辰1, 2, 陈本宏3, 滕素玲1, 2, 王 燕1, 2, 王福文1, 2△
(1济南大学, 山东省医学科学院医学与生命科学学院,山东 济南 250200;2山东省医学科学院药物研究所,国家卫生部生物技术药物重点实验室,山东省罕少见病重点实验室,山东 济南 250062;3平阴县中医医院,山东 济南 250400)
目的: 观察大鼠肢体缺血后处理后脑内LINGO-1表达的变化,研究肢体缺血后处理改善慢性脑缺血后神经损伤的分子机制。方法: 采用50%三氯化铁处理双侧颈总动脉的方法建立慢性脑缺血模型,随机将大鼠分为假手术组、模型组和肢体缺血后处理组。大鼠肢体缺血后处理3周后采用三等分Y型电迷宫方法观察各组大鼠的学习记忆能力,RT-qPCR检测LINGO-1的mRNA,Western blot法测定LINGO-1的蛋白水平。结果: 与模型组相比,肢体缺血后处理组大鼠学习记忆能力显著增加(P<0.05)。假手术组大鼠LINGO-1的mRNA及蛋白水平有少量阳性表达。肢体缺血后处理组大鼠LINGO-1的mRNA及蛋白水平均显著下降(P<0.05)。结论: 慢性脑缺血大鼠脑内LINGO-1水平明显上调,肢体缺血后处理可明显降低LINGO-1的表达水平,并提高学习记忆能力,这可能是肢体缺血后处理改善慢性脑缺血神经功能的分子机制之一。
LINGO-1; 慢性脑缺血; 肢体缺血后处理
慢性脑缺血是指各种原因导致的长期脑血流灌注不足(低于400~600 mL·kg-1·min-1),在血管性痴呆(vascular dementia, VD)、Binswanger病、老年性痴呆(Alzheimer’s disease, AD)等多种神经系统疾病的发生发展过程起着重要的作用。脑组织长期处于慢性缺血状态可呈现大脑皮质萎缩、神经元变性、脑白质疏松、胶质细胞增生等一系列病理改变, 导致认知功能下降,进而发展为VD、Binswanger病、AD等多种脑血管疾病。对于慢性脑缺血,目前治疗方法较多,如使用脑保护剂、针灸疗法等,但对于肢体缺血后处理(limb ischemic postconditioning, LIP)改善慢性脑缺血症状的分子机制研究尚不完善。肢体缺血后处理由Vinten-Johansen等人于2002年在英国首先提出[1],是指对模型动物肢体进行反复多次的缺血再灌注,主要用于改善心肌缺血再灌注损伤的研究[2-3],在治疗急性脑缺血疗效方面也有相关研究[4],但对改善慢性脑缺血症状的分子机制研究较少。
含富亮氨酸重复序列和免疫球蛋白结构域的Nogo受体相互作用蛋白1(leucine-rich repeat and Ig domain-containing, Nogo receptor-interacting protein-1, LINGO-1)是一种神经再生抑制性因子,含富亮氨酸重复片段结构域,在抑制轴突再生、少突胶质细胞分化及髓鞘形成、神经元存活等信号通路中有着重要作用。有研究表明LINGO-1参与慢性脑缺血损伤后神经细胞再生过程[5],但LIP对LINGO-1的影响尚未见报道。本研究观察LIP后慢性脑缺血大鼠脑组织LINGO-1的表达变化,初步探讨LIP对慢性脑缺血损伤恢复可能的分子机制。
材 料 和 方 法
1 动物及分组
SPF级Wistar大鼠30只,体重 250~300 g,雌雄各半。动物饲养于屏蔽环境,温度20~26 ℃,相对湿度40%~70%,昼夜明暗交替时间10 h/14 h。SPF大小鼠繁殖饲料由北京科澳协力饲料有限公司提供,自由饮水。将动物随机分为3组,即假手术(sham)组、模型(model)组和LIP组。每组10只。
2 试剂及仪器
三氯化铁(FeCl3)由上海化学试剂厂生产,分析纯,用双蒸水配成至所需浓度;兔抗大鼠LINGO-1抗体(Noves);辣根过氧化物酶标记的山羊抗兔 IgG(H+L),Western blot、IP细胞裂解液,BCA蛋白浓度测定试剂盒(上海碧云天生物科技研究所);ECL化学发光底物(Thermo);小鼠/兔IgG免疫组化试剂盒(博士德生物工程有限公司)。Y迷宫(张家港市生物仪器厂);J-25型高速冷冻离心机(Beckman Coulter);DYY-6C型电泳仪(北京六一仪器厂);ImageQuant LAS 4000型化学发光成像仪(GE Healthcare)。
3 方法
3.1 慢性脑缺血模型制备 采用三氯化铁诱导大鼠颈总动脉血栓制备慢性脑缺血模型。大鼠腹腔注射3%戊巴比妥钠(2 mL/kg)麻醉后仰卧位固定,从中线纵行切开颈部皮肤约2 cm,剪开浅筋膜,手术分离并暴露双侧颈总动脉和迷走神经。滴上少许利多卡因, 以减少对迷走神经的刺激。仔细分离颈总动脉约1.5~2.0 cm。在双侧颈总动脉下放置自制弧形塑料垫(5 cm×1 cm),以保护血管周围组织。将吸有50% FeCl3溶液2 μL的2 mm×4 mm小片滤纸贴敷在此段动脉上30 min后取下,用生理盐水冲洗局部组织。伤口撒适量青霉素抗感染,然后逐层缝合,回笼饲养。
3.2 肢体缺血后处理 将大鼠固定在大鼠固定套管中,将自制的无创型血压测定仪套管套住大鼠双后肢肢根部,充气加压至200 mmHg,使脉搏消失即为阻断股动脉标志,持续10 min后放气,再灌注5 min,共3个循环。每天早晚各处理1次,连续处理3周。
3.3 Y迷宫训练 实验在黑暗、安静环境下进行。迷宫有3个臂,每个臂的顶端都装有灯泡,箱底装有平行相间的铜棒。两黑暗臂箱底通电,安全区方向给予灯光信号。将大鼠放入3臂均未通电的起步区中适应暗环境3 min,3 min后随机变换安全区位置,安全区灯亮2 s后,如果大鼠停留在黑暗处或另一黑暗臂底,即遭电击(85~90 V),大鼠受点击后从起步区直接逃避到安全区为正确反应,否则为错误反应。30 s后熄灯,结束1次训练,休息30 s后重复。LIP结束前3 d,每日每只大鼠训练20次,连续训练3 d后,记录每只大鼠20次电击逃到安全区位置的正确反应次数,评价其学习能力。
3.4 动物取材 大鼠手术结束3周后,分别腹腔注射20%乌拉坦(4 mL/kg)麻醉,放血后迅速取出大脑,在大脑同一位置取脑组织200~250 mg,装入EP管中,置于-80 ℃冰柜中保存备用。
3.5 Western blot实验检测脑组织中LINGO-1的表达 取-80 ℃冰柜保存的脑组织100 mg,液氮中研磨后加入含1 mmol/L PMSF的裂解液1 mL研磨均匀,倒入玻璃匀浆器中充分裂解,设置高速低温离心机的条件为14 000 r/min、4 ℃ 离心10 min,取上清液,分装,-80 ℃保存备用。BCA试剂盒测定匀浆上清液的蛋白浓度,按常规方法进行SDS-PAGE分离蛋白,转膜、封闭、孵育LINGO-1抗体(1∶1 000)等,最终用化学发光成像仪进行显影后,应用ImageJ图像处理系统处理蛋白条带,进行半定量分析。
3.6 RT-qPCR 检测脑组织中LINGO-1的mRNA表达 取-80 ℃冰柜保存的脑组织100 mg,在液氮中研磨成粉末状,加入1 mL TRIzol对组织进行裂解,充分匀浆,高速低温离心机离心5 min,取上清液,加入200 μL氯仿,剧烈振荡15 s,室温静置10 min。相同条件离心10 min后将水层转移到一个新的EP管中。加入500 μL异丙醇,颠倒数次混匀后,室温静置10 min,相同条件离心10 min,保留沉淀在管底,用75%乙醇进行洗涤,离心后吸除上清,适度风干。加入30 μL DEPC水溶解RNA沉淀,上下振荡。逆转录采用反转录试剂盒将总RNA逆转录为cDNA 第 1 链,反应体积10 μL,37 ℃15 min,85 ℃ 5 s。以β-actin作为内参照。LINGO-1的上游引物序列为 5’-GGTGTTGTAGGAGGAGACGGA-3’,下游引物序列为5’-CAATCGCATGTCTCTCTTGCC-3’,PCR产物为75 bp,内参照采用β-actin,上游引物序列为 5’-CTAAGGCCAACCGTGAAAAG-3’,下游引物序列为5’-ACCAGAGGCATACAGGGACA-3’,PCR产物为104 bp。以每个样品目的基因的表达阈值与内参照基因表达阈值的差(ΔCt)为其相对表达量,各处理组目的基因的ΔCt与对照组目的基因的ΔCt差值计为ΔΔCt,以2-ΔΔCt表示为目的基因在药物处理组的表达量与在对照组表达量的比值,并进行统计学分析。PCR产物同时进行琼脂糖凝胶电泳进一步验证结果。
4 统计学处理
应用SPSS 19.0 统计软件进行数据处理。数据以均数±标准差(mean±SD)表示,组间差异比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 Y迷宫实验
实验结果表明,模型组大鼠正确反应次数较假手术组显著降低(P<0.01),而LIP组大鼠较模型组正确反应次数显著增加(P<0.05),见图1。

Figure 1.The effect of limb ischemic postconditioning (LIP) on correctly reflect times by Y maze in chronic cerebral ischemic rats. Mean±SD. n=10. **P<0.01 vs sham group; #P<0.05 vs model group.
2 LINGO-1 mRNA表达的变化
RT-qPCR结果显示假手术组LINGO-1的mRNA少量表达,模型组大鼠脑组织中LINGO-1的mRNA表达量显著升高(P<0.01),而LIP组较模型组LINGO-1 mRNA表达量显著降低(P<0.01)。琼脂糖凝胶电泳显示结果与之相一致,见图2。
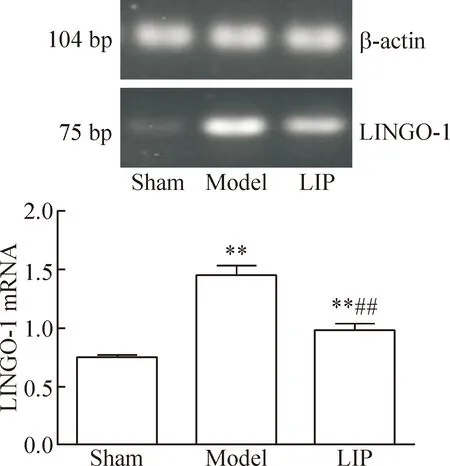
Figure 2.The mRNA expression of LINGO-1 in chronic cerebral ischemic brain tissues in different groups. Mean±SD. n=10. **P<0.01 vs sham group; ##P<0.01 vs model group.
3 LINGO-1蛋白表达的变化
假手术组可见LINGO-1少量表达。模型组大鼠脑组织中的LINGO-1水平明显升高(P<0.01),而LIP组较模型组LINGO-1水平显著降低(P<0.01),见图3。

Figure 3.The protein expression of LINGO-1 in chronic cerebral ischemic brain tissues in different groups. Mean±SD. n=10. **P<0.01 vs sham group; ##P<0.01 vs model group.
讨 论
LINGO-1是Nogo受体复合物[NgR/LINGO-1/p75(或TROY)]中的一种跨膜蛋白,含富亮氨酸重复序列和免疫球蛋白结构,抑制少突胶质细胞分化和髓鞘形成,降低神经元存活率,减少轴突再生。在正常神经系统中,LINGO-1的表达被抑制,在神经病理模型中表达上调[6]。LINGO-1的神经抑制作用具体表现为:(1) 抑制轴突生长:Nogo等髓鞘相关抑制因子通过LINGO-1激活小G蛋白RhoA,使其抑制神经突起的生长。Chen等[7]应用RNA干扰技术研究表明,LINGO-1参与调节髓鞘抑制因子,上调RhoA活性,从而调节抑制信号抑制中枢神经再生。由此可见,LINGO-1能通过调节RhoA信号通路介导跨膜信号传导,进而抑制轴突生长。(2)抑制少突胶质细胞髓鞘分化:LINGO-1负性调节少突胶质细胞再生和髓鞘形成。Zhang等[8]研究表明,当LINGO-1的功能受到抑制时,RhoA作用降低,少突胶质细胞的分化功能和髓鞘形成增强,说明LINGO-1可通过RhoA信号通路调节少突胶质细胞分化和髓鞘形成。此外,LINGO-1可与神经生长因子受体TrkA形成受体复合物,激活TrkA可上调LINGO-1进而抑制髓鞘形成。(3)参与神经元的凋亡过程:抑制神经元存活主要通过PI3K/Akt信号通路调节,PI3K/Akt通路可阻断多种诱导细胞凋亡的细胞因子,进而抑制细胞凋亡,促进细胞存活。表皮生长因子受体(epidermal growth factor receptor,EGFR)是连接LINGO-1和PI3K/Akt通路的桥梁。Zhou等[9]研究发现LINGO-1能通过负性调控EGFR进而抑制PI3K/Akt信号通路活性,提高浦肯野细胞存活率。
LIP的概念于2002提出,2009年Ren等[10]首次报道了LIP能有效减少脑梗死面积。但LIP脑保护的作用机制至今尚不完善,其中LINGO-1与LIP之间的关系研究甚少,据此本实验对两者之间的联系进行了初步探索。实验结果发现,LIP可明显改善慢性脑缺血大鼠学习记忆能力并显著降低其脑组织内LINGO-1蛋白表达水平,因此推测抑制LINGO-1的表达是LIP改善慢性脑缺血损伤的机制之一。那么LIP对LINGO-1的调节,是否与上述机制有关呢?通过文献检索我们发现,一氧化氮(nitric oxide,NO)能扩张血管,维持血流量,对心脑血管有很重要的保护作用[11]。而LIP可以通过抑制一氧化氮合酶(nitric oxide synthase,NOS)解偶机制促进NO合成,进而改善脑缺血损伤[12]。Zhou等[13]研究表明,PI3K/Akt信号通路能促进NO产生,参与神经细胞生长、增殖、分化和凋亡过程,且LIP可以通过调节Akt信号通路防止缺氧所致的新生儿脑缺血损伤。因此我们推测LIP减轻慢性脑缺血损伤的通路之一可能是通过下调LINGO-1的表达,从而抑制NOS解偶,进而激活PI3K/Akt信号通路促进NO生成产生脑保护作用。另外LIP与LINGO-1的关系是否与抑制轴突生长和少突胶质细胞的分化有关,以及上述推测是否准确还有待下一步实验的研究。
本实验采用三氯化铁诱导颈总动脉形成血栓的方法建立慢性脑缺血模型,目的在于减少大鼠创伤,提高存活率,建立更合理的慢性脑缺血模型。LIP明显改善慢性脑缺血症状,也有可能与血栓溶解有关,在下一步实验中有待验证。
综上所述,慢性脑缺血大鼠脑内LINGO-1水平明显上调,LIP可下调LINGO-1的表达量,减少神经细胞凋亡,促进神经功能恢复,提高学习能力,改善慢性脑缺血症状。因此,负性调节LINGO-1蛋白表达可能是LIP改善慢性脑缺血损伤的分子机制之一。
[1] Baxter GF, Yellon DM. Current trends and controversies in ischemia-reperfusion research:meeting report of the Hatter Institute 3rd International Workshop on Cardioprotection[J]. Basic Res Cardiol, 2003, 98(2):133-136.
[2] Jang YH, Kim JH, Ban C, et al. Stromal cell derived factor-1 (SDF-1) targeting reperfusion reduces myocardial infarction in isolated rat hearts[J]. Cardiovasc Ther, 2012, 30(5):264-272.
[3] Yang XM, Liu Y, Cui L, et al. Platelet P2Y12 blockers confer direct postconditioning-like protection in reperfused rabbit hearts[J]. Cardiovasc Pharmacol Ther, 2013, 18(3):251-262.
[4] 李树清, 李 凡, 何 亮, 等. 缺血后适应促进树鼩血栓性脑缺血时紧密连接occludin/ZO-1蛋白表达及抑制脑水肿的机制[J]. 中国病理生理杂志, 2016, 32(3):477-484.
[5] Bai Y, Markham K, Chen F, et al. Theinvivobrain interactome of the amyloid precursor protein[J]. Mol Cell Proteomics, 2008, 7(1):15-34.
[6] Fernandez-Enright F, Andrews JL. LINGO-1: a novel target in therapy for Alzheimer’s disease? [J]. Neural Regen Res, 2016, 11(1):88-89.
[7] Chen N, Cen JS, Wang J, et al. Neural stem cells promotes neuronal differentiation and functional recovery in rats subjected to spinal cord injury[J]. Crit Care Med, 2016, 44(3):e146-e157.
[8] Zhang ZH, Li JJ, Wang QJ, et al. WNK1 is involved in Nogo66 inhibition of OPC differentiation[J]. Mol Cell Neurosci, 2015, 65(1):135-142.
[9] Zhou ZD, Sathiyamoorthy S, Tan EK. LINGO-1 and neurodegeneration: pathophysiologic clues for essential tremor[J]. Tremor Other Hyperkinet Mov (N Y), 2012, 2:tre-02-51-249-1.
[10]Ren C, Yan Z, Wei D, et al. Limb remote ischemic postconditioning protects against focal ischemia in rats[J]. Brain Res, 2009, 1288:88-94.
[11]王诗才, 陈太军, 黄美松, 等. 脑源性神经营养因子保护H2O2诱导的氧化损伤血管内皮细胞[J]. 中国病理生理杂志, 2015, 31(8):1384-1394.
[12]Chen G, Yang J, Lu G, et al. Limb remote ischemic post- conditioning reduces brain reperfusion injury by reversing eNOS uncoupling[J]. Indian J Exp Biol, 2014, 52(6):597-605.
[13]Zhou Y, Fathali N, Lekic T, et al. Remote limb ischemic postconditioning protects against neonatal hypoxic-ischemic brain injury in rat pups by the opioid receptor/Akt pathway [J]. Stroke, 2011, 42(2):439-444.
(责任编辑: 卢 萍, 罗 森)
Effects of limb ischemic postconditioning on expression of LINGO-1 in brain and neural function after focal cerebral infarction in rats
LIANG Chen1, 2, CHEN Ben-hong3, TENG Su-ling1, 2, WANG Yan1, 2, WANG Fu-wen1, 2
(1SchoolofMedicineandLifeSciences,UniversityofJinan,ShandongAcademyofMedicalSciences,Jinan250200,China;2InstituteofMateriaMedica,ShandongAcademyofMedicalSciences,KeyLaboratoryforBiotech-DrugsofMinistryofHealth,KeyLaboratoryforRare&UncommonDiseasesofShandongProvince,Jinan250062,China;3PingyinCountyHospitalofTraditionalChineseMedicine,Jinan250400,China.E-mail:wangfuwww@tom.com)
AIM: To observe the expression of LINGO-1 in the rat brain after ischemic stroke, and to explore the molecular mechanism of improving the neural damage after chronic cerebral ischemia by limb ischemic preconditioning (LIP). METHODS: The chronic cerebral ischemia model was established by the method of processing bilateral common carotid arteries with 50% FeCl3. The rats were randomly divided into sham operation group, model group and LIP group. The study and memory abilities of the animals were observed by the test of Y-type labyrinth after treatment for 2 weeks, and the mRNA and protein expression of LINGO-1 was detected by RT-qPCR and Western blot. RESULTS: Compared with model group, the study and memory abilities were significantly increased (P<0.05). Only a small amount of positive expression of LINGO-1 at mRNA and protein levels in sham operation group was observed. The expression of LINGO-1 in model group was increased significantly. Compared with model group, the expression of LINGO-1 at mRNA and protein levels was significantly decreased in LIP group (P<0.05). CONCLUSION: LIP improves the study and memory abilities and reduces the expression level of LINGO-1. LINGO-1 may be one of the molecular targets for LIP improving the neural function of chronic cerebral ischemia.
LINGO-1; Chronic cerebral ischemia; Limb ischemic postconditioning
1000- 4718(2017)03- 0548- 05
2016- 11- 16
2016- 12- 21
山东省重大新药创制中心建设项目(No. 2009ZX09301-013)
△通讯作者 Tel: 0531-82919972; E-mail: wangfuwww@tom.com
R363
A
10.3969/j.issn.1000- 4718.2017.03.028
