心肌内向整流钾通道激动剂抑制异丙肾上腺素所致大鼠心室重构*
2017-04-11郭云飞翟旭雯吴博威刘清华
杨 迎, 郭云飞, 翟旭雯, 张 研, 李 盼, 张 莉, 吴博威, 刘清华△
(山西医科大学 1病理生理学教研室, 2生理学教研室,山西 太原 030001; 3山西省儿童医院,山西 太原 030013)
心肌内向整流钾通道激动剂抑制异丙肾上腺素所致大鼠心室重构*
杨 迎1, 郭云飞1, 翟旭雯2, 张 研1, 李 盼1, 张 莉3, 吴博威2, 刘清华1△
(山西医科大学1病理生理学教研室,2生理学教研室,山西 太原 030001;3山西省儿童医院,山西 太原 030013)
目的: 观察和探讨内向整流钾通道(IK1)激动剂盐酸扎考必利(zacopride, Zac)对异丙肾上腺素(isoproterenol,Iso)所致心室重构的影响及作用机制。方法: SD大鼠随机分为正常对照组、Iso模型组、Zac干预组、Zac+氯喹干预组和卡托普利阳性对照组。腹腔注射异丙肾上腺素3 mg/kg,每天1次,连续给药10 d,观测各组全心质量/体质量比和左心室质量/体质量比。用全细胞膜片钳技术检测大鼠心室肌细胞电压门控钙电流(ICa-L)、静息膜电位(RMP)及动作电位时程(APD)的变化。选用新生1~3 d的SD乳鼠,用0.08%胰蛋白酶和0.04% Ⅱ型胶原酶消化心脏组织,经差速贴壁法和5-溴脱氧尿嘧啶核苷纯化心肌细胞后随机分成正常对照组、Iso模型组、Zac干预组、Zac+BaCl2干预组和Zac+氯喹干预组,培养24 h后用激光共聚焦显微镜检测心肌细胞内游离钙离子浓度。结果: Iso模型组与正常对照组比较,全心肥厚指数、左心室肥厚指数明显增加,膜片钳结果提示RMP减小,APD明显延长;Zac干预组明显抑制心肌肥大,并增大RMP,缩短APD。同时应用低剂量IK1抑制剂氯喹可明显抑制Zac的抗心室重构作用,并逆转Zac对RMP和APD影响。在乳鼠心肌细胞,Iso可使细胞表面积增大,细胞内[Ca2+]i增高;Zac干预后细胞形态恢复至正常或接近正常水平,并显著减轻钙超载。IK1阻断剂BaCl2和氯喹可阻断Zac的效应。结论: IK1选择性激动剂Zac明显抑制异丙肾上腺素所致的心室重构,其机制可能为增强IK1,进而增大RMP,缩短APD,从而阻断心肌细胞内钙超载依赖的信号通路。
内向整流钾通道; 异丙肾上腺素; 钙超载; 心室重构; 扎考必利
心室重构是心室肌受到损伤时发生的以心肌细胞肥大及间质纤维化为特点的适应性反应,最终将造成心室形态结构改变和心力衰竭。在心室重构的进程中,往往伴有某些离子通道、交换体和离子泵的变化,即电重构,如心肌电压门控钙电流(ICa-L)的变化,瞬时外向钾电流(transient outward potassium current, Ito)、ATP敏感性钾电流(ATP sensitive potassium current, IKATP)和内向整流钾电流(inward rectifier potassium current, IK1)下调,钠钙交换电流(Na+-Ca2+exchanger current, INa/Ca)增强及钠钾泵的抑制等[1-2]。近年来的研究显示,电重构不仅是心肌肥大的结果,还可先于组织重构发生,进而影响组织重构过程[3],这提示研究者需重新探究电重构与组织重构的关系,并尝试将离子通道作为有效干预心室重构的新靶点。很多文献报道,ATP敏感钾通道(KATP通道)在心室重构中具有重要作用,业已证明,KATP通道激动剂显著减轻了多种原因诱发的心室重构[4-5]。IK1和KATP分别由Kir2.x通道和Kir6.x通道构成,它们同属于内向整流钾通道家族,而且孔道形成亚单位的分子结构相似[6]。实验研究还表明IK1下调是心衰心肌电重构的重要特征[7]。因此,我们设想,IK1通道的变化同样涉及心室重构的过程,激动心肌IK1可能同样具有抗心室重构的作用。
本课题组首次报道了一个IK1通道选择性激动剂扎考必利(zacopride, Zac)[8]。利用这个药理学工具药我们观察激动心肌IK1对异丙肾上腺素(isoproterenol,Iso)所致成年大鼠心室重构和乳鼠心肌细胞钙超载的影响,并进一步探讨IK1激动剂抗心室重构的可能机制。
材 料 和 方 法
1 实验动物
健康SD大鼠(军科院实验动物中心,合格证编号为0009841),雄性,体重200~250 g;新生1~3 d的SD大鼠乳鼠,雌雄不限,购自山西医科大学实验动物中心。
2 药品、试剂和主要仪器
Iso和Zac购自Tocris;氯喹、卡托普利(captoril)和5-溴脱氧尿嘧啶核苷(5-bromodeoxyuridine,BrdU)购自Sigma;DMEM、青霉素和链霉素购自HyClone;胎牛血清、胰蛋白酶和Ⅱ型胶原酶购自Gibco;其余均为国内生产分析纯产品。主要仪器为Axopatch 200B膜片钳放大器(Molecular Devices)和FV1000激光共聚焦显微镜(Olympus)。
3 实验方法
3.1 异丙肾上腺素致在体大鼠心室重构模型的建立 8周龄大小的健康SD大鼠随机分为6组,即正常对照(control)组、Zac组、Iso模型组、Iso+Zac组、Zac+氯喹(chloroquine, Chlo)干预(Iso+Zac+Chlo)组和卡托普利阳性对照(Iso+captopril)组。除control组和Zac组外,其余各组动物均腹腔注射异丙肾上腺素(3 mg·kg-1·d-1),control组腹腔注射等量的生理盐水,Zac组和Iso+Zac组腹腔注射15 μg/kg Zac,Zac+Chlo组同时腹腔注射15 μg/kg Zac和7.5 μg/kg氯喹,卡托普利阳性对照组按100 mg·kg-1·d-1给予卡托普利。连续给药10 d。所有大鼠均饲以常规固体饲料和自来水,于停药24 h禁食过夜,然后观察相应指标。
3.2 取心称重及保存 停药24 h禁食过夜,麻醉后快速开胸取出心脏置于4 ℃预冷的生理盐水,由主动脉逆行冲洗心脏血液后,用双层滤纸吸干水分,电子天平准确称量全心质量,去除心房及瓣膜组织,沿室间隔剪开左心室和右心室,去除大血管及心包组织,称量左心室质量,最后计算全心质量/体质量比和左心室质量/体质量比。
3.3 分离单个大鼠心室肌细胞 术前15 min腹腔静脉注射肝素,戊巴比妥钠(65 mg/kg)麻醉后颈动脉放血,迅速开胸取出心脏,置于4 ℃用100%氧气饱和的无钙台氏液中修剪,然后将心脏悬挂在Langendorff灌流装置上经主动脉逆行灌流。先用无钙台氏液灌流8~10 min,再用酶液循环灌流15~20 min。 灌流过程中保持37 ℃恒温,灌流压6.86 kPa,并持续通以100%氧气。待心室肌组织变大、变软后将其剪碎,置于KB 液中轻轻吹打得到分散的心室肌细胞,经150 μm孔径的滤网过滤后保存于KB液中,室温放置2~3 h进行实验。
3.4 全细胞膜片钳技术记录ICa-L、静息膜电位(res-ting membrane potential, RMP)及动作电位(actin potential, AP) 实验前先将存放于高钾KB液中的细胞逐步复钙。取几滴细胞悬液加入细胞池(约1 mL),平放在连有微操纵仪的倒置显微镜上静置10 min,待细胞充分贴壁后,用台氏液灌流,速度约2 mL/min。电极用玻璃毛细管经微电极拉制仪(Narishige)分2步拉制而成,充灌电极内液后,电阻约2~5 MΩ。选取横纹清晰的心肌细胞进行实验。形成高阻抗封接后,用负压破膜,进行全细胞记录。离子电流信号经Axopatch 200B膜片钳放大器、Digidata 1322A模数转换器及pCLAMP 8.0采集、贮存及分析。电压钳方式下进行全细胞ICa-L记录,电流钳方式下记录RMP及AP。
3.5 乳鼠心肌细胞的分离、培养和建立心肌重构细胞模型 75%乙醇浸泡消毒乳鼠,立即取出心脏并放入冰冷的PBS液中,切取心室,初步洗去心室内的血液后,转移入EP管中,剪成(1~3) mm×1 mm×1 mm的碎块,静置5 min后,弃上清,加入0.04% Ⅱ型胶原酶液和0.08%胰蛋白酶(按照2∶1体积临时混和,总量随心脏组织多少调整),37 ℃消化6~8 min,静置后吸出上清置于50 mL离心管(预先加入25 mL含15% FBS的DMEM培养基)中,终止胰酶作用。再次加入混合酶液,重复以上步骤,直至组织块基本消化干净。将所有收集的细胞悬液800 r/min 离心10 min收集细胞,重悬后200目滤网过滤,细胞种植于培养瓶中进行预贴壁培养。2 h后收集未贴壁心肌细胞悬液以适当密度种植于6孔板,加BrdU至终浓度为0.1 mmol/L抑制非心肌细胞增殖,血清饥饿48 h后按组加入药物,原代培养的心肌细胞分成5组:control组、Iso(1 μmol/L)组、Iso+Zac(1 μmol/L)组、Iso+Zac+BaCl2(1 μmol/L)组和Iso+Zac+Chlo(0.3 μmol/L)组。
3.6 加载荧光染料及钙成像 心肌细胞用PBS液冲洗2遍,用100 μL含5 μmol/L钙离子探针Fluo-4/AM滴于盖玻片上,37 ℃避光40 min,PBS液冲洗玻片3遍,洗去多余染料,保留少许PBS液平衡细胞10 min,于20 min内进行细胞内Ca2+浓度(intracellular Ca2+concentration,[Ca2+]i)检测。加载好荧光染料的细胞置于共聚焦激光扫描镜的载物台上,进行形态观测,随机选取心肌细胞,计算心肌细胞表面积和测定胞内游离钙的荧光值。
4 统计学处理
数据以均数±标准差(mean±SD)或均数±标准误(mean±SEM)表示,采用SPSS 16.0统计软件进行单因素方差分析,组间两两比较采用q检验,以P<0.05为差异有统计学意义。
结 果
1 Zac对在体异丙肾上腺素所致的心室重构的影响
异丙肾上腺素可导致心脏体积增大,全心肥厚指数和左心室肥厚指数显著升高,而Zac可有效逆转异丙肾上腺素所致心室重构,其效应与公认的抗重构药物卡托普利相似。应用低剂量氯喹选择性阻断IK1可消除Zac的抗心室重构作用,表明Zac的抗重构作用是通过其激动IK1通道介导的,见图1、表1。
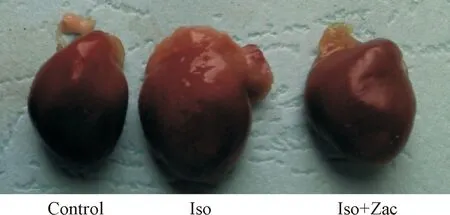
Figure 1.The effects of zacopride (Zac) on isoproterenol (Iso)-induced cardiac hypertrophy in the rats.

表1 Zac对异丙肾上腺素所致心室重构的影响
BW: body weight; HW: heart weight; LVW: left ventricular weight; Chlo: chloroquine.**P<0.01vscontrol;△△P<0.01vsIso;##P<0.01vsIso+Zac.
2 Zac对心室肌细胞RMP和动作电位时程(action potential duration, APD)的影响
长期应用异丙肾上腺素可导致心室肌细胞发生电重构,RMP减小,细胞膜去极化,APD明显延长。应用Zac干预后可使RMP增大甚至恢复至生理水平,并缩短APD(P< 0.01)。小剂量氯喹选择性阻断IK1可消除Zac的作用,表明Zac抗电重构作用是通过其激动IK1通道介导的,见图2、表2。
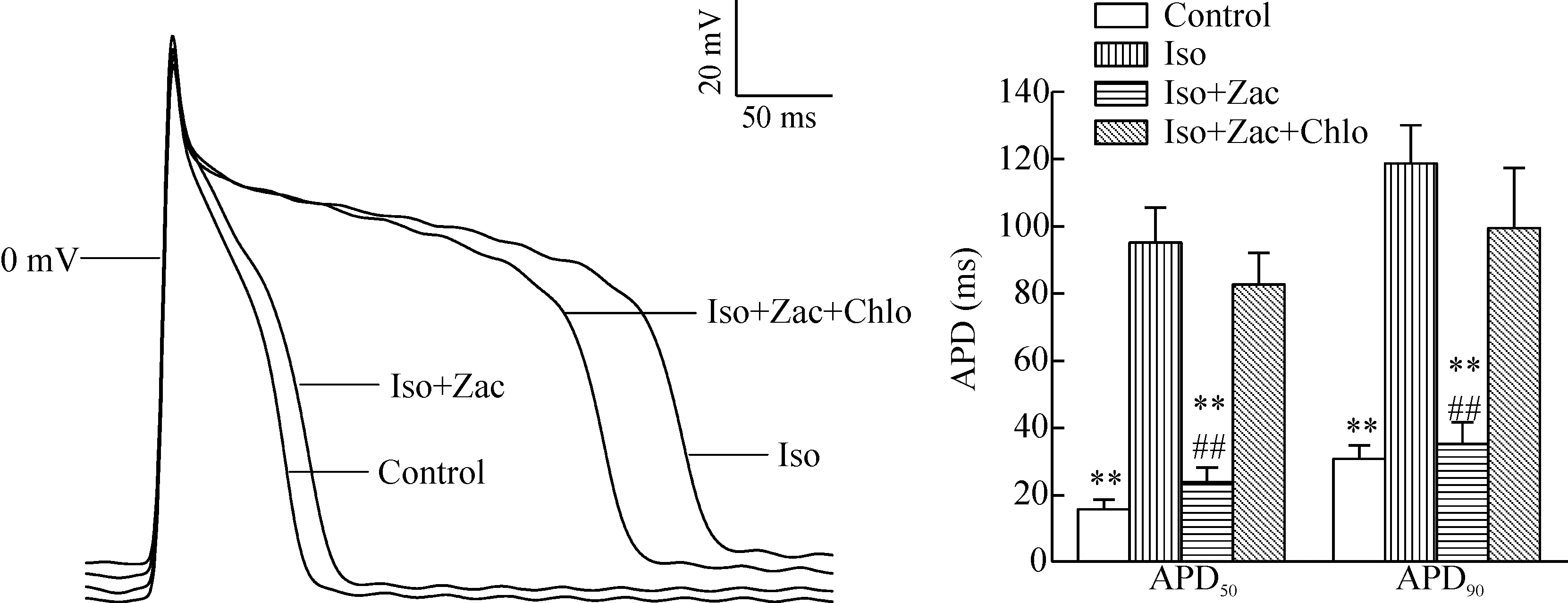
Figure 2.The effects of zacopride (Zac) on the resting membrane potential (RMP) and the action potential duration (APD) in isoproterenol (Iso)-treated rats. APD50 and APD90: action potential duration at 50% and 90% of repolarization, respectively; Chlo: chloroquine. Mean±SD. n=6. **P<0.01 vs Iso; ##P<0.01 vs Iso+Zac+Chlo.

表2 Zac对异丙肾上腺素模型大鼠心室肌细胞AP形态的影响
APA: action potential amplitude; RMP: resting membrane potential; Iso: isoproterenol; Chlo: chloroquine.**P<0.01vscontrol;##P<0.01vsIso+Zac.
3 长期单纯应用Zac对ICa-L的影响
成年健康SD大鼠每日腹腔注射Zac,连续10 d,观察其对大鼠心室肌细胞ICa-L的影响。结果发现,长期应用Zac对ICa-L无明显影响。这一结果与我们前期在大鼠心室肌细胞上急性给予Zac不影响ICa-L的结果一致[8],见图3。
4 Zac对异丙肾上腺素所致乳鼠心室重构的影响
镜下可见异丙肾上腺素模型组的心肌细胞明显增大,Zac干预后细胞形态恢复至正常或接近正常水平。这一结果与Zac对在体异丙肾上腺素所致的心室重构的抑制作用相一致。
利用激光共聚焦测定胞内钙浓度的结果表明,Zac使肥厚模型组心肌细胞内升高了的Ca2+浓度显著降低,而低浓度BaCl2和氯喹作为IK1阻断剂可逆转Zac的抗重构作用,即激动IK1可通过抑制Ca2+激活的致心室重构的信号通路,产生显著的抗心室重构作用,见图4、5。

Figure 3.No effect of zacopride on ICa-L in rat cardiomyocytes was observed. Mean±SD. n=6.

Figure 4.Zacopride (Zac) inhibited isoproterenol (Iso)-induced intracellular calcium overload in cultured neonatal rat cardiomyocytes. The scale bar=50 μm.

Figure 5.The effects of zacopride (Zac) on isoproterenol (Iso)-induced remodeling and calcium overload in neonatal rat cardiomyocytes. Chlo: chloroquine. Mean±SEM. n=6. *P<0.05, **P<0.01 vs control; △P<0.05,△△P<0.01 vs Iso; #P<0.05, ##P<0.01 vs Iso+Zac.
讨 论
大规模动物实验和临床研究已经证实,β受体阻滞剂、血管紧张素转换酶抑制剂、血管紧张素Ⅱ受体阻滞剂、醛固酮拮抗剂、钙通道阻滞剂、内皮素受体拮抗剂等药物能改善心室重构,其作用机制主要涉及减轻心脏负荷、改善心肌收缩和舒张功能;抑制诱导心肌细胞肥大或间质纤维化的基因表达或体液因子释放等[9-11]。然而,由心室重构引发的心力衰竭及恶性心律失常的死亡率仍然较高[9]。
肥大心肌细胞共同的电生理异常是APD延长,APD延长可增加ICa-L通道开放时间,[Ca2+]i升高[12]。Ca2+激活的信号通路被认为在心室重构中发挥关键作用。电压门控钙通道阻断剂可通过减少胞外钙离子内流,发挥显著的抗心肌肥大效应[13]。但考虑到Ca2+对心肌细胞收缩的重要作用,阻断钙通道可能会降低心泵功能,从而限制其临床使用。寻找新的离子通道干预靶点,从而改善心室重构将是未来心血管药理学领域的重要方向。Fauconnier等[14]证实心衰大鼠心室肌细胞内Ca2+浓度升高可抑制IK1。陈依春等[15]亦发现异丙肾上腺素致心肌肥厚模型大鼠心室肌IK1明显被抑制。IK1下调亦是心衰心肌电重构的重要特征[7]。因此,我们将IK1通道作为抗心律失常干预的新靶点。本研究首次提出上调心肌细胞IK1进而增大静息膜电位,可改善心肌细胞电重构进而逆转结构重构。
在本研究中,长期给予异丙肾上腺素既导致大鼠心室结构重构,心肌细胞体积肥大,重量增加;也引起明显的电重构,表现为RMP降低,细胞膜去极化,APD明显延长,两者均可导致细胞膜上电压门控Ca2+内流增多,从而引起细胞内钙超载。[Ca2+]i增多可以进一步触发Ca2+激活的信号通路,相关蛋白合成增加,导致心室结构重构。Zac作为IK1特异性激动剂可减轻异丙肾上腺素诱发的心肌细胞钙超载并逆转心室重构;氯喹作为IK1阻断剂与Zac联合应用可以消除Zac的效应。这表明Zac的抗心室重构和减轻钙超载作用都是由其激动IK1介导的。鉴于Zac自身并不引起电压门控Ca2+电流的明显变化,我们分析Zac减轻钙超载的机制不是直接抑制ICa-L,而是通过激动IK1实现的。通过激动IK1,Zac增大RMP,缩短APD,这两者均可抑制电压门控Ca2+通道开放,Ca2+内流减少,钙超载减轻,进而抑制Ca2+激活的信号转导通路,这可能是IK1激动剂抗心室重构的主要机制。
[1] Aimond F, Alvarez JL, Rauzier JM, et al. Ionic basis of ventricular arrhythmias in remodeled rat heart during long-term myocardial infarction[J]. Cardiovasc Res, 1999, 42(2):402-415.
[2] Long VP 3rd, Bonilla IM, Vargas-Pinto P, et al. Heart failure duration progressively modulates the arrhythmia substrate through structural and electrical remodeling[J]. Life Sci, 2015,123:61-71.
[3] Mueller EE, Momen A, Massé S, et al. Electrical remodelling precedes heart failure in an endothelin-1-induced model of cardiomyopathy[J]. Cardiovasc Res, 2011, 89 (3):623-633.
[4] Sun JM, Wang CM, Guo Z, et al. Reduction of isoprote-renol-induced cardiac hypertrophy and modulation of myocardial connexin43 by a KATPchannel agonist[J]. Mol Med Rep, 2015, 11(3):1845-1850.
[5] Lee TM, Lin MS, Chang NC. Effect of ATP-sensitive potassium channel agonists on ventricular remodeling in healed rat infarcts[J]. J Am Coll Cardiol, 2008, 51(13):1309-1318.
[6] Hibino H, Inanobe A, Furutani K, et al. Inwardly recti-fying potassium channels: their structure, function, and physiological roles[J]. Physiol Rev, 2010, 90(1): 291-366.
[7] Janse MJ. Electrophysiological changes in heart failure and their relationship to arrhythmogenesis[J]. Cardiovasc Res, 2004, 61(2):208-217.
[8] Liu QH, Li XL, Xu YW, et al. A novel discovery of IK1 channel agonist: zacopride selectively enhances IK1 current and suppresses triggered arrhythmias in the rat[J]. J Cardiovasc Pharmacol, 2012, 59(1):37-48.
[9] Burchfield JS, Xie M, Hill JA. Pathological ventricular remodeling: mechanisms: part 1 of 2[J]. Circulation, 2013, 128(4):388-400.
[10]Gude D. How full is our antihypertensives pipeline?[J]. J Pharmacol Pharmacother, 2012, 3(1):7-11.
[11]崔晓琼, 曲 鹏, 姜 华, 等. 阿托伐他汀对AngⅡ诱导大鼠心肌肥大的抑制作用及对TLR4基因表达的影响[J]. 中国病理生理杂志, 2007, 23(12): 2357-2360.
[12]Molkentin J, Lu J, Antos C, et al. A calcineurin-dependent transcriptional pathway for cardiac hypertrophy[J]. Cell, 1998, 93(2):215-228.
[13]Cagalinec M, Kyselovic J, Blaskova E, et al. Comparative study of the effects of lacidipine and enalapril on the left ventricular cardiomyocyte remodeling in spontaneously hypertensive rats[J]. Cardiovasc Pharmacol, 2006, 47(4):561-570.
[14]Fauconnier J, Lacampagne A, Rauzier J, et al. Ca2+-dependent reduction of IK1 in rat ventricular cells: a novel paradigm for arrhythmia in heart failure?[J]. Cardiovasc Res, 2005, 68(2):204-212.
[15]陈依春, 李超红, 杨明珠, 等. 内向整流钾通道激动剂对异丙肾诱发心肌肥厚大鼠心律失常的抑制作用及机制研究[J]. 中国药理学通报, 2016, 32(8): 1127-1133.
(责任编辑: 林白霜, 罗 森)
Cardiac IK1agonist inhibits isoproterenol-induced ventricular remodeling in rats
YANG Ying1, GUO Yun-fei1, ZHAI Xu-wen2, ZHANG Yan1, LI Pan1, ZHANG Li3, WU Bo-wei2, LIU Qing-hua1
(1DepartmentofPhysiopathology,2DepartmentofPhysiology,ShanxiMedicalUniversity,Taiyuan030001,China;3Children’sHospitalofShanxi,Taiyuan030013,China.E-mail:liuqh20041206@163.com)
AIM: To investigate the effect of inward rectifier potassium channels (IK1) agonist zacopride on isoproterenol (Iso)-induced ventricular remodeling and the involved mechanisms.METHODS: SD rats were randomly divided into 5 groups: control, Iso model, Iso+zacopride, Iso+zacopride+chloroquine and Iso+captopril groups. The model of cardiac hypertrophy was developed by intraperitoneal injection of Iso (3 mg·kg-1·d-1for 10 d) and verified by determination of heart-to-body weight ratio and left ventricle-to-body weight ratio. The changes of voltage-gated calcium current (ICa-L), resting membrane potential (RMP) and action potential duration (APD) of the rat ventricular myocytes were detected by the technique of whole-cell patch clamp. Neonatal rat cardiomyocytes were isolated by 0.08% trypsin and 0.04% type II collagenase, and purified using differential adherence method and 5-bromodeoxyuridine. Cultured neonatal rat cardiomyocytes were randomly divided into 5 groups: control, Iso, Iso+zacopride, Iso+zacopride+BaCl2and Iso+zacopride+chloroquine groups. After harvested for 24 h, the [Ca2 +]iof the cardiomyocytes was recorded using a laser confocal scanning microscope.RESULTS: Compared with control group, the whole heart hypertrophic index and left ventricular hypertrophic index in Iso group were increased significantly (P<0.01). Patch clamp data suggested that RMP was reduced, and APD was obviously prolonged. Zacopride treatment obviously inhibited myocardial hypertrophy, increased the RMP and shortened APD (P<0.01). At the same time, application of low dose of IK1atagonist chloroquine reversed the effect of zacopride. In cultured neonatal rat cardiomyocytes, Iso increased the cell area and [Ca2 +]i. Zacopride treatment restored the hypertrophic morphology of the cells to normal or nearly normal levels, and significantly attenuated calcium overload. IK1blocker, BaCl2or chloroquine, reversed the effect of zacopride.CONCLUSION: IK1agonist zacopride significantly inhibits left ventricular remodeling caused by isoproterenol. Via enhancing IK1, thereafter increasing RMP and shor-tening APD, zacopride might decrease Ca2+influx and inhibit intracellular calcium overload-dependent signaling pathway.
Inward rectifier potassium channels; Isoproterenol; Calcium overload; Ventricular remodeling; Zacopride
1000- 4718(2017)03- 0399- 06
2016- 10- 12
2016- 11- 24
国家自然科学基金资助项目(No. 31200864);山西省回国留学人员科研资助项目(No. 2016-059)
△通讯作者 Tel: 13753119195; E-mail: liuqh20041206@163.com
R541.7; R363.2
A
10.3969/j.issn.1000- 4718.2017.03.003
