转化生长因子-β1预处理调控缺氧诱导因子-1α蛋白表达水平对心肌细胞缺氧/复氧损伤的影响
2017-04-11马晓媛马海平伊利亚尔买买提力
马晓媛,俞 瑾,马海平,伊利亚尔·买买提力,郑 宏,王 江
·基础研究·
转化生长因子-β1预处理调控缺氧诱导因子-1α蛋白表达水平对心肌细胞缺氧/复氧损伤的影响
马晓媛,俞 瑾,马海平,伊利亚尔·买买提力,郑 宏,王 江
目的 探讨转化生长因子-β1(TGF-β1)预处理调控缺氧诱导因子-1α(HIF-1α)的蛋白表达水平是否可以影响心肌细胞缺氧/复氧损伤。方法 建立心肌细胞株H9C2缺氧/复氧损伤模型及缺氧预处理模型,将H9C2心肌细胞随机分为5组:正常对照组(Control组)、缺氧复氧组(H/R组)、缺氧预处理组(HPC组),TGF-β1预处理组(TGF-β1-Pre组)、TGF-β1抑制剂组(SB431542组),各组复氧结束后测定培养液乳酸脱氢酶(LDH)活性、HIF-1α蛋白表达水平、心肌细胞凋亡率。结果Control组、H/R组、HPC组、TGF-β1-Pre组、SB431542组的LDH活性(U/L)分别为(201.2±48.9)、(936.6±93.7)、(727.0± 75.9)、(747.3±63.1)、(957.3±55.3);心肌细胞凋亡率(%)分别为(25.5±3.2)、(71.8±5.5)、(42.8±6.1)、(54.1±4.1)、(82.8 ±9.7),与H/R组比较,HPC组、TGF-β1-Pre组的LDH活性、心肌细胞凋亡率显著降低(P<0.05),HIF-1α蛋白表达水平升高(P<0.05);与HPC组比较,TGF-β1-Pre组各项指标差异均无统计学意义(P>0.05)。结论 不论在常氧条件还是在缺氧环境下,TGF-β1均可以增加HIF-1α的蛋白表达水平,并且在缺氧复氧诱导所致的心肌细胞损伤中发挥抗凋亡作用,这种作用与调控HIF-1α的蛋白水平有关。
转化生长因子-β1;缺氧/复氧损伤;缺氧诱导因子-1α;预处理
围术期心肌缺血/再灌注损伤发生率较高[1],并且预后不佳,占术后院内患者死亡原因的17%~27%[2]。由Murry提出的缺血预处理是心肌保护中最为有效的内源性保护措施[3],其中缺氧诱导因子-1(Hypoxia inducible factor-1,HIF-1)在缺血的适应性反应中起核心作用[4]。因此,促使HIF-1的氧调节蛋白HIF-1α(Hypoxia inducible factor-1α,HIF-1α)的稳定表达,可能成为围术期对抗心肌缺血/再灌注损伤的有效策略[5]。但由于缺血预处理或者缺氧预处理在临床实施方面的局限性,有研究使用药物干预发挥心肌保护作用[6]。有研究结果显示,许多生长因子可调节HIF-1α的稳定性,其中转化生长因子-β1(Transforming growth factor-β1,TGF-β1)作为一种分泌型多肽类生长因子,在牙周膜细胞及肿瘤细胞中可增强HIF-1α的稳定性[7-8]。因此,本研究以TGF-β1稳定HIF-1α的蛋白水平为切入点,探讨TGF-β1预处理对心肌细胞缺氧/复氧(hypoxia/reoxgenation,H/R)损伤的影响。
1 材料和方法
1.1 材料 胚胎大鼠心脏来源的细胞系H9C2心肌细胞购自于中国科学院上海生命科学研究院; HIF-1α抗体、驴抗兔辣根过氧化物酶标记的IgG二抗、重组人TGF-β1、SB431542、ECL显色试剂盒均购自Thermo公司;GAPDH抗体购自博士德生物工程有限公司;乳酸脱氢酶(LDH)测试盒购自南京建成生物工程研究所;Tunel试剂盒购自Roche公司。
1.2 H9C2心肌细胞的培养 将冻存复苏后的H9C2心肌细胞用含10%胎牛血清的DMEM高糖培养液,在37℃恒温培养箱(5%CO2、95%空气)培养。1~2天换液一次,实验时取对数生长期细胞进行干预,干预前用无血清M199培养液饥饿细胞12 h同步化。
1.3 实验分组
1.3.1 不同干预条件下的分组 ①不同浓度的TGF-β1干预:根据参考文献的干预时间[7],将心肌细胞随机分为4组(n=6)。分别给予不同浓度0μg/L、1μg/L、5μg/L、10μg/L的TGF-β1进行干预8 h;②不同时间的TGF-β1干预:将心肌细胞随机分为6组(n=6)。给予5μg/L的TGF-β1分别干预2 h、4 h、8 h、10 h、16 h、24 h;③TGF-β1在常氧或缺氧条件下干预:将心肌细胞随机分为4组(n =6)。空白对照组:正常培养细胞不做任何干预; TGF-β1干预组:给予5μg/L的TGF-β1培养10 h;单纯缺氧组:在95%N2+5%CO2的混合气体的培养箱中缺氧培养10 h;TGF-β1干预组+缺氧:给予5μg/L的TGF-β1后放入95%N2+5%CO2混合气体的培养箱中缺氧培养10 h。
1.3.1 总实验分组 将心肌细胞随机分为5组(n= 6)。①正常对照组(Control组);②H/R组:根据参考文献造模[9],缺氧培养4 h,复氧培养2 h,构建H9C2心肌细胞H/R损伤模型;③缺氧预处理组(HPC组):根据参考文献造模[10],缺氧培养 10 min,复氧培养30 min,重复3次后,在此基础上构建H9C2心肌细胞H/R损伤模型;④TGF-β1预处理组(TGF-β1-Pre组):给予5μg/L的TGF-β1干预10 h,在此基础上构建H9C2心肌细胞H/R损伤模型;⑤TGF-β1抑制剂干预组(SB431542组):给予10μM SB431542干预30 min后,给予5μg/L的TGF-β1干预10 h,在此基础上构建H9C2心肌细胞H/R损伤模型。
1.4 检测指标
1.4.1 Western blot检测HIF-1α蛋白表达水平各组细胞干预结束后,裂解并提取各组细胞中总蛋白,测定细胞中总蛋白浓度。取30μg总蛋白于8%SDS-PAGE凝胶电泳,电泳结束后转至PVDF膜,封闭2 h后,分别孵育HIF-1α单抗及内参GADPH一抗于4℃过夜,洗去一抗,用二抗孵育2 h,PVDF膜用ECL化学发光法显影,并放入凝胶扫描系统曝光拍照。运用Image Lab软件计算分析各目的蛋白条带和内参蛋白条带的灰度比值表示蛋白相对表达量。
1.4.2 LDH活性的测定 严格按照试剂盒说明书进行操作,各组干预结束后测定心肌细胞培养液中的LDH活性。
1.4.3 Tunel法测量各组细胞凋亡率 根据凋亡试剂盒检测各组细胞凋亡率,用Image Pro Plus软件分析图像。
1.5 统计学方法 使用SPSS 13.0进行统计学分析,实验数据采用均数±标准差(±s)表示,多个样本比较在方差齐性检验的基础上作单因素方差分析(ANOVA),两两比较采用Tukey's多重比较,以P<0.05认为有统计学意义。
2 结果
2.1 不同浓度的TGF-β1对HIF-1α蛋白表达的影响 1μg/L组、5μg/L组、10μg/L组与Control组相比,HIF-1α的蛋白表达均显著升高(P<0.05);5 μg/L组、10μg/L组与1μg/L组相比,HIF-1α的蛋白表达均显著升高(P<0.05);5μg/L组与10 μg/L组比,HIF-1α的蛋白表达未见明显差异(P>0.05),见图1。

图1 不同浓度的TGF-β1对HIF-1α蛋白表达的影响(n=6)
2.2 5μg/L TGF-β1影响HIF-1α蛋白表达的时间依赖性 与10 h相比,其他时间点HIF-1α的蛋白表达均降低(P<0.05),但TGF-β1在干预第10 h时,HIF-1α蛋白表达最高,见图2。
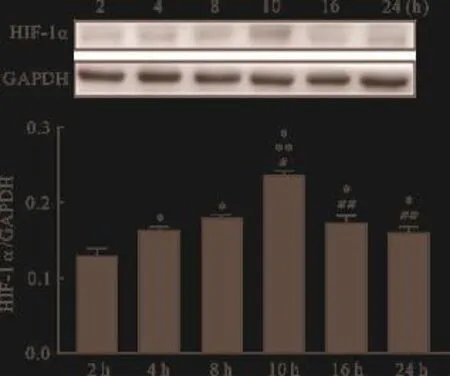
图2 5μg/L TGF-β1影响HIF-1α蛋白表达的时间依赖性(n=6)
2.3 TGF-β1在常氧或缺氧条件下对HIF-1α蛋白表达影响的比较 在常氧条件下,TGF-β1干预与空白对照组相比,HIF-1α的蛋白表达增加(P<0.05);在缺氧条件下,TGF-β1干预较未给予干预组HIF-1α的蛋白表达增加(P<0.05),见图3。
2.4 各实验分组对HIF-1α蛋白表达的影响 与Control组相比,H/R组、HPC组、TGF-β1-Pre组、SB431542组HIF-1α蛋白表达上调(P<0.05);与H/R组相比,HPC组、TGF-β1-Pre组HIF-1α蛋白表达上调(P<0.05),但SB431542组差异无统计学意义(P>0.05);与HPC组相比,TGF-β1-Pre组、SB431542组差异均无统计学意义(P>0.05),见图4。
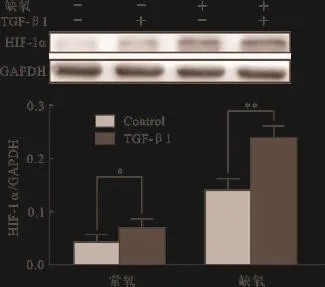
图3 TGF-β1干预在常氧或缺氧条件下对HIF-1α蛋白表达影响的比较(n=6)
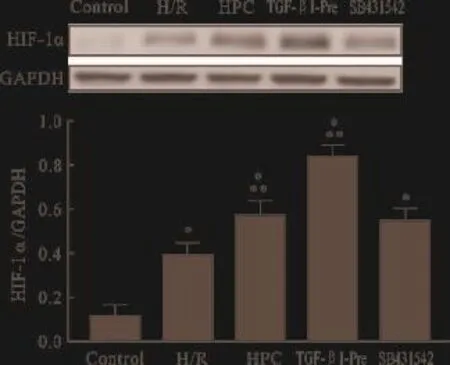
图4 各实验分组对HIF-1α蛋白表达水平的影响(n=6)
2.5 各实验组培养液LDH活性 与Control组相比,H/R组、HPC组、TGF-β1-Pre组、SB431542组培养液LDH活性升高(P<0.05);与H/R组相比,HPC组、TGF-β1-Pre组培养液的LDH活性降低(P<0.05),SB431542组差异无统计学意义(P>0.05); HPC组与TGF-β1-Pre组、SB431542组差异均无统计学意义(P>0.05),见图5。

图5 各组间细胞培养液LDH活性的比较(n=6)
2.6 TUNEL法荧光标记的细胞凋亡率 与Control组相比,H/R组、HPC组、TGF-β1-Pre组、SB431542组细胞凋亡率均增加,差异均有统计学意义(P<0.05);与H/R组相比,HPC组、TGF-β1-Pre组细胞凋亡率降低(P<0.05),但SB431542组差异无统计学意义(P>0.05);与HPC组相比,TGF-β1-Pre组差异无统计学意义(P>0.05),见图6,图7。

图6 各组间细胞凋亡率(%)的比较(n=6)
3 讨论
在缺氧预处理过程中,HIF-1α的表达量明显增加,并且HIF-1α在其心肌保护效应中发挥着中心作用[11]。许多研究表明,除了依赖氧浓度调节外,一些非缺氧因素同样会增加HIF-1α蛋白水平的表达。常氧条件下,在不同的细胞系如人肝癌细胞、纤维肉瘤细胞,给予TGF-β1刺激后,HIF-1α的蛋白表达水平增高,其机制与TGF-β1降低脯氨酸羟化酶的表达水平从而增加HIF-1α的稳定性有关[7]。因此,本研究以TGF-β1稳定HIF-1α的蛋白表达为切入点,观察TGF-β1干预在心肌细胞H/ R诱导的心肌损伤中的作用。研究发现TGF-β1预处理与缺氧预处理组相比同样可以增加HIF-1α的蛋白水平,并且与H/R组相比培养液LDH活性及细胞凋亡率明显降低,说明TGF-β1预处理在心肌细胞H/R诱导的心肌损伤中发挥抗凋亡作用。
HIF-1是缺血或缺氧损伤后内源性保护机制的始动因子,是诱导心肌保护分子机制的关键因素,其调控的靶基因有130余种,这些靶基因可参与血管新生、细胞分化/生存、红细胞合成、调节糖代谢、氧转运等机体对缺血缺氧的适应性反应[12]。HIF-1α是HIF-1的氧调节蛋白,在常氧状态下HIF-1α的半衰期非常短,只有5 min,很快被降解[13]。但在缺氧条件下,通过抑制脯氨酸羟化酶的活性阻断泛素蛋白酶体途径而使HIF-1α稳定表达,与HIF-1的基础表达蛋白HIF-1β结合,最终调控相关靶基因,使细胞及组织适应缺氧的环境[14]。

图7 荧光显微镜下观察细胞凋亡率(×40)(n=6)
为探索在H9C2心肌细胞中,如何给予TGF-β1干预可以达到最佳的干预效果,笔者使用了不同的干预浓度及干预时间,虽然10μg/L增加HIF-1α蛋白水平较5μg/L高,但无统计学差异。使用不同时间点干预发现在10 h时,HIF-1α蛋白水平最高。因此可认为使用5μg/L的干预剂量,10 h的持续干预时间可达到最佳干预条件。
在缺氧条件下,HIF-1α降解受阻可以稳定表达。缺氧时给予TGF-β1刺激,TGF-β1增加HIF-1α的表达是否会被缺氧掩盖?本研究在缺氧条件下同时给予TGF-β1干预,发现在低氧环境下,当TGF-β1刺激心肌细胞时,在增加HIF-1α的蛋白稳定性方面可产生叠加效应。笔者推断,其原因可能与脯氨酸羟化酶的活性有关,机制尚待进一步研究。
TGF-β1作为TGF-β超家族成员之一,是一种多功能的生长因子,它在免疫调节、胚胎的发生发展、肿瘤的形成与发展、炎症反应、创伤愈合等方面具有重要的作用[15]。尽管TGF-β1在许多细胞中具有促凋亡作用,但被证实TGF-β1在心脏再灌注损伤方面可发挥心肌保护作用[16],在体内和体外都可以产生抗损伤作用[17]。TGF-β1产生细胞信号内转导发挥作用不仅通过经典信号通路即Smad信号通路,也包括非典型信号通路ERK1/2及PI3KAKT的激活[18-19]。笔者发现,TGF-β1减少心肌细胞H/R损伤的凋亡,这个作用可以被抑制I型受体活化素受体样激酶ALK5的抑制剂SB431542所减弱,ALK5具有识别Smad2和Smad3,并且诱导其增多并磷酸化的作用。因此TGF-β1预处理在H/R诱导的心肌细胞损伤中发挥抗凋亡可能通过Smad信号通路发挥作用。与研究报道的TGF-β1依赖的Smad信号通路的激活与TGF-β1介导的抗H/R损伤诱导的凋亡保护作用相一致[20]。
总的来说,本研究结果表明,不论在常氧条件还是在缺氧环境下,TGF-β1均可以增加HIF-1α的蛋白表达水平,并且可以在H/R诱导的心肌细胞损伤中发挥抗凋亡作用,这种作用与调控HIF-1α的蛋白水平有关。这为围术期心肌缺血再灌注损伤的治疗提供了新的研究思路。
[1] Botto F,Alonso-Coello P,Chan MT,et al.Myocardial injury after noncardiac surgery:a large,international,prospective cohort study establishing diagnostic criteria,characteristics,predictors,and 30-day outcomes[J].Anesthesiology,2014,120(3):564-578.
[2] Wright DE,Hunt DP.Perioperative surveillance for adversemyocardial events[J].South Med J,2008,101(1):52-58.
[3] Murry CE,Jennings RB,Reimer KA.Preconditioningwith ischemia:a delay of lethal cell injury in ischemicmyocardium[J].Circulation,1986,74(5):1124-1136.
[4] Ke Q,Costa M.Hypoxia-inducible factor-1(HIF-1)[J].Mol Pharmacol,2006,70(5):1469-1480.
[5] Sen Banerjee S,Thirunavukkarasu M,Tipu RishiM,et al.HIF-prolyl hydroxylases and cardiovascular diseases[J].Toxicol Mech Methods,2012,22(5):347-358.
[6] 卢向航,冉珂,徐军美,等.延迟相吗啡预处理对兔心肌缺血再灌注损伤的保护作用[J].中国体外循环杂志,2008,6 (3):180-182.
[7] Mcmahon S,Charbonneau M,Grandmont S,et al.Transforming growth factor beta1 induces hypoxia-inducible factor-1 stabilization through selective inhibition of PHD2 expression[J].JBiol Chem,2006,281(34):24171-24181.
[8] Watanabe T,Yasue A,Tanaka E.Inhibition of transforming growth factorβ1/Smad3 signaling decreases hypoxia-inducible factor-1αprotein stability by inducing prolyl hydroxylase 2 expression in human periodontal ligament cells[J].JPeriodontol,2013,84(9):1346-1352.
[9] Liu L,Wang P,Liu X,etal.Exogenous NAD(+)supplementation protects H9C2 cardiac myoblasts against hypoxia/reoxygenation injury via Sirt1-p53 pathway[J].Fundam Clin Pharmacol,2014,28(2):180-189.
[10] Pan YX,Ren AJ,Zheng J,etal.Delayed cytoprotection induced by hypoxic preconditioning in cultured neonatal rat cardiomyocytes:role of GRP78[J].Life Sci,2007,81(13):1042-1049.
[11] Eckle T,Kohler D,Lehmann R,etal.Hypoxia-inducible factor-1 is central to cardioprotection:a new paradigm for ischemic preconditioning[J].Circulation,2008,118(2):166-175.
[12] Semenza GL,Shimoda LA,Prabhakar NR.Regulation of gene expression by HIF-1[J].Novartis Found Symp,2006,272 (10):2-8.
[13] Loboda A,Jozkowicz A,Dulak J.HIF-1 and HIF-2 transcription factors similar but not identical[J].Mol Cells,2010,29 (5):435-442.
[14] Semenza GL.Oxygen sensing,hypoxia-inducible factors,and disease pathophysiology[J].Annu Rev Pathol,2014,9(1):47-71.
[15] Tirado-Rodriguez B,Ortega E,Segura-Medina P,et al.TGF-β:an importantmediator of allergic disease and a molecule with dual activity in cancer development[J].J Immunol Res,2014,2014(5):318481.
[16] Dandapat A,Hu CP,Li D,et al.Overexpression of TGFbeta l by adeno-associated virus type-2 vector protectsmyocardium fromischemia-reperfusion injury[J].Gene therapy,2008,15(6): 415-423.
[17] Frantz S,Hu K,Adamek A,et al.Transforming growth factor beta inhibition increasesmortality and leftventricular dilatation aftermyocardial infarction[J].Basic Res Cardiol,2008,103(5): 485-492.
[18] Al-Azayzih A,Gao F,Goc A,et al.TGFβ1 induces apoptosis in invasive prostate cancer and bladder cancer cells via AKT-independent,p38 MAPK and JNK/SAPK-mediated activation of caspases[J].Biochem Biophys Res Commun,2012,427(1): 165-170.
[19] Wang F,Chen L,NiH,et al.APRIL depletion induces cell cycle arrestand apoptosis through blocking TGF-βl/ERK signaling pathway in human colorectal cancer cells[J].Mol Cell Biochem,2013,383(1-2):179-189.
[20] Vivar R,Humeres C,Ayala P,et al.TGF-β1 prevents simulated ischemia/reperfusion-induced cardiac fibroblast apoptosis by activation of both canonical and non-canonical signaling pathways[J].Biochim Biophys Acta,2013,1832(6):754-762.
Effects of hypoxia inducible factor-1 alphamediated by transform ing grow th factor beta 1 pre-conditioning on hypoxia/reoxgenation injury of cardiomyocytes
Ma Xiao-yuan,Yu Jin,Ma Hai-ping,Ilyar Mamtili,Zheng Hong,Wang Jiang
Department of Anesthesiology,The First Affiliated Hospital of Xinjiang Medical University,xinjiang Urumqi 830054,China
Wang Jiang,Email:710985359@qq.com
Objective To investigate whether the HIF-1αprotein level regulated by TGF-β1 preconditioning can affect the cardiomyocytes hypoxia/reoxgenation-induced injury of cardiomyocytes.M ethods H9C2 cardiomyocyteswere used to establish hypoxia/reoxgenation-induced injurymodel.Cardiomyocyteswere randomly divided into five groups:controlgroup(Control),hypoxia/reoxgenation group(H/R),hypoxic preconditioning group(HPC),TGF-β1 preconditioning group(TGF-β1-Pre),TGF-β1 inhibitor group(SB431542).Lactic dehydrogenase(LDH)activity,HIF-1αprotein content and cardiomyocytes apoptosis rate weremeasured at the end of the reperfusion.Results The LDH activity of Control group,H/R group,HPC group,TGF-β1-Pre group,SB431542 group were(201.2±48.9)U/L,(936.6±93.7)U/L,(727.0±75.9)U/L,(747.3±63.1)U/L,(957.3±55.3)U/L,respectively.The cell apoptosis rate of Control group,H/R group,HPC group,TGF-β1-Pre group,SB431542 group were(25.5±3.2)%,(71.8 ±5.5)%,(42.8±6.1)%,(54.1±4.1)%,(82.8±9.7)%,respectively.The LDH activity and cell apoptosis rate in HPC group and TGF-β1-Pre group were both decreased compared with that in H/R group,meanwhile accompanied by increased HIF-1αprotein content(P<0.05).There was no significantly difference between HPC group and TGF-β1-Pre group.Conclusion TGF-β1 could increase the expression levelof HIF-1αprotein nomatter in normoxia or hypoxia circumstance,TGF-β1 exertantiapoptotic effect in hypoxia/reoxgenation-induced injury of cardiomyocytes,which is associated with themodulation of HIF-1α.
Transforming growth factor-β1;Hypoxia/reoxgenation injury;Hypoxia inducible factor-1α;Pre-conditioning
2016-10-09)
2016-10-28)
10.13498/j.cnki.chin.j.ecc.2017.01.13
新疆维吾尔自治区自然科学基金面上项目(2014211C038)
830054乌鲁木齐,新疆医科大学第一附属医院麻醉科
王江,Email:710985359@qq.com
