PKCε信号通路介导甘青铁线莲活性成分APG抗心肌缺血再灌注损伤的机制研究
2017-04-11冯颖达冯建宇狄守印陆云阳汤海峰朱艳荣
冯颖达,冯建宇,杨 阳,狄守印,张 伟,陆云阳,汤海峰,朱艳荣
·基础研究·
PKCε信号通路介导甘青铁线莲活性成分APG抗心肌缺血再灌注损伤的机制研究
冯颖达,冯建宇,杨 阳,狄守印,张 伟,陆云阳,汤海峰,朱艳荣
目的 研究不同浓度甘青铁线莲活性成分APG对H9C2大鼠心肌细胞缺血再灌注损伤的保护作用及其可能的机制。方法 体外培养H9C2大鼠心肌细胞,经2μM/L和4μM/L的APG预处理24 h后,建立缺氧复氧损伤模型(I/R)(缺氧45 min,复氧3 h)。采用CCK-8法检测细胞活力,检测细胞培养液乳酸脱氢酶(LDH)的释放量、丙二醛(MDA)的释放量和细胞内超氧化物歧化酶(SOD)的活力;采用Western Blot法检测细胞内蛋白激酶Cε(PKCε)、Caspase-3、Bax和Bcl-2表达情况,使用特异性PKCε抑制剂CHE观察PKCε信号通路在此过程中的作用。结果 I/R处理可抑制H9C2细胞活性,细胞培养基中LDH、MDA含量升高,SOD活力降低(与Control组比较,P<0.05)。抑制PKCε表达,上调Caspase-3表达,下调Bcl-2/ Bax比例(与Control组比较,P<0.05)。2μM/L和4μM/L的APG预处理均可发挥细胞保护作用,降低LDH与MDA释放量,提高SOD活力(与I/R组比较,P<0.05)。此外,APG处理对抗了I/R损伤引起的PKCε表达下调,抑制Caspase-3表达,提高了Bcl-2/Bax比例(与I/R组比较,P<0.05)。CHE处理后细胞活力下降,Caspase-3表达上调,Bcl-2/Bax比例下降,凋亡增加(与APG+I/R组比较,P<0.05)。结论 甘青铁线莲中活性成分APG可减轻心肌缺血再灌注损伤,其机制可能是激活PKCε相关信号通路,最终抑制心肌细胞凋亡。
甘青铁线莲;心肌缺血再灌注损伤;蛋白激酶Cε;细胞凋亡
缺血性心脏病是威胁人类健康的一项重大疾病,心肌缺血再灌注(ischemia/reperfusion,I/R)损伤是重要的损伤类型,其病理机制复杂,有很多信号通路和细胞因子参与其中[1-4]。心肌I/R损伤是指缺血期处于可逆损伤的心肌细胞,恢复血液供应后产生不可逆转的损伤[5]。甘青铁线莲为藏药材,其性辛、甘、温,祛寒,增生胃火,活血通淤,破癖瘤积聚[6],且其作为复方制剂益心康泰胶囊的主药在临床应用中疗效显著。本课题组前期从甘青铁线莲中分离并鉴定出一种主要活性成分:芹菜素-7-O-β-D-(-6'-p-香豆酰基)-吡喃葡萄糖(简称APG),经过药理活性筛选,发现APG可减轻脑I/R损伤,且未见毒副作用(相关结果已申请国家发明专利,专利号:ZL201210425548.1)[7],而APG是否能发挥抗凋亡作用从而减轻心肌I/R损伤及其具体作用机制尚未见报道。本实验采用体外培养H9C2大鼠心肌细胞模拟I/R损伤,探讨APG对心肌I/R损伤的保护作用及作用机制。
1 材料和方法
1.1 细胞株 大鼠H9C2心肌细胞,购自中国科学院上海细胞库。
1.2 药物与试剂 APG单体由本课题组分离所得。乳酸钠、4-羟乙基哌嗪乙磺酸、氯化钠、氯化钾、氯化钙、脱氧葡萄糖、连二亚硫酸钠(Sigma公司),胎牛血清(FBS)(Gibco公司),高糖DMEM培养基、胰蛋白酶(Hyclone公司),CCK-8试剂盒购(七海复泰公司),乳酸脱氢酶(LDH)检测试剂盒、丙二醛(MDA)检测试剂盒和超氧化物歧化酶(SOD)(南京建成生物工程研究所)。兔抗蛋白激酶Cε(PKCε)、兔抗Caspase-3、兔抗Bax抗体,兔抗Bcl-2(CST公司),鼠抗β-actin抗体(Santa Cruz公司)。辣根过氧化物酶(HRP)标记的羊抗兔、羊抗鼠(北京中杉金桥生物技术公司)。抗体公司说明该来源抗体可很好识别此种蛋白。
1.3 仪器 CO2细胞培养箱(Thermo公司),超净工作台(苏州富泰洁净系统有限公司),恒温水浴锅(常州国华电器有限公司),倒置显微镜(Olympus公司),台式低速离心机(Sigma公司),细胞培养瓶(Corning公司),96孔细胞培养板(Costar公司),酶标仪(Thermo公司),Western Blot电泳、转膜及发光成像仪(Bio-Rad公司)。
1.4 大鼠H9C2心肌细胞的培养 在CO2培养箱中(37℃,5%CO2),以含10%胎牛血清的高糖DMEM培养液培养。待细胞融合度达90%进行传代,每隔两天换液,取对数生长期细胞接种于培养瓶或培养板进行后续实验。
1.5 心肌细胞I/R模型的建立 I/R损伤通过缺血液模拟缺血环境,缺血液组成为MgCl21mM/L、KCl 16 mM/L、NaCl 134 mM/L、CaCl2·H2O 0.9 mM/L、NaS2O31.2 mM/L、HEPES 2 mM/L、脱氧葡萄糖5 mM/L、乳酸钠10 mM/L。加入缺血液的细胞培养板或培养瓶置于持续通气密闭容器(95%N2,5%CO2)中缺氧45 min,更换正常DMEM后在培养箱(95%O2,5%CO2)中复氧孵育3 h。
1.6 心肌细胞存活率检测 将大鼠H9C2心肌细胞制成9×104/ml的细胞悬液接种于96孔板,在CO2培养箱中(37℃,5%CO2)孵育24 h,吸弃原培养液,用不同浓度(1μM/L、2μM/L、4μM/L、8μM/ L、16μM/L、32μM/L)APG处理24 h,每组设10个复孔。结束后每孔加入10μl CCK-8试液,于CO2培养箱(37℃,5%CO2)中孵育2 h,酶标仪450 nm波长下检测光密度OD值。
1.7 实验分组 首先实验分为4组,分别为正常对照组(Control)、I/R组、APG预处理组(I/R损伤前分别加入终浓度为2μM/L、4μM/L APG预处理24 h),观察APG对I/R损伤后心肌细胞的保护作用;随后在I/R处理前加入PKCε阻断剂CHE阻断PKCε预处理2 h,浓度为5μM/L(已证实在该浓度对细胞无明显毒性作用),分为I/R组、APG+I/R组、APG+CHE+I/R组、CHE+I/R组,观察PKCε信号通路在心肌细胞保护效应中的作用。
1.8 CCK-8法检测各组心肌细胞活力 将大鼠H9C2心肌细胞制成9×104/ml的细胞悬液接种于96孔板,在CO2培养箱中(37℃,5%CO2)孵育24 h。实验各组处理结束后每孔加入10μl CCK-8试液,于CO2培养箱(37℃,5%CO2)中孵育2 h,酶标仪450 nm波长下检测光密度OD值,每组设10个复孔。
1.9 生化指标检测 各组处理结束后取细胞培养液和提取细胞蛋白分别按照检测试剂盒说明书,检测LDH、MDA含量及SOD活力,各重复5次。
2.0 Western Blot法检测PKCε蛋白及凋亡指标变化 各组处理后的细胞置于冰上(每组4个样本),用PBS洗一遍,收集细胞,加细胞裂解液裂解 20 min(4℃条件下)后,离心20 min(12 000 r/min,4℃),收集细胞裂解产物,BCA蛋白定量后根据蛋白浓度加入相应量的5×loading buffer,煮沸8 min。以每孔30μg蛋白上样进行电泳(SDS-PAGE)并用转膜仪将蛋白转到聚偏二氟乙烯膜(PVDF膜),根据所需蛋白分子量切膜,条带用含5%脱脂奶粉的TBST封闭2 h。分别孵育PKCε(1∶800)、Caspase-3(1∶1 000)、Bax(1∶1 000)和Bcl-2(1∶1 000),4℃过夜。用TBST洗涤5遍,每遍6 min,常温下用辣根过氧化物酶标记的二抗(1∶5 000)孵育2 h。用TBST洗涤5遍,每遍6 min,配制发光液,用Bio-Rad发光成像,用Image Lab软件进行分析。
2.1 统计学分析 实验数据结果均以±标准差(珋x± s)表示,采用GraphPad Prism 5.0软件进行统计分析,组间数据比较采用方差分析(ANOVA),若总体差异显著,再以t检验分析相应两组间的显著性差别。P<0.05表示有显著性差异。
2 结果
2.1 不同浓度APG对心肌细胞增殖的影响 如图1所示,当药物浓度达到4μM/L时,细胞成活率最高,但随着药物浓度升高,细胞成活率逐渐降低,故后续实验设定APG高低浓度分别为4μM/L和2μM/L。
2.2 APG预处理对I/R损伤后各组心肌细胞活力的影响 如图2和图3所示,实验1中I/R处理显著降低了H 9C2细胞活力(与Control组比较,P<0.05)。APG预处理24 h显著提高了细胞活力(与I/R组比较,P<0.05),其中4μM/L的APG保护效果更明显(与APG 2μM/L+I/R组比较,P<0.05)。在倒置显微镜下观察,I/R损伤后H9C2细胞形态变圆皱缩,体积缩小,可见大量死细胞。APG预处理的细胞死亡减少,细胞形态显著改善。
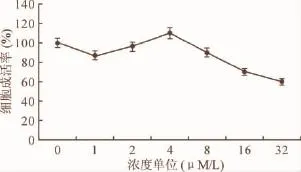
图1 不同浓度APG对心肌细胞增殖的影响

图2 APG对I/R损伤后H9C2细胞活力的影响
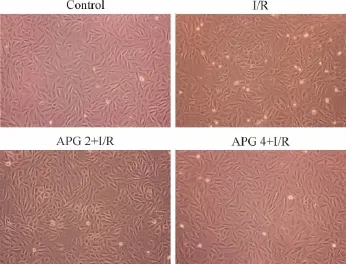
图3 APG对I/R损伤后H9C2心肌细胞形态的影响(倒置显微镜,200倍)
2.3 APG预处理对I/R损伤后H9C2心肌细胞的影响 如图4所示,实验1中I/R损伤后的H9C2细胞乳酸脱氢酶(lactate dehydrogenase,LDH)和丙二醛(malondialdehyde,MDA)释放量明显升高,超氧化物歧化酶(superoxide dismutase,SOD)活力显著降低(P<0.05)。APG预处理24 h后,剂量依赖性降低LDH和MDA的释放,提高和SOD活力(P<0.05)。

图4 APG对I/R损伤后各组心肌细胞LDH、MDA含量和SOD活力变化
2.4 APG预处理对I/R损伤后PKCε及凋亡相关蛋白表达的影响 实验1Western Blot结果显示(见图5),与Control组相比,I/R处理降低PKCε表达水平(P<0.05),明显上调Caspase-3表达水平(P<0.05)、下调了抗凋亡蛋白Bcl-2表达,上调凋亡蛋白Bax表达(P<0.05);与I/R组相比,2μM/L和4 μM/L的APG处理对抗了I/R损伤引起PKCε表达下调(P<0.05),降低了Caspase-3表达(P<0.05),上调了抗凋亡蛋白Bcl-2表达,下调凋亡蛋白Bax表达(P<0.05)。且4μM/L APG保护效果更为明显(P<0.05)。
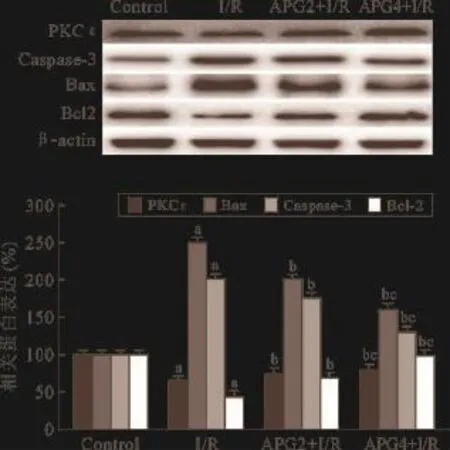
图5 APG对I/R损伤后H9C2细胞PKCε、Bax、Bcl-2和Caspase-3蛋白表达影响
2.5 APG和CHE共处理对I/R损伤后各组心肌细胞活力的影响 前期结果显示4μM/L的APG具有较好的保护效果。如图6所示,实验2中给予PKC抑制剂CHE后检测细胞活力发现,与APG+ I/R相比,APG+CHE+I/R组细胞活力显著降低(P<0.05)。与I/R组相比,CHE+I/R对细胞活力没有影响(P>0.05)。
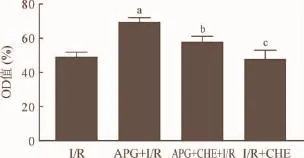
图6 APG和CHE共处理对I/R损伤后H9C2细胞活力的影响
2.6 APG和CHE共处理对I/R损伤后PKCε及凋亡相关蛋白表达的影响 实验2 Western Blot结果显示(见图7),与I/R组相比,APG+I/R处理剂量依赖性对抗了I/R损伤引起的PKCε表达下调(P<0.05),导致了Caspase-3表达下降(P<0.05),抗凋亡蛋白Bcl-2表达增加,凋亡蛋白Bax表达下降(P<0.05);与APG+I/R组相比,APG+CHE+ I/R组PKCε表达显著降低(P<0.05),Caspase-3表达增加(P<0.05),抗凋亡蛋白Bcl-2表达下降,凋亡蛋白Bax表达增加(P<0.05)。与I/R组相比,CHE+I/R组蛋白表达未显著变化(P>0.05)。
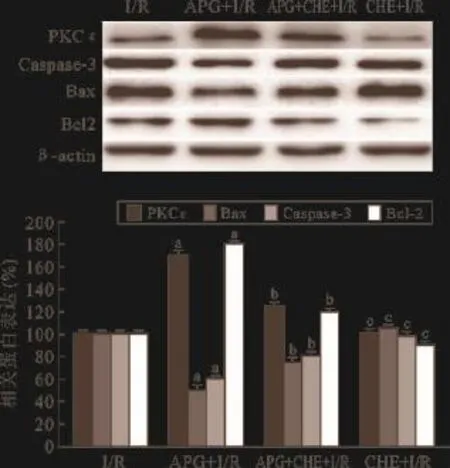
图7 APG和CHE共处理对I/R损伤后H9C2细胞PKCε、Bax、Bcl-2和Caspase-3蛋白表达影响
3 讨论
甘青铁线莲作为复方制剂益心康泰胶囊的主药,具有养阴补血、化瘀通脉、清腑降浊的功效,而且该藏药组方治疗心肌缺血再灌注损伤原理与中医治疗思想一致。APG为芹菜素与对香豆酸经葡萄糖苷相连的结构,其中芹菜素具有抗氧化、抗凋亡、抗炎及扩张血管调节血脂的作用[8-9]。Delazar等采用1,1-二苯基-2-三硝基苯肼(DPPH)分析其抗氧化活性,结果表明APG具有优良的抗氧化效果,抗氧化值几乎与槲皮素相当[10]。本实验在H9C2心肌细胞缺血再灌注模型上探讨了APG的心肌保护作用,发现了有类似的保护效果。结果显示缺血再灌注处理的H9C2细胞凋亡明显增加,而APG可抑制凋亡。
缺血再灌注损伤的机制目前尚未彻底阐明,一般认为,能量代谢障碍、自由基生成增多、细胞内钙超载等因素是其主要机制[11]。为了探讨APG的抗心肌I/R损伤保护作用是否依赖于其对PKCε蛋白表达的上调,笔者采用特异性PKCε抑制剂CHE,在不影响基础水平PKCε生理功能的浓度下,比较APG预处理组和APG加CHE组心肌细胞在I/R损伤后细胞活力、PKCε及凋亡相关蛋白表达的变化。结果显示4μM/L的APG预处理24 h能有效减轻I/R对心肌细胞的损害,提高细胞存活率,上调Bcl-2/Bax比例且伴有PKCε表达的上调,该保护作用具有剂量依赖性。本研究亦证实,在经I/R损伤的心肌细胞,APG预处理所产生的抗凋亡效应可被PKCε抑制剂CHE明显削弱。
蛋白激酶C(protein kinase C,PKC)是一组具有单一肽链结构而又广泛分布的丝氨酸-苏氨酸激酶,在神经系统中广泛分布,且是心肌缺血再灌注损伤中多种信号传递中的信号分子之一。PKC可转位到胞核内或者启动细胞核内的信号转导,从而发挥心肌保护作用,但并非所有亚型均有作用,目前仅发现PKCε、δ、α、β和η(PKCε尤为突出)有心肌保护作用[12-13]。研究表明,PKCε在心肌缺血预处理、运动预处理、及多种药物预处理抗MI/R损伤过程中发挥重要作用,缺血再灌注损伤后可引发线粒体氧化应激损伤[14-18]。有研究报道 PKCε可作为mKATP通道的上游激活分子,在缺血预处理的信号转导中,PKCε激活后引起线粒体mKATP通道的开放,从而维持保护线粒体,发挥心肌保护作用[19]。
综上所述,本实验证实了APG预处理可以对抗I/R损伤引起的心肌细胞PKCε表达的下调,但仍需进一步探讨PKCε发挥心肌保护作用的相关分子及上下游关系。APG的心肌保护作用涉及PKCε信号通路,这为笔者深入研究APG作为心血管保护药物的作用机制提供了新的思路。
[1] Zhu L,Wei T,Chang X,etal.Effects of Salidroside onmyocardial injury in vivo in vitro via regulation of Nox/NF-κB/AP1 pathway[J].Infammation,2015,38(1):1589-1598.
[2] 杨阳,段维勋,金振晓,等.姜黄素对血管内皮细胞过氧化氢损伤的保护作用及其机制研究[J].中国体外循环杂志,2011,9 (4):239-242.
[3] 杨阳,段维勋,周京军,等.γ-分泌酶抑制剂对正常乳鼠心肌细胞的影响[J].中国体外循环杂志,2011,9(2):89-92.
[4] 杨阳,段维勋,王宁,等.γ-分泌酶抑制剂对大鼠离体心脏缺血再灌注损伤的作用[J].中国体外循环杂志,2013,11(1):41-44.
[5] 赵国龙,张秋芳,翟蒙恩,等.褪黑素受体对大鼠心肌缺血再灌注损伤的调控及其机制研究[J].中国体外循环杂志,2015,13 (2):113-122.
[6] 中国科学院西北高原生物研究所.藏药志[M].西宁:青海人民出版社,1991:250.
[7] CaiM,Ma YL,ZhangW,etal.Apigenin-7-O-β-D-(-6'-p-coumaroyl)-Glucopyranoside treatmentelicitsneurotective effect against experimental ischemic stroke[J].Int JBiol Sci,2016,12 (1):42-52.
[8] Lee SJ,Mun GI,An SM,et al.Evidence for the association of peroxidaseswith the antioxidant effect of p-coumaric acid in endothelial cells exposed to high glucose plus arachidonic acid[J].BMB Rep,2009,42(9):561-567.
[9] Jyoti Roy A,Stanely Mainzen Prince P.Preventive effects of pcoumaric acid on lysosomal dysfunction andmyocardial infarct size in experimentally induced myocardial infarction[J].Eur JPharmacol,2013,699(1-3):33-9.
[10] Delazar A,Celik S,Gokturk RS,et al.Two acylated flavonoid glycosides from stachys bombycina,and their free radical scavenging activity[J].Pharmazie,2006,60(11):878-880.
[11] Zhu XH,Yuan HJ,Wu YN,et al.Non-nvasive limb ischemic pre-conditioning reduces oxidative stress and attenuatesmyocardium ischemia-reperfusion injury in diabetic rats[J].Free Radic Res,2011,45(2):201-210.
[12] Akita Y.Protein kinase C-epsilon(PKC-epsilon):its unique structure and function[J].JBiochem,2002,132(6):847-852.
[13] Chen Y,Tian Q.The role of protein kinase C epsilon in neural signal transduction and neurogenic diseases[J].Front Med,2011,5(1):70-76.
[14] Hund TJ,Lerner DL,Yamada KA,et al.Protein kinase Cepsilon mediates salutary effects on electrical coupling induced by ischemic preconditioning[J].Heart Rhythm,2007,4(9):1183-1193.
[15] Inagaki K,Churchill E,Mochly-Rosen D.Epsilon protein kinase C as a potential therapeutic target for the ischemic heart[J].Cardiovas Res,2006,70(15):222-230.
[16] Hao Z,Pan SS,Shen YJ,et al.Exercise preconditioning-induced early and late phase of cardioprotection is associated with protein kinase C epsilon translocation[J].Circ J,2014,78(7): 1636-1645.
[17] Tang L,Peng Y,Xu T,et al.The effects of quercetin protect cardiomyocytes from A/R injury is related to its capability to increasing expression and activity of PKC epsilon protein[J].Mol Cell Biochem,2013,382(1):145-152.
[18] Yang Y,Wang J,Li Y,et al.Ho-1 signaling activation by pterostilbene treatment attenuatesmitochondrial oxidative damage induced by cerebral ischemia reperfusion injury[J].Mol Neurobiol,2016,53(4):2339-2353.
[19] Costa AD,Garlid KD.Intramitochondrial signaling:interactions amongmito KATP,PKC epsilon,ROS,and MPT[J].Am J Physiol Heart Circ Physiol,2008,295(2):874-882.
Com pound APG derived from Clematis tangutica amelioratesm yocardial ischem ia/reperfusion injury via activating PKCεand inhibiting apoptosis
Feng Ying-da,Feng Jian-yu,Yang Yang,Di Shou-yin,Zhang Wei,Lu Yun-yang,Tang Hai-feng,
Zhu Yan-rong
Institute of Materia Medica,School of Pharmacy,Fourth Military Medical University,Shaan'xi Xi'an 710032,China Corresponding author:Tang Hai-feng,E-mail:tanghaifeng71@163.com Zhu Yan-rong,E-mail:zyr19830812@163.com
Ob jective To investigate the protective effects of APG on myocardial ischemia/reperfusion(I/R)injury(IRI) and its possiblemechanism.M ethods The cultured H9C2 cells were treated with APG for 24 h,and subjected to IRI(I 45min,R 3 h).After the 3 h reperfusion,cell viability,serum LDH and serum MDA,cell SOD activity,apoptotic index,PKCεexpression,Caspase-3 expression,Bax expression and Bcl-2 expression were detected,then the specific inhibitor of PKCεCHEwas applied to evaluate the roles of PKCεin this process.Results I/R treatment reduced cell viability significantly,decreased SOD activity and the Bcl-2/Bax ratio,down-regulated PKCεexpression,up-regulated LDH levels,MDA levels and Caspase-3 expression(vs the control group,P<0.05).Moreover,APG treatment(both 2μM/L and 4μM/L)increased the cell viability,SOD activity and the Bcl-2/Bax ratio,down-regulated LDH levels,MDA levels and Caspase-3 expression,up-regulated PKCεexpression in a dose dependentmanner (vs the I/R group,P<0.05).In addition,compared with the APG+IR group,CHE treatment reduced the cell viability,up-regulated Caspase-3 expression,decreased the Bcl-2/Bax ratio(vs the APG+I/R group,P<0.05).Conclusion APG treatment ameliorates I/R injury via activating PKCεpathway and inhibiting apoptosis.
Clematis tangutica;Myocardial ischemia/reperfusion injury;PKCε;Apoptosis
2016-09-23)
2016-10-24)
10.13498/j.cnki.chin.j.ecc.2017.01.11
国家自然科学基金(81403182,81503285,81570231)
710032西安,第四军医大学药物研究所(冯颖达、陆云阳、汤海峰);710032西安,第四军医大学西京医院心血管外科(冯建宇),药剂科(朱艳荣、张 伟);710032西安,第四军医大学生物医学工程系(杨 阳);710032西安,第四军医大学唐都医院胸外科(狄守印)
汤海峰,E-mail:tanghaifeng71@163.com;朱艳荣,E-mail:zyr19830812@163.com
