便携式体外生命支持系统离体和在体实验研究
2017-04-11周圆圆尹宗涛李洪谊王辉山
刘 宇,周圆圆,尹宗涛,李洪谊,王辉山
·基础研究·
便携式体外生命支持系统离体和在体实验研究
刘 宇,周圆圆,尹宗涛,李洪谊,王辉山
目的 初步考察便携式体外生命支持系统的离体和在体性能。方法 离体实验检测便携式体外生命支持系统的稳定性;在体实验中12只雌性巴马香猪随机分为实验组和对照组,每组6只。分别应用便携式体外生命支持系统及Maquet公司Rotaflow系统进行体外循环,4.0 L/min运转6 h,于转流前、转流中每2 h及转流后取静脉血检测游离血红蛋白含量评价装置溶血性能并检测血小板激活率。结果 离体实验证实便携式体外生命支持系统稳定性优于或等于同类Maquet公司Rotaflow系统;在体实验提示4.0 L/min流量运行6 h,血浆游离血红蛋白含量均在50 g/L以下,血小板激活均小于8%。结论便携式体外生命支持系统离体和在体性能稳定、可靠。
便携;体外生命支持;动物实验;体外实验
战伤及外伤所致的严重心脏、大血管损伤救治难度大、死亡率高,很多由于无法接受及时、合理的治疗导致死亡。回顾性研究发现,心肺复苏等院前急救措施的普及显著提高了院前心跳骤停患者的抢救成功率[1],但抢救成功率也仅有30%。体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)技术为体外生命支持治疗提供了一个新的方向和选择,应用ECMO救治战伤和严重创伤可能会为这部分伤员的后送和救治赢得时间,这同时也对ECMO救治的现场性提出了新的要求[2]。目前,临床应用的ECMO系统便携性较差并且长期以来为进口产品,无法满足现场救治的便携性要求,同时限制了国产医疗设备的发展。本课题前期初步构建了国产化便携式体外生命支持系统(portable extracorporeal life support system,PELS),此研究主要考察该系统部分离体和在体性能。
1 材料与方法
1.1 实验动物 健康成年雌性巴马香猪(沈阳军区总医院实验动物中心提供)12只,体重38~52(44.92 ±4.5)kg,术前12 h禁食,4 h禁饮。
1.2 主要仪器及材料 对照组采用Maquet公司Rotaflow系统,实验组采用自行研制PELS系统,两套系统均采用Maquet公司ECMO套包,Sorin公司变温水箱。体外插管:Edward公司16 F股动脉插管、18 F股静脉插管;Datex-Ohmeda公司S/5多功能监护仪,预充液总量约为600 ml(其中包括复方乳酸钠注射液600 ml,肝素4 000 U)。血浆游离血红蛋白(plasma free hemoglobin,PFH)试剂盒(Sigma公司,StLouis,MO),血小板激活试剂盒(Sigma公司,St Louis,MO)等。
1.3 装置设计 PELS系统以磁耦合离心驱动系统为基础,辅助有转速控制,血流量检测,血液压力检测的多传感血液循环装置。该装置通过磁耦合驱动的方式实现驱动机构对离心泵头转动驱动。采用Maxon高速电机提供动力驱动,集成有超声波血液流量监测传感器及高精度血液压力监测传感器,可实现血液循环压力连续在线监测与报警。同时为了满足便携式的野外急救需要,本装置还集成了基于锂电池供电的电源管理系统,可实现市电与锂电池供电工作两种工作方式,锂电池供电下系统运行时长不小于4 h。该装置整体尺寸不超过300mm×300 mm×400 mm,总体重量不超过10 kg,见图1。

图1 PELS系统实物图
1.4 离体实验 建立PELS离体循环实验管路,主要包括PELS系统,ECMO套包,超声波流量计,循环水槽等,如图2。

图2 PELS体外实验模拟管路连接图
PELS系统体外模拟测试,包括驱动转速稳定性、流量检测稳定性测试、压力稳定性测试及电池供电时间测试。为了实现对PELS系统进行全面测评,在电池供电下,通过设置(转速、流量)两个参数,进行(转速、流量、压力)三个参数的监测,测试时长4 h。具体参数设置如下:设置PELS的转速分别为2 000 r/min和4 000 r/min,流量分别为1.0 L/ min和4.5 L/min,然后检测PELS系统输出的(转速、流量、压力)三个参数。具体实验过程如下:按图示连接好管路系统后,对系统进行预充,设置PELS系统转速分别为2 000 r/min和4 000 r/min,通过调节节流阀设置超声波流量计显示流量分别为1.0 L/min和4.5 L/min,启动PELS数据保存功能,系统将自动保存(转速、流量、压力)三个检测参数,每次采用电池供电运行,运行时长4 h,重复实验4次。
1.5 在体实验
1.5.1 动物模型建立 实验用猪采用氯胺酮20 mg/kg及阿托品0.5 mg肌内注射诱导麻醉,1.5%~2.0%异氟烷面罩吸入5 min后行气管内插管,呼吸机辅助呼吸,吸入氧浓度40%,潮气量10 ml/kg,呼吸频率15~20次/min。右颈部、胸部、下腹部、双侧腹股沟备皮,胸部贴电极片行心电监护,猪舌中部夹氧饱和度探头监测末梢血氧饱和度,肛门置温度探头监测直肠温度。术区以安尔碘消毒,铺无菌单。双侧腹股沟穿刺左侧股静脉及右侧股动静脉,分别置入5 F中心静脉导管、20 G动脉穿刺针作为中心静脉压、静脉输液通路及动脉监测。右颈部气管旁行约4 cm长纵切口,切开皮肤、皮下组织,胸锁乳突肌中点内侧肌间沟内分离出右侧颈总动脉及颈内静脉,以5-0 Prolene缝线于颈总动脉及颈内静脉预置荷包缝线,切开血管后分别置入16 F股动脉插管及18 F股静脉插管(股静脉插管需置入右心房内),股静脉注射肝素钠300 U/kg全身肝素化。体外生命支持系统及ECMO系统管道预充排气,连接动静脉插管建立体外循环。4.0 L/min运转6 h,于转流前、转流期间每2 h和转流后采集静脉血10 ml用于后续检测,而后逐渐减低流量并停机。拔除颈总动脉及颈内静脉插管,收紧荷包线打结止血,鱼精蛋白中和肝素。
1.5.2 PFH检测 待测全血1 ml,4℃,15 000 g离心10 min,分离血清,再次4℃,15 000 g离心10 min。应用PFH试剂盒,在试管内分别加入待测血浆20μl,空白管加去离子水20μl,标准管加血红蛋白标准液20μl。于上述各管内加入1.0 ml 0.2%邻甲苯胺溶液,再加入1.0 m l 1%过氧化氢溶液,混匀放置10 min,各管加入10 ml 10%冰乙酸溶液,于分光光度计波长为435 nm测定浓度。
1.5.3 血小板激活 检测应用血小板激活检测试剂盒,待测全血20μl,加入荧光素标记的抗血小板单克隆抗体各10μl,室温避光反应20 min,立即加入1.0ml1%多聚甲醛混匀,4℃保存,24 h内在流式细胞仪上分析。以CSD、FSC和CD61识别获取血小板,以速度300个/s获取10 000个血小板进行FL1和FL2分析。ELISA定量测定血浆中WF及CD62P水平。计算血小板激活指数。
2 结果
2.1 离体实验结果 离体实验统计结果表明,PELS系统可以稳定输出预设的转速及相应流量,本系统各项参数均优于目前Maquet公司Rotaflow产品的公开技术参数。见表1~3。

表1 PELS系统与Maquet公司Rotaflow产品参数对照表
2.2 在体实验结果 PELS系统及Maquet公司Rotaflow系统均运行平稳,全组实验动物无死亡。
2.2.1 PFH检测 PFH检测结果显示,4.0 L/min装置运行6 h后,两组PFH含量均在50 g/L以下,两组间比较无统计学差异,提示两套装置对血细胞损伤较弱,并且在应用相同ECMO套包的条件下,PELS系统与Rotaflow系统相比红细胞损伤无显著性差异。见图3。
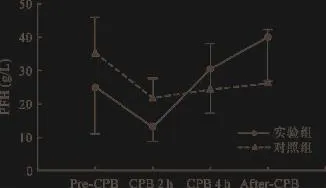
图3 PFH检测
2.2.2 血小板激活检测 血小板激活性能检测结果显示,4.0 L/min装置运行6 h,两种装置对血小板激活均在8%以下,实验组与对照组血小板激活无显著差异。见图4。

图4 血小板激活检测
3 讨论
表2 PELS系统离体实验数据统计表(±s)

表2 PELS系统离体实验数据统计表(±s)
序号 设定转速(r/min) 设定流量(L/min) 平均转速(r/min) 平均流量(L/min) 平均压力(mm Hg) 1 2 000 1.0 1 987±6.0 1.02±0.04 105±0.69 2 2 000 1.0 1 989±5.2 1.03±0.04 106±0.69 3 2 000 1.0 2 002±4.3 1.01±0.05 113±0.54 4 2 000 1.0 1 999±3.8 1.06±0.03 104±1.45平均 2 000 1.0 1 994±4.8 1.03±0.04 107±0.84
表3 PELS系统离体实验数据统计表(±s)
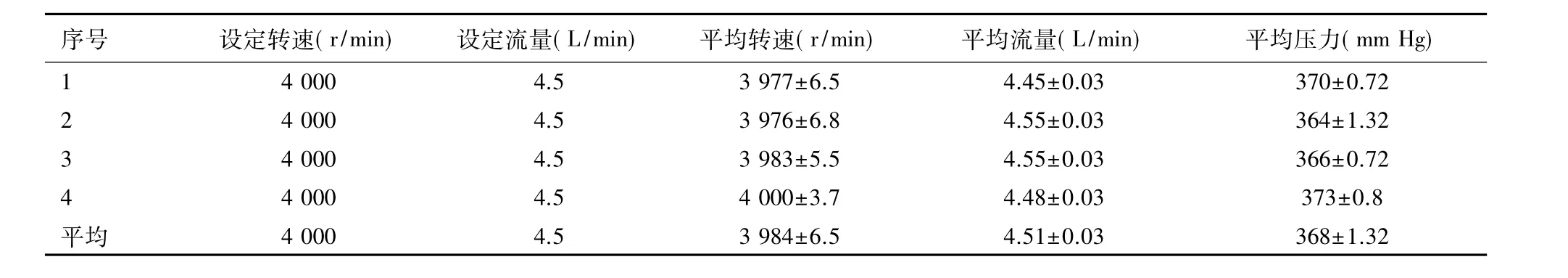
表3 PELS系统离体实验数据统计表(±s)
序号 设定转速(r/min) 设定流量(L/min) 平均转速(r/min) 平均流量(L/min) 平均压力(mm Hg) 1 4 000 4.5 3 977±6.5 4.45±0.03 370±0.72 2 4 000 4.5 3 976±6.8 4.55±0.03 364±1.32 3 4 000 4.5 3 983±5.5 4.55±0.03 366±0.72 4 4 000 4.5 4 000±3.7 4.48±0.03 373±0.8平均 4 000 4.5 3 984±6.5 4.51±0.03 368±1.32
战场及外伤后心脏及大血管损伤可以迅速导致失血性休克救治难度较大,通过PELS在院前或基层医疗机构用于这类伤员的救治可以赢得宝贵的救治时间。因此,研制国产化的PELS系统对于国产医疗设备的发展及危重患者救治均具有积极作用。但是,目前临床应用的ECMO系统设备庞大、操作复杂、移动性差,无法满足现场救治等恶劣条件下的应用需要[3]。针对这些问题,本课题组前期工作中设计、开发了PELS系统,以磁耦合离心血泵为基础构建了PELS系统的泵装置。
氧合器、泵装置和循环管路是体外生命支持设备必不可少的三大组件。其中,影响设备便携性的瓶颈主要在于泵装置。因此,笔者首先仅对泵装置进行了设计及开发,使其可以兼容Maquet公司的ECMO套包。由于氧合器和循环管路共同组成ECMO套包,动物实验期间氧合效率及CO2排出等考察氧合器的这种指标并不在本考察范围内。本次主要考察了泵装置与Maquet公司离心泵头兼容性能。
本研究的PELS系统基于磁耦合离心驱动原理,实现了体外辅助循环的小型化便携式集成。该装置通过磁耦合驱动的方式实现驱动机构对离心泵头转动驱动[4],离心泵头与驱动机构分离,可实现血液循环过程中的封闭运行,减少血液污染,离心泵头可为一次性耗材,减少了血液交叉感染。采用高速电机提供动力驱动,可满足成人血液循环所需流量[5]。由于本系统集成了血液流量监测传感器及高精度血液压力监测传感器,可以满足体外生命支持过程中的安全使用。同时,为了实现便携式的野外急救,本装置集成了大容量锂电池,可以满足长时间运转。此外,整机尺寸不超过300mm×300 mm×400 mm,总体重量不超过10 kg,实现救护车搭载或单人携带,也保证了该装置的便携性能,大大提高了体外辅助循环应用范围。离体实验提示,该装置可以很好的兼容Maquet公司ECMO套包,在相同条件下其转速、流量学、电池工作时长上均优于Maquet公司的Rotaflow系统。
为检测PELS系统实际应用效果,笔者进行了动物实验。在课题组之前进行ECMO辅助动物模型基础上[6],进行了PELS系统及Rotaflow系统长时间ECMO辅助实验。本动物实验中检测了PFH及血小板激活情况,结果表明,PELS系统辅助6 h后血PFH含量及血小板激活情况与Rotaflow系统相比无显著差异,提示PELS系统辅助6 h以内对红细胞的损害与Rotaflow系统无显著差异,能够符合临床要求,足以满足战场救治后送需要。
综上所述,自行研制的PELS系统与Maquet公司Rotaflow离心泵相比具有相似稳定性,优秀的便携性和超长的运行时间,并且可以很好的兼容Maquet公司ECMO套包,6 h内不增加红细胞损伤的风险,可以实现短时间伤病员后送及体外生命支持的需要。
[1] Daya MR,Schmicker RH,Zive DM,et al.Out-of-hospital cardiac arrest survival improving over time:Results from the Resuscitation Outcomes Consortium(ROC)[J].Resuscitation,2015,91 (1):108-115.
[2] Schmidt F,Sasse M,Boehne M,et al.Concept of"awake venovenous extracorporealmembrane oxygenation"in pediatric patients awaiting lung transplantation[J].Pediatr Transplant,2013,17 (3):224-230.
[3] Wu ZJ,Zhang T,Bianchi G,et al.Thirty-day in-vivo performance of a wearable artificial pump-lung for ambulatory respiratory support[J].Ann Thorac Surg,2012,93(1):274-281.
[4] 关醒凡.现代泵技术手册[M].第1版.北京:宇航出版社,1995.179-305.
[5] 张根广,张鸣远,杨万英,等.模型血泵相似性设计及验证[J].西安交通大学学报,2008,42(1):32-35.
[6] 刘宇,张永,韩劲松,等.失血性休克后深低温救治-复苏小型猪模型的建立[J].中国体外循环杂志,2016,14(2):56-59.
Portable extracorporeal life support system in vitro and in vivo experiment
Liu Yu,Zhou Yuan-yuan,Yin Zong-tao,Li Hong-yi,Wang Hui-shan
Department of Cardiovascular Surgery,General Hospital of Shenyang Military Area Command,Shenyang,110016,China
Wang Hui-shan,Email:huishanwang@hotmail.com
Ob jective To explore the performance of a portable extracorporeal life support(PELS)system in vitro and in vivo.Methods In vitro,PELSsystem was tested for stable assessment;in vivo,12 female swinewere randomized into experimentgroup(n =6)and control group(n=6).Cardiopulmonary bypass(CPB)was repectively established with PELSand RotaFlow with 4 L/min of flow for 6 h.The plasma free hemoglobin and plateletactivation were evaluated before initial of CPB,every 2 hs in CPB and after terminated CPB.Results In vitro,experiments confirmed that the stability of PELSsystem was better than or equal to Maquet company Rotaflow system;in vivo,the plasma free hemoglobin was lower than 20 g/L and the plateletactivation was lower than 10%after 6 h performance of PELS system.Conclusion The portable extracorporeal life support system conducts the reliable performance in vitro and in vivo.
Portable;Extracorporeal life support;In vivo;In vitro
2016-10-12)
2017-01-19)
10.13498/j.cnki.chin.j.ecc.2017.01.10
2013年军队装备研制项目重大项目(ASY135001);2014年辽宁省建设产业技术创新体系示范工程医疗器械临床研究平台(2014305006)
110016沈阳,沈阳军区总医院心血管外科(刘宇、尹宗涛、王辉山);110167沈阳,中国科学院沈阳自动化研究所(周圆圆、李洪谊)
王辉山,Email:huishanwang@hotmail.com
