重编程心肌细胞治疗大鼠心动过缓
2017-04-11胡雁南郞希龙
胡雁南,薛 祥,张 浩,郞希龙
·基础研究·
重编程心肌细胞治疗大鼠心动过缓
胡雁南,薛 祥,张 浩,郞希龙
目的 将Tbx18基因导入窦房结损毁模型的大鼠左室心尖部,探索治疗缓慢型心律失常疾病的新方法。方法取24只成年的Sprague Dawley雄性大鼠,随机分为实验组(n=12)和对照组(n=12),实验组注入Tbx18起搏基因,对照组植入等量绿色萤光蛋白(GFP),观察其心率变化及对儿茶酚胺的反应性。对移植部位的心肌行Western blot及免疫荧光检测。结果 实验组的自主心律明显高于对照组(P<0.05)。且移植组的自主心律起源于基因注入部位。注射异丙肾上腺素后,移植组心律明显高于对照组(P<0.05),移植部位心肌组织行Western blot及免疫荧光检测提示:实验组Tbx18蛋白的表达明显高于对照组。结论 将Tbx18基因植入窦房结损毁模型的大鼠左室心尖部,可以显著提高大鼠的心率,且对异丙肾上腺素具有良好的反应性。
Tbx18基因;生物起搏器;基因治疗;心动过缓
缓慢型心律失常疾病是一类严重的心脏传导疾病,目前主流的治疗方法是植入电子起搏器,然而其中约有5%的患者因各种并发症需进一步治疗,如:心律失常、气胸、血气胸、感染、出血等[1]。此外,当电子起搏器的电池耗尽,就可能引起患者的心脏骤停并需手术更换电池。为解决这些问题,一种新型的起搏方式—生物心脏起搏器应运而生。与电子心脏起搏器相比,生物心脏起搏器无需电池、电极、导线等,并具有更好的自主反应性[2]。近期有研究表明过表达人的干细胞转录因子Tbx18可以使正常的心肌细胞重编程为起搏样细胞[3],然而由于缺乏长期的观察且利用腺相关病毒转基因表达时间较短,限制了其临床应用。本文拟研究将利用慢病毒为载体,将Lenti.Tbx18.注入到大鼠窦房结损毁模型的左室心尖部,探索治疗缓慢型心律失常疾病的新方法。
1 材料和方法
1.1 窦性心动过缓模型建立 选取24只成年雄性大鼠,购自第二军医大学动物实验中心,体重约130 g。将大鼠随机分为Lenti.hTbx18实验组(n=12)和Lenti.EGFP对照组(n=12),将大鼠放入麻醉仓中,吸入异氟烷5 L/min约2 min,待其麻醉后,迅速将其置于麻醉台上,将舌拉出显露会厌,经会厌迅速插入气管插管,将大鼠仰卧位固定于操作台上,四肢胶带固定,将异氟烷流量降至为2 L/min,备皮,脱毛,75%酒精消毒,肢体导联体表心电图监测并记录ECG。自左侧第六肋间进胸,暴露心脏,显露窦房结。使用电烧器烧灼窦房结及周围组织。同时心外膜缝合临时起搏导线,连接临时起搏器。直至心电图显示房性“P”波消失、宽大的QRS,房室分离出现,使用临时起搏器调起搏心率120 bpm予以保护,肢体导联体表心电图监测并记录ECG。实验动物的饲养及操作过程均符合《实验动物管理条例》,并经长海医院伦理委员会批准(CHEC-2015-0012)。
1.2 病毒注射 Tbx18重组慢病毒购自和元生物技术有限公司,滴度约2.09×108TU/ml。使用10μl微量注射器及30 G的注射针头,与心室面成30~45°夹角进针约4 mm,于左室心尖部无血管区行病毒注射,回抽无血后将病毒液直接注入左心室心尖部,注射后,于左室心肌表面加压止血约5min,防止病毒液的溢出。心外膜缝合起搏导线连接起搏器,起搏频率为120 bpm,记录该点起搏的兴奋点在体表心电图中QRS波群的方向及形态,用以对比分析病毒注射后出现室性自主节律的起搏点是否来源于病毒注射的部位,同时在注射点处心外膜采用5-0 Prolene线进行标记。
1.3 心电图检查 实验组和对照组于1周,2周,3周,4周,6周,8周,随机各取6只大鼠行心电图检查,将大鼠放入麻醉仓中,吸入麻醉约2min,将电极插入大鼠的双上肢及左下肢皮下,根据体表ECG各导联QRS波形态,与心外膜起搏标测记录的心电图相比,判断该室性心律是否来源于病毒注射部位。
1.4 神经递质反应性(异丙肾上腺素) 第4周两组各取6只大鼠,经尾静脉按1μg/(kg·min)注射异丙肾上腺素5 min,观察两组大鼠的心率变化,并比较组间差异。
1.5 Western blot及免疫荧光 2个月后腹腔注射苯巴比妥处死动物,取细胞移植部位心肌标本行Western blot检测,一抗为鼠抗人hTbx18(Abcam公司,1∶50),二抗为羊抗鼠IgG(Santa Cruz,1∶200)。术后8周处死动物,取注射部心肌位并制成5μm的冰冻切片,丙酮固定,行免疫荧光染色检测。
1.6 统计学分析 所有统计学分析均采用SPSS19统计软件处理,所有计量资料以均数±标准差(±s)表示。数据先使用K-S法进行正态性检验,使用Levene's方法进行方差性检验,两组之间的均数比较使用t检验,各组内多个组间比较采用two-way ANOVA进行重复测量。P<0.05,认为两组数据差别具有统计学意义。
2 结 果
2.1 窦房结损毁模型的建立 正常大鼠生理状体下的心率>160 bpm。图1为烧灼窦房结建立窦房结毁损模型。当大鼠窦房结毁损模型建立后,体表心电图可见原先P波消失,变为不规则P波,心室率减慢约为80 bpm,持续观察30 min未恢复认为建模成功,实验过程中未发生死亡事件,见图2。

图1 手术法建立窦房结损毁模型

图2 正常心电图和损毁后心电图
2.2 心电图检查 在病毒注射前,两组动物心率无明显差异,(66±3.8)bpm vs(64.0±3.9)bpm,(P>0.05)。实验组心率在1周时达到顶峰,后维持6周,两组数据差别具有统计学意义(P<0.05),见图3。在第8周实验组心率开始出现下降趋势但仍高于对照组,数据分别为1周后心率为(168.5±14) bpm vs(64.0±5.9)bpm,2周后心率为(170.4±16) bpm vs(76.3±6.3)bpm,3周后心率为(188.6±18.2)bpm vs(54.1±4.2)bpm,4周后心率为(189.1±21.2) bpm vs(71.8±6.6)bpm,6周后心率为(175±17.0) bpm vs(73±4.0)bpm,8周后心率为(68.3±5.0)bpm vs (66±3.8)bpm。第4周实验组动物心电图QRS波方向和形态被证实与心外膜起搏时QRS波方向和形态相同,提示自主心律起源于病毒注射部位。见图4。

图3 6周大鼠心率变化结果

图4 4周后大鼠的室性心率
2.3 儿茶酚胺反应性 第4周各取6只大鼠行儿茶酚胺反应性研究,对实验组大鼠尾静脉注射异丙肾上腺素1μg/(kg·min)持续时间5 min,大鼠心率基础值由(174.2±11.4)bpm增至(230.1±15.4) bpm。对照组中大鼠心率基础值为(64.0±3.9)bpm,使用异丙肾上腺素后心率增加为(74.5±2.6)bpm,两组差别具有统统计学意义,P<0.05。见图5。
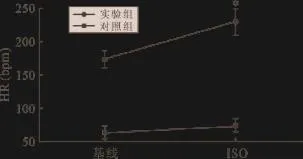
图5 3周时注射异丙肾上腺素后大鼠心率变化
2.4 Western blot及免疫荧光 实验组及对照组病毒注射部位行Western blot检测目的蛋白Tbx18的表达,其结果显示:与对照组相比实验组中Tbx18蛋白表达量显著增高,差异具有统计学意义。见图6。为了进一步的明确实验组心肌细胞Tbx18蛋白表达情况,通过抗Tbx18免疫荧光染色,其结果显示:hT-bx18细胞膜(绿色荧光)在实验组高表达。见图7。
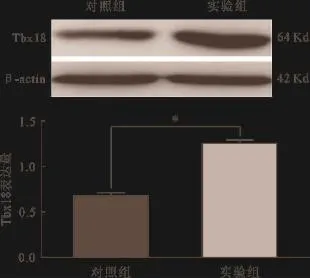
图6 大鼠心肌细胞的Western blot检测

图7 大鼠心肌细胞的抗hTbx18免疫荧光染色(×40)
3 讨论
Tbx18在发育中的动物心脏的原始心外膜、室间隔、瓣膜、上腔静脉及窦房结中都有表达,窦房结胚胎组织的发育需要Tbx18,本实验通过Tbx18转染心肌细胞成功构建心脏生物起搏器,转染起搏基因后的心肌细胞不仅具有窦房结样细胞的起搏功能,且具有很低起搏器使用率,本实验通过心外膜灼烧可造成窦房结透壁性不可逆损伤,从而造成心律减慢,窦性停搏等心律失常,而转染了Tbx18的心室肌细胞,不仅具有良好的自主节律性,并且其起搏位点来源于Tbx18病毒注射部位。生物起搏器不仅具有更好的自主反应性且对儿茶酚胺高度敏感,这些优势使得生物起搏器走进临床服务患者成为可能。以往的基因法构建生物起搏器主要方式是通过增加离子通道的数目以达到更多地内向电流而发挥起搏作用[4-8],而笔者采用了一种更直接、高效的方法——将起搏基因直接导入心肌细胞,使其成为类窦房结样细胞而发挥起搏功能[3],目前的研究不仅证实了Tbx18可将心肌细胞转化为窦房结样细胞,而且还证实了这种转化具有良好的自主反应性。本实验发现生物起搏器电活动的活跃期是病毒注射后第1周,第8周后病毒转染组的心率也降低,可能原因是由于异源性蛋白表达,可引起了自身免疫反应,导致了表达Tbx18的心肌细胞受到了清除。以往的基因治疗方法大多是通过腺病毒作为载体导入心肌细胞或干细胞,然而腺病毒的表达时限较短且不能整合到宿主的染色体中,无法实现稳定持久的表达。理想的起搏器,无论是电子起搏器还是生物起搏器都应当具有良好的自主调节和自主反应性[9-10]。本实验通过使用慢病毒使起搏基因整合到宿主细胞的染色体中以实现长期持久的表达,使其表达时限提高到8周,使其为临床应用迈进一大步。
然而本实验仍有不足之处:首先,表达时限问题一直是制约生物起搏器发展的主要问题,也是生物起搏器代替电子起搏器关键。由于小动物心律较快,与大动物实验相比,大动物实验更贴近临床。而暂时性起搏也具有一定的临床意义,例如临床上因起搏器发生感染的患者,常需要移除起搏器,使用抗生素抗感染治疗,待感染控制后,才能再次重新安装电子起搏器,这期间可以使用临时起搏器作为过渡[11]。所以下一步研究的关键是如何提高基因的表达时限问题。其次是注入起搏基因后大鼠的心率虽然较前有所提升但仍低于正常心率,所以下一步研究方向是否可以联合两种起搏基因注入心肌细胞以达到更好的起搏效果。最后利用大动物实验验证其起搏效果及相关基因及蛋白的表达情况,为临床应用奠定坚实的基础。
[1] Eberhardt F,Bode F,Bonnemeier H,etal.Long term complications in single and dual chamber pacing are influenced by surgical experience and patientmorbidity[J].Heart,2005,91(4):500-506.
[2] Chauveau S,Brink PR,Cohen IS.Stem cellebased biological pacemakers from proof of principle to therapy:a review[J].Cytotherapy,2014,16(7):873-880.
[3] Kapoor N,Liang W,Marban E,et al.Direct conversion of quiescent cardiomyocytes to pacemaker cells by expression of Tbx18[J].Nat Biotechnol,2013,31(1):54-62.
[4] Plotnikov AN,Bucchi A,Shlapakova I,etal.HCN212-channel biological pacemakersmanifesting ventricular tachyarrhythmiasare responsive to treatment with I(f)blockade[J].Heart Rhythm,2008,5(2):282-288.
[5] Boink GJ,Duan L,Nearing BD,etal.HCN2/SkM1 gene transfer into canine left bundle branch induces stable,autonomically responsive biological pacing at physiological heart rates[J].JAm Coll Cardiol,2013,61(11):1192-1201.
[6] Lu W,Yaoming N,Boli R,et al.mHCN4 genetically modified canine mesenchymal stem cells provide biological pacemaking function in complete dogs with atrioventricular block[J].Pacing Clin Electrophysiol,2013,36(9):1138-1149.
[7] Zhou YF,Yang XJ,Li HX,et al.Genetically-engineered mesenchymal stem cells transfected with human HCN1 gene to create cardiac pacemaker cells[J].J Int Med Res,2013,41(5):1570-1576.
[8] Boink GJ,Nearing BD,Shlapakova IN,et al.Ca(2+)-stimulated adenylyl cyclase AC1 generates efficient biological pacing as single gene therapy and in combination with HCN2[J].Circulation,2012,126(5):528-536.
[9] Occhetta E,Bortnik M,Marino P.Usefulness of hemodynamic sensors for physiologiccardiac pacing in heart failure patients[J].Cardiol Res Pract,2011,2011:925653.
[10] Brubaker PH1,Kitzman DW.Chronotropic incompetence:Causes,consequences,andmanagement[J].Circulation,2011,123 (9):1010-1020.
[11] Sohail MR,Uslan DZ,Khan AH,etal.Managementand outcome of permanent pacemaker and implantable cardioverter-defibrillator infections[J].JAm Coll Cardiol,2007,49(18):1851-1859.
Reprogrammed cardiom yocytes in treatment of bradycardia in rats
Hu Yan-nan,Xue Xiang,Zhang Hao,Lang Xi-long
Department of cardiothoracic surgery,Changhai Hospital,Second Military Medical University,Shanghai200433,China
Lang Xi-long,Email:langx1666@sohu.com
Objective To explore a new approach to treatment for bradycardia by transplanting Tbx18 gene to the apex of the LV in ratsmodel of sinoatrial node damage.M ethods Twenty-four ratswere randomed into test group and control group.Rats in test group were injected with Tbx18 and those in control group were injected with GFP,the heart rhythm of each group and catecholamine-responsive were observed.Western blot and immunofluorescence were tested for themyocardium of the injection site.Results The heart rates in test group were faster than control group and the rhythm originated from the injection site.The rhythm in test group was faster than control group after isoprenaline injected.Western blot and immunofluorescence studies showed that the expression of Tbx18 in test groupare was higher than control group.Conclusion Transplanting Tbx18 gene to apex of the LV can increase the rhythm of bradycardia in rats and this increase rhythm is sensitive to isoprenaline.
Tbx18 gene;Biological pacemaker;Gene therapy;Bradycardia
2016-09-26)
2016-10-24)
10.13498/j.cnki.chin.j.ecc.2017.01.12
国家自然科学基金资助项目(81271707)
200082上海,第二军医大学附属长海医院胸心外科
郎希龙,E-mail:langx1666@sohu.com
