抗IL-9抗体治疗肝癌恶性腹水的疗效及其机制研究①
2017-04-10张沛玲雷荣娥覃沁怡姜海行覃山羽
张沛玲 雷荣娥 覃沁怡 石 城 姜海行 覃山羽
(广西医科大学第一附属医院消化内科,南宁530021)
抗IL-9抗体治疗肝癌恶性腹水的疗效及其机制研究①
张沛玲 雷荣娥 覃沁怡 石 城 姜海行 覃山羽
(广西医科大学第一附属医院消化内科,南宁530021)
目的:探索抗IL-9抗体治疗小鼠肝癌恶性腹水(MA)的疗效及作用机制。方法:应用小鼠H22细胞系建立小鼠MA模型,造模24 h后将45只小鼠随机分成实验组、阴性对照组和空白对照组,每组15只。实验组给予腹腔注射抗IL-9抗体,阴性对照组给予注射同型IgG抗体,空白对照组给予注射生理盐水,隔天1次,共注射5次。每次注射前均称量各组小鼠体重,并观察小鼠日常活动状态。末次用药结束24 h后每组随机处死5只小鼠,测量MA体积,收集MA上清,采用ELISA法检测MA中VEGF、MMP-2、IL-9、IFN-γ表达水平。其余小鼠观察其生存时间。结果:干预后实验组、阴性对照组和空白对照组小鼠的MA体积分别为(6.70±1.52)ml、(10.28±1.75)ml、(10.36±2.30)ml,与空白对照组和阴性对照组相比,实验组小鼠MA体积明显减少,差异有统计学意义(P<0.05)。实验组小鼠平均生存时间为(17.2±2.1)d,显著长于阴性对照组(14.5±1.2)d和空白对照组(14.8±1.4)d(P<0.05);与空白对照组和阴性对照组相比,实验组小鼠MA中VEGF水平显著降低,差异有统计学意义(P<0.05),与阴性对照组相比,实验组小鼠MA中IL-9水平显著降低,差异有统计学意义(P<0.05);但三组间MMP-2、IFN-γ水平比较差异无统计学意义(P>0.05)。结论:腹腔注射抗IL-9抗体可以有效地抑制H22细胞荷瘤小鼠MA的产生,延长其生存时间,该作用可能是通过抑制MA中VEGF、IL-9的表达而实现。
恶性腹水;抗IL-9抗体;H22细胞;肝癌
多种恶性肿瘤,如肝癌、卵巢癌、胃癌等疾病发展至晚期时,由于肿瘤细胞侵袭和转移到腹腔可导致恶性腹水(Malignant ascites,MA),大量MA严重影响患者的生活质量并缩短患者的生存时间[1]。除了原发病的治疗外,现阶段对于MA的治疗并没有十分有效的方法。血管生成和血管渗透性增加被认为是MA形成的主要机制。目前临床上治疗MA的药物(如恩度、卡妥索单抗等)主要是通过抑制肿瘤细胞表达血管内皮生长因子(VEGF)、基质金属蛋白酶-2(MMP-2)等因子来抑制肿瘤血管生成,进而减少MA的产生[2,3]。然而,这些药物的临床疗效有限,仍需寻找其他有效的药物进行治疗。
研究表明,MA中含有大量的免疫细胞和免疫因子,这些免疫细胞和免疫因子在MA的发生、发展和转归中发挥重要的作用[4]。然而,目前有关MA中免疫因子作用的报道十分有限,仍需进一步研究。白细胞介素9(IL-9)是机体重要的免疫因子,可由多种免疫细胞(Th2、Th9、Th17和Treg细胞等)分泌[5]。本研究前期实验已发现肝癌患者的MA中IL-9水平较肝硬化患者腹水中的水平高[6],且肝癌患者MA中高表达IL-9与患者生存期缩短相关,因此我们推测IL-9可能具有促进MA发生发展的作用,但目前尚未有抑制IL-9水平对MA转归影响的研究报道。因此,本研究通过建立小鼠肝癌MA模型,并给予抗IL-9抗体干预,以进一步阐明IL-9在MA的作用,并探索抗IL-9对治疗MA的疗效和机制。
1 材料与方法
1.1 材料 清洁级雌性BALB/c小鼠45只,4~5周龄,体质量18~22 g,由广西医科大学实验动物中心提供,动物许可证号:SYXK桂2014-0002。肝癌H22 MA瘤模型小鼠购自广西中医药研究所。实验小鼠饲养于室温(24±2)℃,相对湿度40%~60%,12 h光照、12 h黑暗的实验室中,自由摄取食物和水。动物适应性饲养3 d,实验过程中喂食小鼠标准颗粒饲料(购自广西医科大学实验动物中心)。多克隆山羊抗鼠IL-9抗体和同型对照IgG抗体均购于美国R&D公司;小鼠VEGF、MMP-2、IL-9、IFN-γ的酶联免疫吸附(Enzyme linked immunosorbent assay,ELISA)检测试剂盒购自中国武汉华美生物工程有限公司。
1.2 方法
1.2.1 MA瘤小鼠模型的制作 取传代第7天鼠肝癌H22MA瘤小鼠1只,颈椎脱臼法处死,用75%乙醇消毒小鼠腹部,于超净台下无菌操作吸取小鼠腹腔乳白色瘤液3 ml,移入离心管离心(1 000 r/min离心5 min),收集H22细胞。用PBS缓冲液轻轻吹打后离心(1 000 r/min,5 min),弃上清,用PBS缓冲液将细胞悬液浓度调整为1×107ml-1。0.4%台盼蓝染色镜检细胞存活率≥95%后行腹腔接种。用75%乙醇消毒小鼠腹部,每只小鼠腹腔注射瘤细胞悬液0.2 ml(相当于瘤细胞数2×106个/只)。整个过程严格无菌操作,接种于1 h内完成。
1.2.2 实验小鼠分组与用药 小鼠腹腔注射H22细胞24 h后,将45只小鼠随机分成实验组、阴性对照组和空白对照组,每组15只。实验组给予腹腔注射抗IL-9抗体(20.0 μg/只),阴性对照组给予注射同型IgG抗体(20.0 μg/只),空白对照组给予腹腔注射等体积的生理盐水。各组小鼠隔日给药1次,共给药5次,每只小鼠每次注射药体积均为0.2 ml。
1.2.3 观测指标
(1) 一般观测指标:用药期间观察各组小鼠毛色,活动状况及精神状态等一般生活状况,每次给药前称量体重。(2) 小鼠MA体积检测:末次给药24 h后,采用颈椎脱臼法每组随机处死5只小鼠,利用无菌注射器抽取MA并测量MA体积;按下列公式计算小鼠MA抑制率:MA抑制率=(1-实验组平均MA体积/对照组平均MA体积)×100%[7]。(3) MA中的VEGF、MMP-2、IL-9、IFN-γ浓度检测: 将MA收集于离心管中,1 000 r/min离心5 min,取上清。采用ELISA 法检测MA上清中VEGF、MMP-2、IL-9、IFN-γ浓度。(4) 小鼠生存期观察:记录各组剩下的10只小鼠的死亡时间,从小鼠接种H22细胞开始至小鼠死亡结束。按下列公式计算小鼠生命延长率:生命延长率=(实验组平均生存时间-对照组平均生存时间)/对照组平均生存时间×100%[8]。
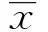
2 结果
2.1 造模结果及生长状态 各组小鼠造模后第6~7天开始腹部逐渐膨隆,提示MA模型造模成功。各组小鼠均出现毛发干燥、脱毛、活动力下降等现象,以空白对照组和阴性对照组明显。与实验组相比,空白对照组和阴性对照组小鼠腹部膨隆较迅速。但各组小鼠体重改变无明显差异。
2.2 各组小鼠MA量 末次用药结束24 h后每组随机处死5只小鼠,抽取MA,测量MA体积,实验组、阴性对照组和空白对照组小鼠的MA体积分别为(6.70±1.52)ml、(10.28±1.75)ml、(10.36±2.30)ml,与空白对照组和阴性对照组相比,实验组小鼠平均MA体积明显减少,差异有统计学意义(P<0.05);空白对照组与阴性对照组相比, MA体积无明显变化 (P>0.05)。与空白对照组相比,实验组的MA抑制率为35.33%。
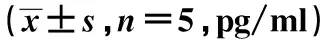


GroupsIL-9VEGFIFN-γMMP-2Experimentalgroup184.77±7.402) 67.74±7.771)2)2173.53±482.891397.07±19.03Negativecontrolgroup420.68±233.4894.16±20.832224.03±470.181414.90±22.00Blankcontrlgroup375.51±143.6790.99±6.40 2380.07±464.941406.02±12.85
Note:Compared with blank control group,1)P<0.05;Compared with negativec control group,2)P<0.05.
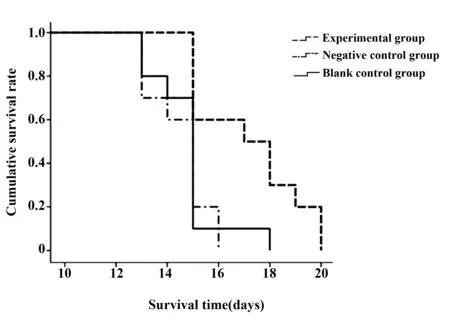
图1 各组小鼠生存时间比较Fig.1 Comparison of survival time among mice with different interventionNote: Mice with IL-9 antibody injection had a longer survival time than mice with IgG or saline injection.
2.3 小鼠MA中VEGF、MMP-2、IL-9、IFN-γ浓度 与空白对照组和阴性对照组比较,实验组小鼠MA中VEGF水平显著降低,差异有统计学意义(P<0.05);与阴性对照组相比,实验组小鼠MA中IL-9水平显著降低,差异有统计学意义(P<0.05);与空白对照组和阴性对照组比较,实验组小鼠MA中MMP-2、IFN-γ浓度减少,但差异无统计学意义(P>0.05)。见表1。
2.4 各组小鼠生存期比较 空白对照组小鼠至造模后第18天全部死亡,阴性对照组小鼠至造模后第16天全部死亡,而实验组小鼠至造模后第20天全部死亡。实验组、阴性对照组、空白对照组小鼠的平均生存时间分别为(17.2±2.10)d、(14.4±1.18)d、(14.8±1.40)d,Log-rank检验显示,实验组小鼠生存时间显著长于阴性对照组和空白对照组,差异有统计学意义(P<0.05)。阴性对照组和空白对照组相比,生存时间无明显变化,差别无统计学意义(P>0.05)。与空白对照组相比,实验组小鼠生存时间延长率为16.2%,提示抗IL-9抗体干预后,小鼠生存时间延长,有较好的效果。见图1。
3 讨论
IL-9是机体重要的免疫因子,可由多种免疫细胞(Th2、Th9、Th17、Treg细胞等)分泌[5]。IL-9与IL-9受体(IL-9R)结合,通过激活JAK/STAT信号通路,启动一系列相关基因转录表达来发挥一系列生物学作用。IL-9具有多种免疫作用,如能促进机体清除寄生虫,增强Treg细胞的免疫抑制功能等[5]。然而,目前有关IL-9在肿瘤方面的研究较少,IL-9与肿瘤的关系还不明确。有研究发现,使用IL-9干预黑色素瘤细胞HTB-72后,可抑制肿瘤细胞的生长[9],而在肺癌的研究中发现IL-9能促进肿瘤细胞的增殖[10]。在IL-9-/-小鼠建立的乳腺癌和大肠癌模型中的研究发现,T细胞对肿瘤的敏感性增高,即小鼠早期就出现肿瘤排斥现象;而使用抗IL-9干预后,野生型小鼠的肿瘤生长出现减慢的现象[11]。我们前期研究也发现MA中IL-9水平较高[6],提示IL-9与MA的发生发展有关,而抗IL-9有可能成为治疗MA的一种可行的方法。
MA的发生机制十分复杂,血管生成和血管渗透性增加被认为是MA生成的两个重要因素,而VEGF、MMP-2、MMP-9、碱性成纤维生长因子(bFGF)等血管活性因子在其中起着重要作用。目前临床上使用的药物也是通过调节肿瘤细胞表面的血管活性因子来抑制肿瘤血管生成,进而减少MA的生成。在使用抗IL-9单抗治疗哮喘疾病的研究中发现,抗IL-9抗体可抑制IL-9的表达,降低肥大细胞的数量和活性,同时减少肺VEGF和成纤维生长因子(FGF)-2的表达[12]。我们应用抗IL-9抗体注射治疗肝纤维小鼠模型,发现使用抗IL-9能显著改善小鼠肝纤维化状态,并能促进其较快的恢复[13]。在体外研究中,我们还发现IL-9干预肝癌细胞可以提高VEGF、MMP的表达,因此本实验中探讨注射抗IL-9对小鼠MA模型疗效的影响及可能机制,结果表明,与未使用抗IL-9注射治疗相比,抗IL-9注射后小鼠的MA生成减少,且MA中的VEGF表达水平下降,提示抗IL-9可以有效地治疗MA,其机制可能是通过降低MA中VEGF表达来实现的。
有研究发现使用抗IL-9抗体中和IL-9后,可以改善实验性自身免疫性脑脊髓炎的症状,这是通过减少Th17细胞数量,降低血清中IL-17、IL-6、IFN-γ和TNF-α表达水平来实现的[14]。既往报道和我们的前期研究均表明,MA中Th9、Th17、Th1等免疫细胞通过分泌效应因子,如IL-9、IL-17、IFN-γ 等来参与MA的生成和发展过程,其中Th9细胞数量增多,提示患者预后较差。本实验在研究抗IL-9抗体对MA中的IL-9、IFN-γ影响时,发现抗IL-9抗体能够降低MA中IL-9的表达水平,IFN-γ表达有所下降,但组间比较IFN-γ的表达水平差异无统计学意义。这提示抗IL-9抗体有可能通过降低MA中IL-9水平来抑制肿瘤的活性,从而延长小鼠的生存时间。本研究中实验组小鼠的生存时间较空白组和阴性对照组延长,但从生存时间的数值上看不是十分明显;结合实验组MA中IL-9虽然显著低于对照组,但检测值仍有(184.77±7.40)pg/ml,考虑生存时间延长不十分明显的其中一个原因是实验中抗IL-9抗体的用量不足,未能完全中和MA中IL-9;其次,MA是肿瘤终末期的表现,在H22腹水瘤模型小鼠造模中接种的肿瘤细胞数目较多,肿瘤细胞增殖快,模型小鼠的肿瘤负荷量大,使得小鼠在短时间内死亡,导致最终实验组生存期虽有所延长,但不十分明显。
综上所述,本研究显示抗IL-9抗体干预肝癌MA模型小鼠后可以有效地减少小鼠MA的产生,改善小鼠的症状,延长其生存时间,其作用机制可能是通过抑制MA中VEGF和IL-9的表达来实现的。
[1] Cavazzoni E,Bugiantella W,Graziosi L,etal.Malignant ascites:pathophysiology and treatment [J].Int J Clin Oncol,2013,18(1):1-9.
[2] Wang Y,Xu RC,Zhang XL,etal.Interleukin-8 secretion by ovarian cancer cells increases anchorage-independent growth,proliferation,angiogenic potential,adhesion and invasion [J].Cytokine,2012,59(1):145-155.
[3] 吴春艳,王 伟,陈 鑫,等.重组人血管内皮抑素治疗小鼠恶性腹腔积液疗效及作用机制研究[J].中国临床药理学与治疗学,2014,19(5):507-511.
[4] Cao X.Regulatory T cells and immune tolerance to tumors [J].Immunol Res,2010,46(1-3):79-93.
[5] Stassen M,Schmitt E,Bopp T.From interleukin-9 to T helper 9 cells [J].Ann N Y Acad Sci,2012,1247:56-68.
[6] Yang XY,Jiang HX,Huang XL,etal.Role of Th9 cells and Th17 cells in the pathogenesis of malignant ascites [J].Asian Pac J Trop Biomed,2015,5(10):772-777.
[7] 时艳艳,岳 麓,齐卫卫,等.消癌平治疗小鼠恶性腹水的实验研究[J].中华肿瘤防治杂志,2011,18(9):655-658.
[8] 刘 宣,柴 妮,韩植芬,等.健脾解毒方对湿热证结肠癌小鼠肿瘤血管新生的抑制作用[J].上海中医药大学学报,2015,29(6):50-54.
[9] Fang Y,Chen X,Bai Q,etal.IL-9 inhibits HTB-72 melanoma cell growth through upregulation of p21 and TRAIL [J].J Surg Oncol,2015,111(8):969-974.
[10] Ye ZJ,Zhou Q,Yin W,etal.Differentiation and immune regulation of IL-9-producing CD4+T cells in malignant pleural effusion [J]. Am J Respir Crit Care Med,2012,186(11):1168-1179.
[11] Hoelzinger DB,Dominguez AL,Cohen PA,etal.Inhibition of adaptive immunity by IL9 can be disrupted to achieve rapid T-cell sensitization and rejection of progressive tumor challenges [J].Cancer Res,2014,74(23):6845-6855.
[12] Oh CK,Raible D,Geba GP,etal.Biology of the interleukin-9 pathway and its therapeutic potential for the treatment of asthma[J].Inflamm Allergy Drug Targets,2011,10(3):180-186.
[13] Qin SY,Lu DH,Guo XY,etal.A deleterious role for Th9/IL-9 in hepatic fibrogenesis [J].Sci Rep,2016,6:18694.
[14] Li H,Nourbakhsh B,Ciric B,etal.Neutralization of IL-9 ameliorates experimental autoimmune encephalomyelitis by decreasing the effector T cell population [J].J Immunol,2010,185(7):4095-4100.
[收稿2016-10-17 修回2016-11-16]
(编辑 倪 鹏)
Effects and mechanism of anti IL-9 antibody on malignant ascites of hepatic carcinoma
ZHANGPei-Ling,LEIRong-E,QINQin-Yi,SHICheng,JIANGHai-Xing,QINShan-Yu.
DepartmentofGastroenterology,theFirstAffiliatedHospitalofGuangxiMedicalUniversity,Nanning530021,China
Objective:To explore the effects and mechanism of anti IL-9 antibody on malignant ascites (MA) of hepatic carcinoma in mice.Methods: A mouse model of MA was established by mouse H22 cell line.45 mice were divided randomly into experimental group,negative control group and blank control group at 24 hours after modeling,with 15 mice in each group.The experimental group was injected intraperitoneally with anti IL-9 antibody;the negative control group was injected with isotype IgG antibody;the blank control group was injected with normal saline.The weight and behavior of the mice were measured before each injection.Five mice of each group was sacrificed at 24 hours after the last injection to measure the volume of MA.The level of VEGF,MMP-2,IL-9 and IFN-γ in MA were determined with ELISA assay;the survival time of rest mice were recorded and compared.Results: The mean volume of MA of experimental group,negative control group and blank control group were (6.70±1.52)ml,(10.28±1.75)ml,(10.36±2.30) ml,respectively,the MA volume of experimental group were lower as compared to negative control group and blank control group(P<0.05).The mean survival time of experimental group was (17.2±2.1)d,which was significantly prolonged compared with the negative control group (14.5±1.2)d and the blank control group (14.8±1.4)d (P<0.05).The levels of VEGF of MA in experimental group was significantly lower compared to the negative control group and blank control group (P<0.05).The levels of IL-9 of MA in experimental group was significantly lower compared to the negative control group(P<0.05).The levels of MMP-2 and IFN-γ in experimental group had no significant difference compared with the negative control group and blank control group (P>0.05).Conclusion: Intraperitoneal injection anti IL-9 antibody on H22 ascites-bearing mice can effectively inhibit the generation of the MA.The mechanism may be related to the inhibition of the expression of the VEGF and IL-9.
Malignant ascites;Anti IL-9 antibody;H22 cell;Hepatic carcinoma
10.3969/j.issn.1000-484X.2017.03.015
①本文受国家自然科学基金(No.31560257;31360221)资助。
张沛玲(1991年-),女,在读硕士,主要从事消化系统疾病发病机制研究。
及指导教师:覃山羽(1973年-),女,博士,教授,主任医师,主要从事消化系统肿瘤疾病发病机制的研究,E-mail:qsy0511@163.com。
R735.7
A
1000-484X(2017)03-0388-04
