水飞蓟宾葡甲胺盐对肝纤维化大鼠的疗效和可能机制①
2017-04-10陈应康佘福强刘大腾朱建超田培燕
陈应康 佘福强 刘大腾 朱建超 刘 燕 田培燕
(黔南民族医学高等专科学校,南州558000)
水飞蓟宾葡甲胺盐对肝纤维化大鼠的疗效和可能机制①
陈应康 佘福强 刘大腾 朱建超 刘 燕 田培燕
(黔南民族医学高等专科学校,南州558000)
目的:考察水飞蓟宾葡甲胺盐对肝纤维化大鼠的疗效和可能机制。方法:将肝纤维化大鼠相随机分为4个组别,即模型组、水飞蓟宾葡甲胺盐高剂量组120 mg/kg、水飞蓟宾葡甲胺盐中剂量组60 mg/kg和水飞蓟宾葡甲胺盐低剂量组30 mg/kg,将同期正常大鼠作为正常对照组,每组10只,连续给药4周。结果:试验全程无死亡大鼠。与正常组比,模型组大鼠体重减少,少动,毛发暗淡,肝脏指数减少(P<0.05),脾脏指数增加(P<0.05),与模型组相比,水飞蓟宾葡甲胺各组体重明显增加(P<0.05),活动较好,毛发色泽有改善,肝脏指数明显增加(P<0.05),脾脏指数明显降低(P<0.05)。与对照组比,模型组的ALT、AST和TBIL增高(P<0.05),ALB降低(P<0.05),与模型组相比,水飞蓟宾葡甲胺各组的ALT、AST和TBIL显著降低(P<0.05),ALB显著增高(P<0.05)。与对照组比,模型组的TG、TC和LDLC增高(P<0.05),与模型组相比,水飞蓟宾葡甲胺各组的TG、TC和LDLC显著降低(P<0.05)。与对照组相比,模型组的LXRα及SREBP1c蛋白显著增高(P>0.05),与模型组相比,水飞蓟宾葡甲胺各组的LXRα及SREBP1c蛋白显著降低(P<0.05)。模型组大鼠的肝小叶消失,中度增生的显微组织将肝小叶分为不同的假小叶,大部分肝细胞明显脂肪变性,点灶状坏死,水飞蓟宾葡甲胺各组的肝组织,肝小叶恢复,肝细胞脂肪变性改善,坏死点灶明显减少。结论:水飞蓟宾葡甲胺盐具有治疗肝纤维化的作用,在改善肝功能和降低血脂方面具有显著优势,与降低肝组织的LXRα和SREBP1c表达有关,但降低上述两种蛋白的机理仍有待进一步考察。
水飞蓟宾葡甲胺盐;肝纤维化;肝功能;血脂;肝组织蛋白
水飞蓟素(Silybum marianum)是世界级公认的保肝药物,在急慢性肝炎、肝硬化和中毒性肝损伤中均有应用,具有保护肝细胞膜和改善肝功能的作用。水飞蓟素在结构上属黄酮类天然混合物,是经菊科植物水飞蓟(Silibum marianum gaertn)果实提取得到,水飞蓟宾是水飞蓟素发挥药效的主要成分,但水飞蓟宾不溶于水,且脂溶性不高,因此口服吸收差,在其结构的羟基位置引入极性基团,可提高水溶性[1-3],水飞蓟宾葡甲胺盐(Silibinin-N-methylglucamine)就是个水飞蓟宾衍生物的成功案例,水飞蓟宾葡甲胺盐因其良好的水溶性,已被制成片剂和胶囊,临床广泛使用。肝纤维化(Hepatic fibrosis,HF)是多种慢性肝病的病理学发展到肝硬化的关键过度阶段,其预后备受关注,也是近年来肝病研究的重点[4-6]。水飞蓟宾葡甲胺盐在治疗肝硬化方面具有确切的效果,但近些年对其可能机制研究较少,少有的研究涉及指标也并不系统,肝脏肝X受体α(Liver X receptor-α,LXRα)和醇调节元件结合蛋白1c(Steml regulatory element-binding protein-1c,SREBP1c)是肝纤维化的重要指标。本课题拟采用纤维化大鼠为受试对象,考察水飞蓟宾葡甲胺盐对纤维化大鼠在肝功能、血脂和肝组织LXRα和SREBP1c蛋白表达的影响,为临床应用水飞蓟宾葡甲胺盐提供参考。
1 材料与方法
1.1 材料
1.1.1 受试动物 清洁级(SPF级)SD大鼠,全雄性,体重180~220 g,购自重庆市中药研究院实验动物研究所,合格证号:SCXK(渝)。12 h白天日光灯照射,自由饮食饮水。
1.1.2 受试试剂和药物 二甲基亚硝胺(DMN)市试剂厂。丙氨酸氨基转移酶(Alanine aminotransaminase,ALT)、白蛋白(Albumin,ALB)、总胆红素(Total bilirubin,TBIL)、血清甘油三酯(Triglyceride,TG)和胆固醇(Total cholesterol,TC) 试剂盒购自南京建成生物工程研究所。水飞蓟宾葡甲胺盐,国药准字H32026145,批号:20150101,规格:50 mg/片,江苏中兴药业有限公司生产。
1.2 方法
1.2.1 肝纤维化大鼠制备 采用二甲基亚硝胺以10 μg/kg的剂量腹腔注射,1次/d,连续4周。
1.2.2 分组与给药 将肝纤维化大鼠随机分为4个组别,即模型组,水飞蓟宾葡甲胺盐高剂量组120 mg/kg、水飞蓟宾葡甲胺盐中剂量组60 mg/kg和水飞蓟宾葡甲胺盐低剂量组30 mg/kg,将同期正常大鼠作为正常对照组,每组10只,连续给药4周。
1.2.3 指标检测
1.2.3.1 肝功能检测 试验结束后,处死大鼠,取腹主动脉血,离心取血清,采用全自动生化仪,按试剂盒的要求检测血清中的ALT、ALB和TBIL水平。
1.2.3.2 血脂水平检测 取血清,采用全自动生化仪,按试剂盒的要求检测血清中的TC、TG和LDLC水平。
1.2.4 肝脏LXRα和SREBP1c表达检测及肝病理
1.2.4.1 LXRα和SREBP1c表达肝总蛋白提取 处死大鼠,取肝脏,称重,按照 1∶10加 RIPA 裂解液,冰浴超声碾碎呈匀浆状,10 000 r/min离心10 min,收上清。BCA 法测定总蛋白,根据蛋白标准曲线,定量所提取肝蛋白。
1.2.4.2 BCA法测定总蛋白 Western blot分析小鼠肝脏组织蛋白表达:根据文献提示[7],将肝总蛋白20 μg 加 5×上样缓冲液,100℃沸水变性,采用SDS-聚丙烯酰胺凝胶电泳,进行凝胶电泳,拨胶,转膜,将转膜后的 PVDF膜放入杂交袋,加入 TBST 稀释的一抗LXRα(1∶1 000)、SREBP1c (1∶1 000) 和β-actin (1∶5 000),封口,室温孵育 1 h,4℃孵育过夜。TBST洗一抗3 次,将 PVDF膜放入杂交袋,加二抗,室温孵育 1 h,TBST洗二抗3 次,显影。蛋白条带利用 β-actin 标准化,采用美国 Kodak Image Station 4000R 凝胶成像系统显影分析。
1.2.5 肝组织HE染色 试验结束后,处死大鼠,分离肝,中性甲醛缓冲液固定、包埋、切片、脱水、透明和HE染色。
2 结果
2.1 水飞蓟宾葡甲胺盐对肝纤维化大鼠生存状态的影响 试验全程无死亡大鼠。与正常组比,模型组大鼠体重减少,少动,毛发暗淡,肝脏指数减少(P<0.05),脾脏指数增加(P<0.05),与模型组比,水飞蓟宾葡甲胺各组体重明显增加(P<0.05),活动较好,毛发色泽有改善,肝脏指数明显增加(P<0.05),脾脏指数明显降低(P<0.05),且呈剂量依赖性关系,见表1、2。
表1 水飞蓟宾葡甲胺盐对肝纤维化大鼠体重的影响
Tab.1 Effect of Silybinin meglumine on body weight of hepatic fibrosis rats
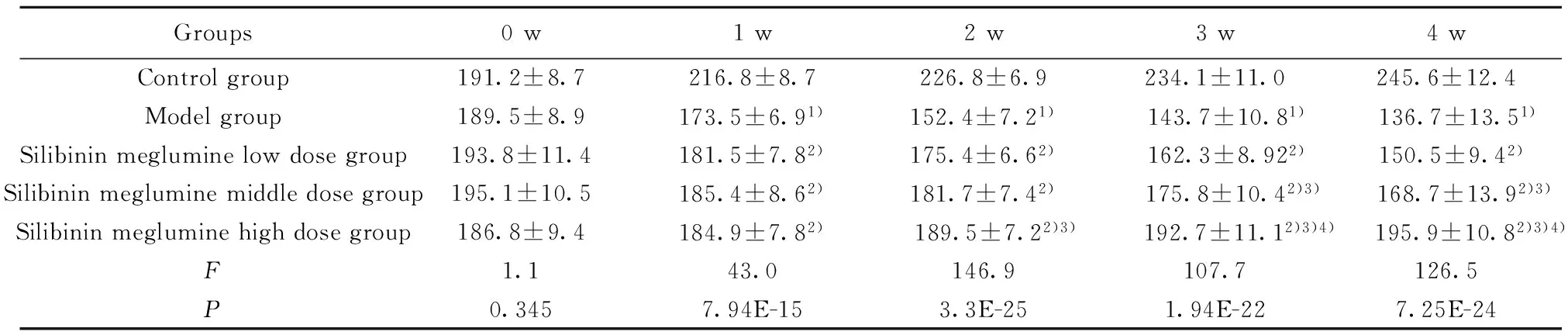
Groups0w1w2w3w4wControlgroup191.2±8.7216.8±8.7226.8±6.9234.1±11.0245.6±12.4Modelgroup189.5±8.9173.5±6.91)152.4±7.21) 143.7±10.81) 136.7±13.51)Silibininmegluminelowdosegroup193.8±11.4181.5±7.82)175.4±6.62) 162.3±8.922)150.5±9.42)Silibininmegluminemiddledosegroup195.1±10.5185.4±8.62)181.7±7.42) 175.8±10.42)3) 168.7±13.92)3)Silibininmegluminehighdosegroup186.8±9.4184.9±7.82) 189.5±7.22)3) 192.7±11.12)3)4) 195.9±10.82)3)4)F1.143.0146.9107.7126.5P0.3457.94E-153.3E-251.94E-227.25E-24
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05;compared with low dose Silybinin meglumine,3)P<0.05;compared with middle dose Silybinin meglumine,4)P<0.05.
2.2 水飞蓟宾葡甲胺盐对肝纤维化大鼠肝功能的影响 与对照组相比,模型组的ALT、AST和TBIL增高(P<0.05),ALB降低(P<0.05),与模型组相比,水飞蓟宾葡甲胺各组的ALT、AST和TBIL显著降低(P<0.05),ALB显著增高(P<0.05),且呈剂量依赖性关系(P<0.05),见表3。
表2 水飞蓟宾葡甲胺盐对肝纤维化大鼠肝脾系数的影响
Tab.2 Effect of Silybinin meglumine on liver and spleen indexes of hepatic fibrosis rats
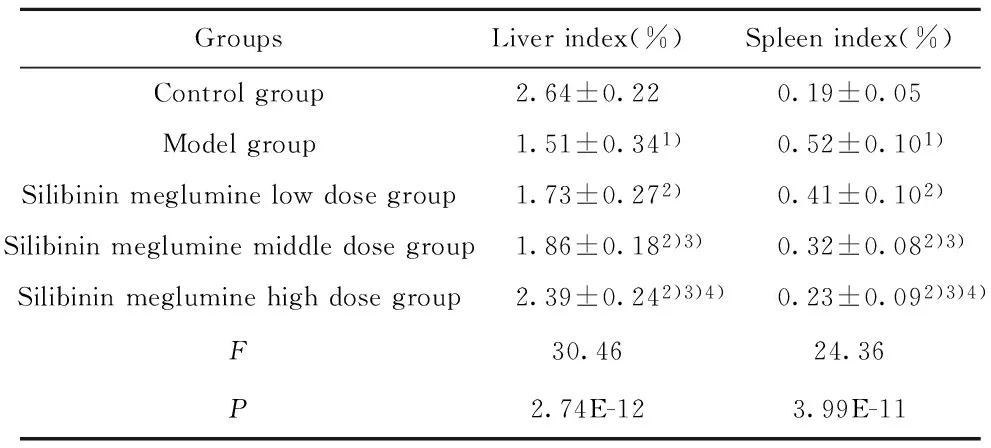
GroupsLiverindex(%)Spleenindex(%)Controlgroup2.64±0.220.19±0.05Modelgroup1.51±0.341)0.52±0.101)Silibininmegluminelowdosegroup1.73±0.272)0.41±0.102)Silibininmegluminemiddledosegroup1.86±0.182)3)0.32±0.082)3)Silibininmegluminehighdosegroup2.39±0.242)3)4)0.23±0.092)3)4)F30.4624.36P2.74E-123.99E-11
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05;compared with low dose Silybinin meglumine,3)P<0.05;compared with middle dose Silybinin meglumine,4)P<0.05.
2.3 水飞蓟宾葡甲胺盐对肝纤维化大鼠血脂的影响 与对照组相比,模型组的TG、TC和LDLC增高(P<0.05),与模型组相比,水飞蓟宾葡甲胺各组的TG、TC和LDLC显著降低(P<0.05),且呈剂量依赖性关系(P<0.05),见表4。
2.4 水飞蓟宾葡甲胺盐对肝纤维化大鼠肝组织的LXRα及SREBP1c蛋白表达的影响 与对照组相比,模型组的LXRα及SREBP1c蛋白显著增高(P>0.05),与模型组相比,水飞蓟宾葡甲胺各组的LXRα及SREBP1c蛋白显著降低(P<0.05),且呈剂量依赖性关系(P<0.05),见图1。
2.5 水飞蓟宾葡甲胺盐对肝纤维化大鼠肝HE染色的影响 模型组大鼠的肝小叶消失,中度增生的显微组织将肝小叶分为不同的假小叶,大部分肝细胞明显脂肪变性,点灶状坏死,水飞蓟宾葡甲胺各组的肝组织,肝小叶恢复,肝细胞脂肪变性改善,坏死点灶明显减少,呈剂量依赖性关系,见图2。
表3 水飞蓟宾葡甲胺盐对肝纤维化大鼠肝功能的影响
Tab.3 Effect of Silybinin meglumine on liver function of hepatic fibrosis rats
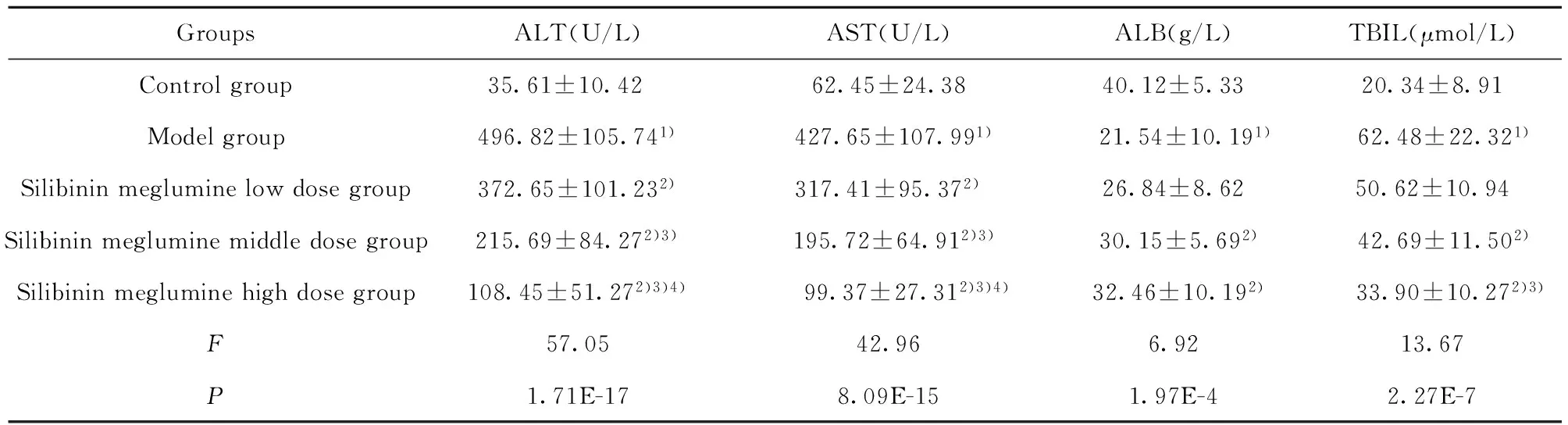
GroupsALT(U/L)AST(U/L)ALB(g/L)TBIL(μmol/L)Controlgroup35.61±10.42 62.45±24.3840.12±5.3320.34±8.91Modelgroup496.82±105.741)427.65±107.991) 21.54±10.191) 62.48±22.321)Silibininmegluminelowdosegroup372.65±101.232)317.41±95.372)26.84±8.6250.62±10.94Silibininmegluminemiddledosegroup215.69±84.272)3)195.72±64.912)3)30.15±5.692) 42.69±11.502)Silibininmegluminehighdosegroup108.45±51.272)3)4) 99.37±27.312)3)4)32.46±10.192) 33.90±10.272)3)F57.0542.966.9213.67P1.71E-178.09E-151.97E-42.27E-7
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05;compared with low dose Silybinin meglumine,3)P<0.05;compared with middle dose Silybinin meglumine,4)P<0.05.
表4 水飞蓟宾葡甲胺盐对肝纤维化大鼠血脂的影响
Tab.4 Effect of Silybinin meglumine on blood lipid of hepatic fibrosis rats
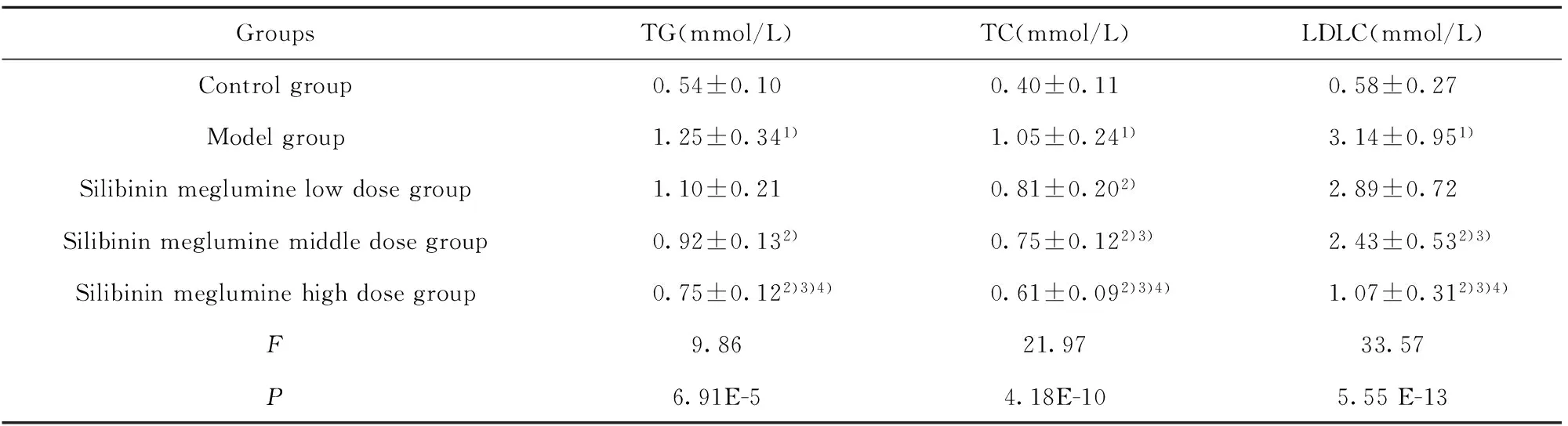
GroupsTG(mmol/L)TC(mmol/L)LDLC(mmol/L)Controlgroup0.54±0.100.40±0.110.58±0.27Modelgroup1.25±0.341)1.05±0.241)3.14±0.951)Silibininmegluminelowdosegroup1.10±0.210.81±0.202)2.89±0.72Silibininmegluminemiddledosegroup0.92±0.132)0.75±0.122)3)2.43±0.532)3)Silibininmegluminehighdosegroup0.75±0.122)3)4)0.61±0.092)3)4)1.07±0.312)3)4)F9.8621.9733.57P6.91E-54.18E-105.55E-13
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05;compared with low dose Silybinin meglumine,3)P<0.05;compared with middle dose Silybinin meglumine,4)P<0.05.
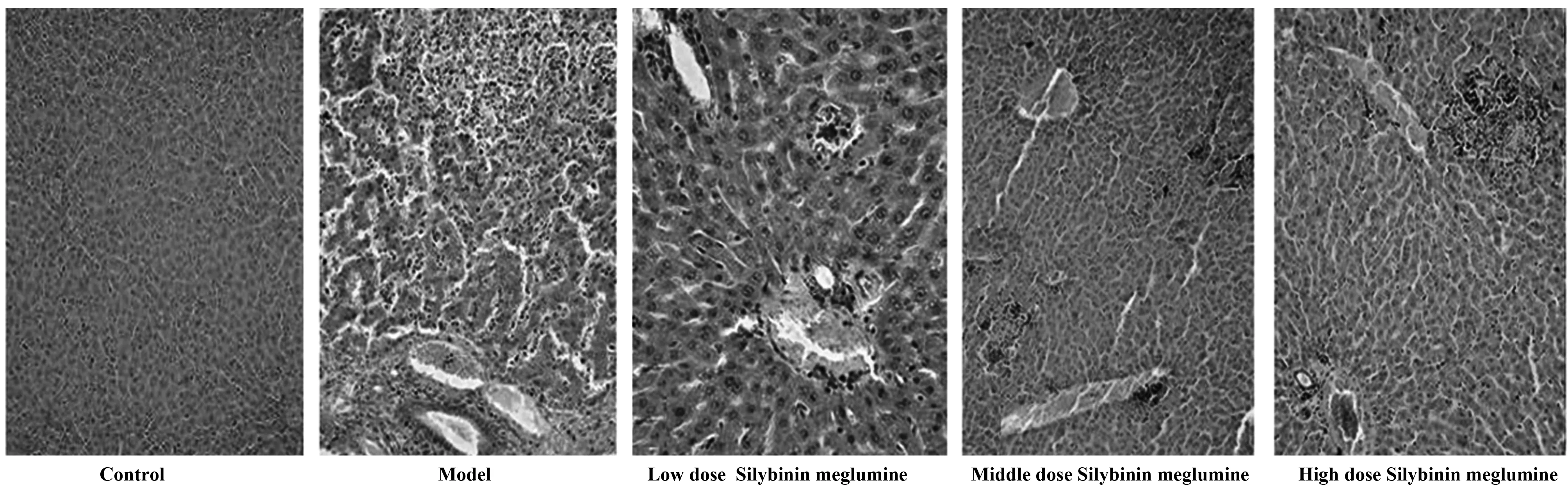
图2 水飞蓟宾葡甲胺盐对肝纤维化大鼠肝HE染色的影响(×200)Fig.2 Effect of Silybinin meglumine on liver pathology of hepatic fibrosis rats(×200)
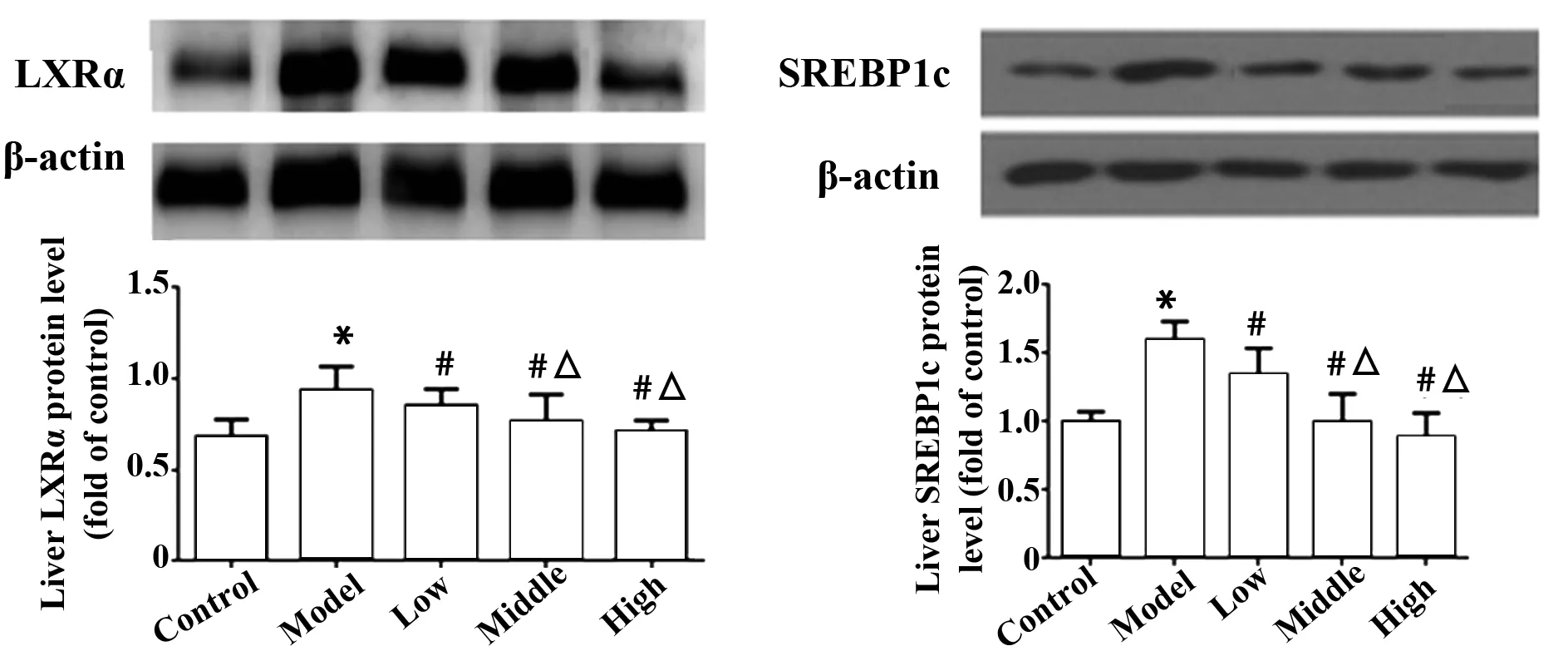
图1 水飞蓟宾葡甲胺盐对肝纤维化大鼠肝组织的LXRα及SREBP1c蛋白表达的影响Fig.1 Effect of Silybinin meglumine on LXRα and SREBP1c expression in liver tissue of hepatic fibrosis ratsNote: Compared with control group,*.P<0.05;compared with model group,#.P<0.05;compared with low dose Silybinin meglumine,△.P<0.05.
3 讨论
LXRα在肝脏有表达,与肝脏的甘油三酯(TG)合成、脂肪形成和炎症因子调节密切相关,给予高胆固醇喂食的LXRα-/-小鼠的肝组织显微可见大量胆固醇,可见LXRα与肝纤维化发生发展紧密相连,随着肝纤维化病变加重,LXRα表达也显著增多[8-10],同时LXRα过表达可与LXRα的配体类视黄醇 X 受体结合成异二聚体,激活成脂基因SREBP-1c过量表达,SREBP1c作为脂肪合成相关基因转录的决定子,调节脂肪代谢相关酶如脂肪合成酶、3-磷酸甘油酞基转移酶等基因表达来调控体内的脂肪合成,参与肝脏TG合成,但SREBP1c表达一般不会受正常饮食干扰,LXRα与SREBP1c共同过量表达可加速肝脏生成大量脂肪酸,引起肝细胞脂肪变性,进一步加重肝纤维化,这也就解释了肝纤维化大鼠外周血的血脂增高、肝功能降低及显微的脂质病理变化,体外试验显示,抑制SREBP1c表达可限制下调脂质合成基因表达,因此SREBP1c表达调控是治疗肝纤维化的新药靶向参考[11-13]。给予水飞蓟宾葡甲胺盐后,肝组织的LXRα与SREBP1c表达明显降低,呈剂量依赖性关系,提示水飞蓟宾葡甲胺盐可能通过阻断或降低LXRα与SREBP1c的过表达,进而抑制脂肪酸与TG合成,减少肝细胞的脂肪水平,改善血脂紊乱,延缓肝纤维化进程,达到保肝的作用。对于水飞蓟宾葡甲胺盐与LXRα与SREBP1c表达的关联度鲜有文献报道,体外试验甚至获得了相反的结论,如高糖环境下水飞蓟宾可显著上调Insig-1和SREBP1c蛋白表达,Insig-1和SREBP1c两者表达呈正相关关系,但笔者认为该结果的可信度因水飞蓟宾的水不溶性和脂不溶性的理化性质而倍受质疑。因此该课题可能在发掘水飞蓟宾葡甲胺盐对于肝纤维化的作用靶点方面有了突破性进展。另一方面,从水飞蓟宾葡甲胺盐具有阻断或降低SREBP1c过表达的作用来看,因高胰岛素血症可延迟SREBP1c前体剪切加工,因此高胰岛素血症患者也呈现SREBP1c高表达,这一点也提示水飞蓟宾葡甲胺盐可能对高胰岛素血症具有辅助治疗作用。
综上所述,水飞蓟宾葡甲胺盐具有治疗肝纤维化的作用,在改善肝功能和降低血脂方面具有显著优势,与降低肝组织的LXRα和SREBP1c表达有关,但降低上述两种蛋白的机理仍有待进一步考察。
[1] Kim SH,Kim KY,Yu SN,etal.Autophagy inhibition enhances silibinin-induced apoptosis by regulating reactive oxygen species production in human prostate cancer PC-3 cells[J].Biochem Biophys Res Commun,2015,468(1-2):151-156.
[2] 李青权,周 强,牛俊奇,等.水飞蓟素药理机制新进展及临床价值再探讨[J].临床肝胆病杂志,2015,31(2):315-317.
[3] Cufí S, Bonavia R, Vazquez-Martin A, et al. Silibinin meglumine, a water-soluble form of milk thistle silymarin, is an orally active anti-cancer agent that impedes the epithelial-to-mesenchymal transition (EMT) in EGFR-mutant non-small-cell lung carcinoma cells[J].Food Chem Toxicol,2013,60(10):360-368.
[4] Johannes J,Jayarama-Naidu R,Meyer F,etal.Silychristin,a flavonolignan derived from the milk thistle,is a potent inhibitor of the thyroid hormone transporter MCT8[J].Endocrinology,2016,157(4):1694-1701.
[5] Gufford BT,Barr JT,González-Pérez V,etal.Quantitative prediction and clinical evaluation of an unexplored herb-drug interaction mechanism in healthy volunteers[J].CPT Pharmacometrics Syst Pharmacol,2015,4(12):701-710.
[6] Rosso N,Marin V,Giordani A,etal.The pros and the cons for the use of silybin-rich oral formulations in treatment of liver damage (NAFLD in Particular)[J].Curr Med Chem,2015,22(25):2954-2971.
[7] Oppi-Williams C, Suagee JK, Corl BA.Regulation of lipid synthesis by liver X receptor α and sterol regulatory element-binding protein 1 in mammary epithelial cells[J].J Dairy Sci,2013,96(1):112-121.
[8] Ding H,Li Y,Feng Y,etal.LXR agonist T0901317 upregulates thrombomodulin expression in glomerular endothelial cells by inhibition of nuclear factor κB[J].Mol Med Rep,2016,13(6):4888-4896.
[9] Zhang DQ,Sun P,Jin Q,etal.Resveratrol regulates activated hepatic stellate cells by modulating NF-κB and the PI3K/Akt signaling pathway[J].J Food Sci,2016,81(1):H240-H245.
[10] Ann JY,Eo H,Lim Y.Mulberry leaves (Morus alba L.) ameliorate obesity-induced hepatic lipogenesis,fibrosis,and oxidative stress in high-fat diet-fed mice[J].Genes Nutr,2015,10(6):46.
[11] Urushima H,Sanada Y,Sakaue M.Maltitol prevents the progression of fatty liver degeneration in mice fed high-fat diets[J].J Med Food,2015,18(10):1081-1087.
[12] Liu G,Zhang Y,Liu C,etal.Luteolin alleviates alcoholic liver disease induced by chronic and binge ethanol feeding in mice[J].J Nutr,2014,144(7):1009-1015.
[13] Krawczyk M,Grünhage F,Lammert F.Identification of combined genetic determinants of liver stiffness within the SREBP1c-PNPLA3 pathway[J].Int J Mol Sci,2013,14(10):21153-21166.
[14] 徐 君,莫朝晖.水飞蓟宾保护胰岛β细胞的作用及机制[J].中国临床药理学与治疗学,2013,18(04):476-480.
[收稿2016-04-26 修回2016-06-22]
(编辑 倪 鹏)
Efficacy of Silybinin meglumine on hepatic fibrosis rats and possible mechanisms
CHENYing-Kang,SHEFu-Qiang,LIUDa-Teng,ZHUJian-Chao,LIUYan,TIANPei-Yan.
QiannanMedicalCollegeforNationalities,Nanzhou558000,China
Objective:To investigate the efficacy of Silybinin meglumine on hepatic fibrosis rats and possible mecha-nisms.Methods: The liver fibrosis rats were randomly divided into 4 groups,the model group,Silybinin meglumine 120 mg/kg group,Silybinin meglumine dose group 60 mg/kg and Silybinin meglumine low dose group 30 mg/kg,and the control group.All groups had been treated for 4 groups.Results: No deaths rat.Compared with the control group,the reduced body weight,less dynamic,dark hair,decreased liver and spleen indexes,increased ALT,AST,TBIL,TG,TC and LDLC,and the decreased ALB, and the increased LXRα and SREBP1c had been observed in the model group(P<0.05).Compared with the model group,better activity and body weight,the increased liver and spleen indexs decreased ALT,AST,TBIL,TG,TC and LDLC,and the increased ALB, and the decreased LXRα and SREBP1c had been observed in the Silybinin meglumine groups(P<0.05),in a way of dose-depended.Conclusion: The Silibinin meglumine can treat liver fibrosis,by improving liver function,lowing lipid and decreaseing LXRα and SREBP1c expression in liver tissue.But the mechanism of two proteins reduced remains for further investigation.
Silibinin meglumine;Liver fibrosis;Hepatic function;Lipids;Liver tissue protein
10.3969/j.issn.1000-484X.2017.03.009
①本文为黔南民族医学高等专科学校科研基金项目(No.QNYZ 2013字2号)。
陈应康(1970年-),男,副教授,主要从事病理毒理学方面研究,E-mail:ccyykk_144@163.com。
R285.5
A
1000-484X(2017)03-0360-05
