miR-122a抑制人喉癌细胞株Hep2细胞增殖的研究
2017-04-10陈云华于亚峰
陈云华 于亚峰
(常熟市第二人民医院耳鼻咽喉科,常熟215500)
miR-122a抑制人喉癌细胞株Hep2细胞增殖的研究
陈云华 于亚峰①
(常熟市第二人民医院耳鼻咽喉科,常熟215500)
目的:研究miR-122a对人喉癌细胞株Hep2细胞增殖、细胞周期以及相关蛋白表达量的影响。方法:人喉癌细胞株Hep2细胞分别转染miR-122a寡聚核苷酸(A组)和miR-122a inhibitor(阻遏物)(B组),同时设立阻遏物阴性对照( inhibitor negative control,miR-NC inhibitor)(C组)和空白对照(D组)。用RT-PCR、MTT法、流式细胞仪和Western blot技术评价各组细胞增殖和细胞周期的生物学特征。结果:转染miR-122a寡聚核苷酸后,Hep2细胞中miR-122a表达显著增加。同D组相比,A组细胞增殖水平明显受到抑制,miR-122a寡聚核苷酸能够有效诱导Hep-2细胞周期阻滞在G1/G0期,A组细胞分裂周期蛋白42表达水平明显下调,细胞周期调控因子蛋白CDK4及细胞周期素D1蛋白表达水平明显降低。结论:miR-122a寡聚核苷酸能够显著抑制喉癌细胞Hep2的增殖,miR-122a是潜在的人喉癌细胞基因治疗的候选靶点。
喉肿瘤;miR-122a;细胞周期;Hep2细胞
喉癌作为头颈部常见的恶性肿瘤之一,现阶段常用的治疗手段主要包括两种,放疗后全喉切除或者是直接手术治疗。但是这两种治疗的方式影响了患者的术后喉功能和生活质量[1,2]。因而需要研发新的治疗策略,微小RNA(miRNAs,miRNA)分子治疗因其对机体损伤较小的优势成为相关肿瘤的新治疗模式。微小RNA是非编码小RNA,大小为20~25个核苷酸(nucleotide,nt)。最近相关研究表明,miRNA能够在细胞功能调控方面发挥巨大作用,同肿瘤的发生和发展密切相关,例如,在肿瘤中某些miRNA呈特异性表达,表现出促癌或者抑癌的作用[3]。借助芯片技术的巨大优势,依托常熟市第二人民医院和苏州大学附属第一医院大量的人喉癌标本组织,美国LC Sciences公司提供通过测定分析正常人喉组织和人类喉癌细胞系中miRNA表达谱,研究结论发现多种人喉癌中表达特异性的miRNA(见表1)。miR-122a作为一个有代表性的miRNA,是抑癌性微小RNA,近期的研究结果证实miR-122a在许多肿瘤组织中表达量较低[4],这其中就包括喉癌。本研究通过转染人喉癌细胞,增加miR-122a在喉癌细胞中的表达量,观察其对人喉癌瘤细胞周期相关蛋白表达量以及其增殖的影响,从而探究miR-122a对喉癌细胞生长增殖的生物学特征影响。本文旨在研究喉癌发生发展中miR-122a对喉癌的影响作用机制,最后能够为miR-122a作为喉癌诊断以及治疗靶点提供合理的理论依据。
1 材料与方法
1.1 材料 通过miRNAs目标靶基因数据库(http://www.mirbase.org/)查询获得miR-122a基因序列,并且委托华大基因公司设计合成;胎牛血清由杭州四季青生物工程材料有限公司提供,1640培养基由美国Hyclone提供,Lipofectamine 2000转染试剂由美国Invitrogen 公司提供,寡聚核苷酸由上海华大基因科技有限公司提供,TaqMan microRNA反转录试剂盒由宝生物工程(大连)有限公司提供,PVDF 膜为美国伯乐Bio-Rad,ECL发光液显影液由美国赛默飞公司提供,细胞周期蛋白一抗CDC42、CDK4和Cyclin D由武汉博士德生物工程有限公司提供。主要仪器:MK3多功能酶标仪由美国赛默飞公司提供,FACSCanto流式细胞仪由美国BD公司提供,上海天能Tanon 3500凝胶成像系统由河南博奥诚恒科贸有限公司提供,Image J软件由美国国立卫生研究院提供。
1.2 方法
1.2.1 Hep2细胞培养和转染 将Hep2细胞分为A组(转染miR-122a寡聚核苷酸组)、B组(miR-122a inhibitor),C组(miR-122a-NC inhibitor)和D组(空白对照组)。在37℃、5%CO2孵箱中,细胞培养在含10%新生胎牛血清的1640培养基中,待细胞生长到对数生长期时进行测量。将调整后的Hep2细胞(1×106ml-1)接种到12孔培养板中,正常培养24 h,融合细胞在50%~60%时。转染试剂和寡聚核苷酸按照说明书进行1∶1混合,混匀后孵育15 min,接种到12孔板中,然后继续培养6 h,换完生长液后连续培养24 h。然后重复转染1次,不作处理的组为空白对照组。
1.2.2 miR-122a的表达检测 转染Hep2细胞2 d后,利用细胞刮刀收集细胞。将提取的总miRNA溶入无RNA酶的双蒸水中,用来检测miRNA的质量和浓度。利用TaqMan microRNA反转录试剂盒进行反转录,加入反义miRNA或内参U6引物扩增。在扩增反应结束以后,分析PCR反应曲线,最后得到Ct值。PCR反应完成后,利用ABI 7300System SDS软件分析,记录分析与之相应的Ct值,利用2-ΔΔCt方法计算基因相对表达量。
1.2.3 MTT法检测Hep2细胞增殖 Hep2细胞转染48 h后,用胰酶消化后经PBS冲洗,收集细胞。进行细胞计数以后,以浓度2×104个/100 μl分装到96孔培养板中,做6个复孔。在37℃、5%CO2培养条件下,每孔加入5 μl的MTT溶液培养,到达检测点(24、48、72 h)时弃去培养液,每孔加入150 μl二甲基亚砜,轻轻振动10 min,在550nm波长处,利用多功能酶标仪,检测各孔的吸光度值。
1.2.4 利用流式细胞术检测肿瘤细胞的周期 肿瘤细胞被转染48 h以后,通过胰酶消化后收集肿瘤细胞,加入PBS混匀,1 500 r/min离心 5 min,重复洗1次。最后分别加入PI及RNase A,利用流式细胞仪检测Hep2肿瘤细胞的周期状况。
1.2.5 周期相关蛋白表达的检测 经寡聚核苷酸转染48 h后的四组肿瘤细胞提取总蛋白,以利用传统的BCA蛋白定量法进行蛋白定量。对应的SDS-PAGE(12%)凝胶电泳分离蛋白质(40 μg)。湿转至PVDF膜,脱脂奶粉37℃封闭1 h,在4℃下,细胞周期蛋白一抗CDC42、CDK4和Cyclin D孵育过夜,HRP标记的二抗孵育1.5 h后。利用ECL发光液显影和凝胶成像仪成像。利用Image J软件分别测量四组电泳条带的灰度值。获得各实验组相对灰度值(不同处理组灰度值除以空白对照组),从而判断CDC42蛋白相对的表达情况,GAPDH作为内对照。
表1 正常人喉组织和人类喉癌细胞系miRNA表达谱
Tab.1 miRNA differentially expressed profile between normal laryngeal tissue and human laryngeal carcinoma cell line

miRNAProportionNormallaryngealtissueMinimumMaximumAverageHumanlaryngealcarcinomacelllineMinimumMaximumAveragemiR-1005.013195.536367.894564.5812229.7630860.3422039.98miR-106b4.51590.813166.841591.572574.777172.735481.94miR-122a0.029159.7516700.512816.97112.31345.56228.94miR-127-3P6.61586.641235.18905.143406.868928.986137.62miR-175.793077.46936.94438.1514540.138039.8825196.79miR-2181.011631.4116004.838929.611000.0217231.129018.91miR-29c0.26947.255562.42570.93164.321269.59632.47
Note:The results ofP<0.01 in table were obtained byttest of indepo samples,and the proportion were between human laryngeal carcinoma cell line and normal human laryngeal tissue.

2 结果
2.1 miRNA微阵列芯片表达谱分析结果 微阵列芯片杂交结果显示,miR-122a的表达降低最明显,见表1。
2.2 Hep2细胞中miR-122a的表达检测结果 Hep2细胞被转染miR-122a寡聚核苷酸48 h以后,miR-122a相对表达量分别为:D组(51.49±0.31),C
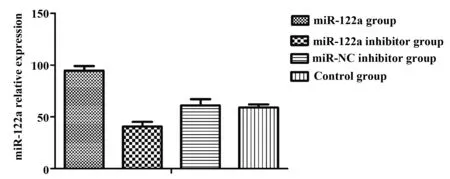
图1 转染miR-122a后,Hep2细胞中miR-122a表达水平明显上调Fig.1 MiR-122a expression levels significantly increased in Hep2 cells after transfected miR-122a

图2 转染miR-122a后不同时间MTT法检测Hep2细胞生长情况Fig.2 MTT assay Hep2 cells growth at different times after transfected miR-122a
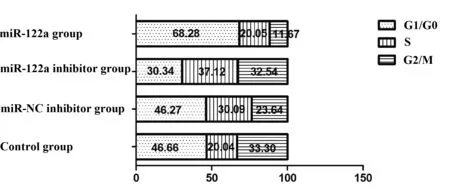
图3 miR-122a诱导Hep2细胞周期阻滞在G1/G0期Fig.3 miR-122a induced Hep2 cell cycle arrest in G1/ G0 phase
组(53.58±0.68),B组(43.36±0.64),A组(96.13±1.12)。经单因素方差分析,4组整体差异显著(F=1 905.178,P=0.000),两两比较发现:与D组相比,A组细胞中miR-122a表达水平明显上调,差异具有统计学意义(LSD-t=52.493,P=0.000),见图1。
2.3 MTT法检测Hep2肿瘤细胞的增殖情况 Hep2细胞被miR-122a寡聚核苷酸转染以后,利用MTT法分别在24、48、72 h后肿瘤细胞相对存活率如图2所示。在24 h后不同时间段内,A组的相对存活率显著低于B、C和D组 (均P<0.05),见图2。
2.4 肿瘤细胞周期的检测 miR-122a寡聚核苷酸转染Hep2肿瘤细胞48 h,A组细胞G1/G0期达68.28%,明显高于B组(30.34%),C组(46.27%)和D组(46.66%),具有差异统计学意义(P<0.05)。结果表明miR-122a寡聚核苷酸能够有效诱导Hep2细胞周期阻滞在G1/G0期。见图3、4。
2.5 Western blot检测CDC42及细胞周期相关蛋白的表达 转染miR-122a寡聚核苷酸的Hep2细胞48 h后,A组CDC42蛋白表达量B组和D组相比,其表达量明显减少(P<0.05),表明Hep2细胞在被miR-122a寡聚核苷酸转染后CDC42蛋白表达水平降低,同miR-122a呈负相关。而且同C组相比,CDK4以及Cyclin D1蛋白表达水平也是明显减少,见图5。
图4 转染miR-122a Hep2细胞周期图Fig.4 Transfected with miR-122a in Hep2 cell cycle
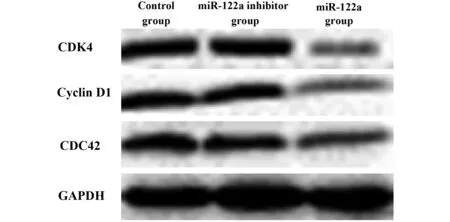
图5 各组CDK4、Cylin D1及CDC42蛋白表达水平Fig.5 CDK4,Cyclin D1 protein levels and CDC42 in groups
3 讨论
miRNAs作为一类内源性非编码的小RNA分子,近期科研结果显示miRNA与人类多种肿瘤的形成与发展密切关联。miR-122a作为广泛存在的且在人类正常细胞中发现较早的miRNA,其中重要的特点是miR-122a在多种肿瘤组织中呈低表达的状态。当今热点之一是探讨miRNA在肿瘤发生和发展中的功能。现阶段miRNA的发现为研究基因的表达调控提供了另一种研究思路[5]。
喉癌其本质上是因为其多基因异常而发生的恶性疾病[6]。miR-122a与喉癌细胞相关周期蛋白的表达目前国内外尚没有相关报道。本次研究通过转染miR-122a寡聚核苷酸的方式,使Hep2细胞内的miR-122a表达量升高,通过RT-PCR法检测其表达数量后,研究结果与空白组相比,转染寡聚核苷酸组的喉癌细胞中miR-122a表达量明显增多,并且进一步研究发现,通过MTT法检测喉癌细胞增殖,转染寡聚核苷酸组喉癌细胞的相对存活率随着时间的相对延长,抑制效应增强,并且明显降低。另外细胞周期实验结果显示,寡聚核苷酸miR-122a能有将肿瘤细胞阻滞在G1/G0期。本研究表明,miR-122a同抑制喉癌细胞的增殖密切相关。因此本次研究推测miR-122a可能在喉癌的发生过程中起着非常重要的抑制作用。
研究表明,细胞周期中的G1期是启动细胞周期循环的重要时期。其中的CDK4/Cyclin D1是G1期向S期转换的重要的周期蛋白[7]。Western blot的研究结果显示CDK4/Cyclin D1表达相对于对照组和无义序列组显著减少,此结果表明G1期向S期转换受到明显的抑制作用。CDC42具有GTP酶活性,定位于人染色体1p36.1[8,9]。当前研究发现CDC42在乳腺癌等多种肿瘤中具有较高的表达量,参与肿瘤细胞增殖、凋亡、周期等有关的许多过程[10,11]。Gao等[12]研究miR-137在HCC肝癌细胞中表达增高,能够调控CDC42,诱导肝癌细胞周期阻滞在G1/G0期,从而抑制其增殖。本实验研究发现miR-122a寡聚核苷酸能够显著下调CDC42蛋白和CDK4和Cyclin D1水平表达,表明CDC42、CDK4和Cyclin D1可能是miR-122a的下游靶基因,miR-122a通过调控 CDC42、CDK4和Cyclin D1抑制Hep2细胞增殖。我们将进一步研究人喉癌细胞生长过程中miR-122a对Cyclin D1、CDC42和CDK4的调控作用。
总之,体外实验研究结果显示,被转染miR-122a寡聚核苷酸后的Hep2细胞,miR-122a表达量增高明显。因此我们推测miR-122a通过调节CDC42蛋白的表达,进而影响Hep2喉癌细胞的细胞周期和增殖能力。miR-122a能够作为潜在的人喉癌细胞基因治疗的候选靶点,可为喉癌的临床治疗提供有效的解决方案。
[1] Li P,Liu H,Wang Z,etal.MicroRNAs in laryngeal cancer:implications for diagnosis,prognosis and therapy[J].Am J Transl Res,2016,8(5):1935-1944.
[2] 张思毅,卢仲明,宋新汉,等.喉癌组织中的microRNA差异表达谱及miR-125a-5p抑制喉癌细胞增殖的初步研究[J].中国病理生理杂志,2013,29(1):86-92.
[3] Wierzbicka M,Winiarski P,Osuch-Wójcikiewicz E.The incidence of laryngeal cancer in Europe with special regard to Poland in last 2 decades[J].Otolaryngol Pol,2016,70(4):16-21.
[4] 李 群,陆达锴,崔 翔,等.非编码RNA在喉癌发生中的作用及其临床意义[J].中国细胞生物学学报,2013,35(12):1797-1805.
[5] Sakurai F,Furukawa N,Higuchi M,etal.Suppression of hepatitis C virus replicon by adenovirus vector-mediated expression of tough decoy RNA against miR-122a[J].Virus Res,2012,165(2):214-218.
[6] Michael RS,Ellisen LW.The molecular pathogenesis of head and neck squamous cell carcinoma[J].J Clin Invest,2012,122(6):1951-1957.
[7] Lewis BP,Burge CB,Bartel DP.Conserved seed pairing,often flanked by adenosines,indicates that thousands of human genes are microRNA targets[J].Cell,2005,120(1):15-20.
[8] Yang SW,Ting HC,Lo YT,etal.Guanine nucleotide induced conformational change of Cdc42 revealed by hydrogen/deuterium exchange mass spectrometry[J].Biochim Biophys Acta,2016,1864(1):42-51.
[9] Fukuda H,Nakamura S,Chisaki Y,etal.Daphnetin inhibits invasion and migration of LM8 murine osteosarcoma cells by decreasing RhoA and Cdc42 expression[J].Biochem Biophys Res Commun,2016,471(1):63-67.
[10] Chou J,Wang BI,Zheng T,etal.MALAT1 induced migration and invasion of human breast cancer cells by competitively binding miR-1 with cdc42[J].Biochem Biophys Res Commun,2016,472(1):262-269.
[11] 解英俊,鄂长勇,盛基尧,等.沉默Cdc42对肝癌细胞增殖、迁移和侵袭能力的影响[J].中华外科杂志,2015,53(12):957-962.
[12] Gao M,Liu L,Li S,etal.Inhibition of cell proliferation and metastasis of human hepatocellular carcinoma by miR-137 is regulated by CDC42[J].Oncol Rep,2015,34(5):2523-2532.
[收稿2016-09-26 修回2016-10-11]
(编辑 许四平)
Impact of miR-122a on inhibition proliferation of laryngeal carcinoma cell line Hep2
CHENYun-Hua,YUYa-Feng.
DepartmentofOtolaryngology,ChangshuSecondPeople′sHospital,Changshu215500,China
Objective:To study the effect of miR-122a on inhibition proliferation of laryngeal carcinoma cell line Hep-2.Methods: The oligomucleotide of miR-122a was transfected into laryngeal carcinoma cell line Hep2 cells,which were devided into three groups of A(miR-122a transfection),B(miR-122a inhibitor),C(miR-122a-NC inhibitor) and group of D(blank control).The expression of miR-122a was defected by RT-PCR,and relevant protein expression was evaluated by Western blot.The cell proliferation and cell cycle were determined by MTT assy and flow cytometry,respectively.Results: Compared to group D,miR-122a expression in Hep2 cells was obviously elevated atter miR-122a-transfected.The proliferation of Hep2 cells in group A was significantly inhibited and the cell cycle arrested at G1/G0 phase.The protein expression of CDC42 was downregulated with decreased expressions of CDK4 and cyclin D1 in group A.Conclusion: miR-122a inhibits the proliferation activity of Hep2 cells,suggesting that miR-122a can be taken as a potential candidate for gene therapy of laryngeal carcinoma.
Laryngeal carcinoma;miR-122a;Cell cycle;Hep2 cells
10.3969/j.issn.1000-484X.2017.03.007
陈云华(1974年-),男,副主任医师,主要从事头颈部肿瘤方面的研究,E-mail:yunhua1974@126.com。
及指导教师:于亚峰(1974年-),男,博士,副主任医师,主要从事头颈部肿瘤方面的研究。
R739.65
A
1000-484X(2017)03-0352-04
①苏州大学附属第一医院耳鼻咽喉科,苏州215006。
