白细胞介素10通过抑制自噬调节树突状细胞功能①
2017-04-10屈玉兰邓捷文邓常文夏福灿郭振红
屈玉兰 邓捷文 邓常文 夏福灿 郭振红 白 冲
(第二军医大学长海医院呼吸与危重症医学科,上海200433)
白细胞介素10通过抑制自噬调节树突状细胞功能①
屈玉兰 邓捷文②③邓常文 夏福灿④郭振红③白 冲
(第二军医大学长海医院呼吸与危重症医学科,上海200433)
目的:研究白细胞介素10(Interleukin-10,IL-10)对树突状细胞(Dendritic cells,DCs)自噬及功能的影响。 方法:体外培养C57BL/6小鼠骨髓来源的DCs分为对照组、LPS刺激组、IL-10干预组、IL-10与雷帕霉素干预组、雷帕霉素干预组,分别通过流式细胞术分析DCs表面共刺激分子CD40、CD80的表达、DCs摄取OVA抗原的比例以及诱导OT2细胞增殖比例,ELISA检测DCs分泌IL-6,TNF-α的水平等DCs相关功能;蛋白免疫印迹法检测DCs自噬蛋白LC3的表达,比较组间差异,以探讨IL-10对DCs功能及自噬的影响。 结果:(1)与LPS刺激组比较,IL-10处理组DCs的表面共刺激分子CD40、CD80的表达下降、分泌IL-6、TNF-α水平下降、刺激T细胞增殖的比例明显减弱、摄取OVA抗原的能力增加,IL-10+雷帕霉素干预组的DCs与IL-10单独处理组相比,表面CD80的表达明显增加(P<0.05)、分泌IL-6、TNF-α能力及刺激T细胞增殖的能力均明显增加(P<0.000 1)。(2)DCs的自噬相关蛋白(LC3Ⅱ/LC3Ⅰ比例)明显下降。 结论:IL-10可能通过抑制DCs自噬水平调节树突状细胞功能。
白细胞介素10;树突状细胞;自噬;调节功能
树突状细胞(Dendritic cells,DCs)作为目前最强大的抗原递呈细胞,在肿瘤、炎症及其他免疫反应中起着关键作用,与多种疾病(如:肿瘤、哮喘、自身免疫性脑脊髓炎等)密切相关[1]。DCs逐渐成熟的过程中,其表面共刺激分子及MHCⅡ表达增加,成为T淋巴细胞依赖的免疫反应最有效的诱导者。因此调控DCs的功能对抑制疾病的发生发展具有至关重要的作用。IL-10是Th2型细胞因子的家族成员,目前被认为最重要的负调控因子之一,具有强大的抗炎和免疫抑制作用。包括树突状细胞在内,其他如T细胞、巨噬细胞、B细胞在参与免疫反应时都能产生IL-10[2]。IL-10-/-小鼠生存能力及感染严重程度也明显低于野生组。既往研究表明IL-10能够影响DCs的分化及其表面共刺激分子的表达。如IL-10能够抑制IFN-γ和 TNF-α 对DCs表面共刺激分子的活化[3,4]。但是IL-10到底如何调节DCs的功能仍然存在争议。
自噬是广泛存在于真核生物的基本生命现象复制,在大多数细胞内起着“清道夫”的作用,是细胞内细胞器和其他结构自然减员和更新的正常途径[5]。自噬分为大自噬、小自噬和分子伴侣介导的自噬,而大自噬是最主要的方式[6]。自噬作为一种进化保守的细胞降解途径,涉及广泛,在包括肿瘤、衰老、炎症在内的各种免疫反应中都起重要作用[5,7],研究发现自噬不仅在DCs的发育过程中起着重要的作用,即外周血单核细胞在向DCs转化的过程中,自噬明显增强[8],而且自噬与DCs的功能也存在一定的关系,如RSV病毒感染后,能诱导DCs发生自噬从而分泌炎性因子,发生天然免疫反应[9]。TLR信号通路的激活能明显促进DCs的成熟及炎症因子的分泌,LPS作为经典的TLR4刺激剂也能通过促进DCs自噬从而活化DCs[10,11]。因此通过抑制DCs自噬可能成为抑制DCs活化的途径。我们研究发现IL-10能抑制LPS对DCs的活化作用,并且这一作用可能通过抑制DCs自噬实现的。这一研究有望为临床治疗DCs相关疾病提供新的思路。
1 材料与方法
1.1 实验材料、试剂 C57BL/6小鼠,雄性,6~8周龄,均购自上海必凯实验动物有限公司[许可证号:SYXK(沪)2013-0058]。C57/B6及OT2小鼠均在第二军医大学免疫学国家重点实验室SPF级动物房饲养[许可证号:SYXK(沪)2013-0016]。所有动物实验经第二军医大学实验动物伦理委员会批准。Chicken Ovabu min(OVA)购自美国Sigma公司。不同荧光标记的大鼠抗小鼠流式抗体 CD11c-PE、CD11c-APC、CD86-PE、CD80-FITC、CD40-PE、IaKb-FITC、CD4-APC,以及FITC、APC或者PE标记的同行对照IgG2 等均购自美国BD Pharmingen公司,分装后于4℃保存;rmIL-10购自美国PeproTech公司。小鼠重组GM-CSF、IL-4购自Promega公司,分装后-80℃保存备用。IL-6、TNF-α ELISA试剂盒均购自e-Bioscience公司。细胞裂解液(Cell lysis buffer)、蛋白酶抑制剂(Protease Inhibitor cocktail set Ⅲ,EDTA-Free)LC3B抗体等均购自美国CST公司。
1.2 方法
1.2.1 小鼠骨髓树突状细胞的培养 颈椎脱臼法处死C57BL/6小鼠,无菌取出股骨胫骨,1 ml注射器冲洗出骨髓细胞,用移液枪吹成单细胞悬液后离心,Tris-NH4Cl溶解红细胞,过滤后离心,用完全培养基(RPMI1640培养基+10%胎牛血清+mGM-CSF 10 ng/ml+mIL-4 1 ng/ml),重悬后加入6孔板培养,培养3 d后,弃除培养基及悬浮细胞,重新加入新鲜完全培养基,以后每天换液。第5天的为未成熟骨髓来源的树突状细胞(immuture bone marrow-derived dendritic cell,im-BMDC),第7天以后的为成熟的树突状细胞(m-BMDC)。
1.2.2 BMDCs表面共刺激分子及分泌细胞因子的检测 观察IL-10对培养BMDC作用时,将常规培养的BMDC于第5天吹下疏松贴壁的增值性细胞聚集体,即为富集的BMDC。离心后用含10%FBS的血清重悬细胞并铺于24孔板(1×106细胞/孔),将实验分为:(1)空白对照组;(2)LPS 100 ng/ml刺激组;(3)IL-10干预组 ;(4)IL-10+雷帕霉素干预组;(5)雷帕霉素干预组。37℃、5%CO2孵箱中培养12 h后,分别收集各孔的细胞及培养上清。ELISA法检测各组细胞培养上清中的IL-6、TNF-α的水平,流式细胞术分析DCs表面共刺激分子的表达水平。
1.2.3 流式检测BMDCs摄取OVA抗原的能力 观察IL-10对BMDCs对OVA抗原的摄取能力时,将实验分为空白对照,LPS(100 ng/ml)刺激组,IL-10预处理后LPS刺激组。即预先用IL-10处理BMDCs 10 h后,用LPS刺激12 h,将细胞收集后转入1.5 ml EP管中,各组分为4℃冰箱中孵育组和37℃孵箱中孵育组。处理Blank组,不加入OVA外,余各组加入荧光标记的OVA(1∶2 000)孵育2 h后,冷的PBS洗涤2次后,加入CD11c-PE流式抗体,4℃孵育30 min后用冷的PBS洗涤后重悬,进行流式检测。
1.2.4 T淋巴细胞增殖实验及T细胞活化反应检测 颈椎脱臼发处死OT2小鼠,无菌取出脾脏,研磨制备单细胞悬液,用Tris-NH4Cl破红后,滤网过滤后离心,弃上清,CD4磁珠分选出T细胞并细胞计数。CFSE进行细胞染色,用预冷的RPMI1640培养基洗涤1次。 OT2细胞计数后用10%1640培养基调整细胞浓度为106个/ml,并以105个/孔铺板于96孔圆底培养板,各组DCs加入到预置孔中,以DCs∶T=1∶10比例铺板。37℃、5%CO2的孵箱中孵育72 h后检测T细胞增殖情况。
1.2.5 Western blot检测各组BMDC自噬水平 收集第5天的BMDC,以3×106铺板于6孔板。①用LPS刺激DCs,收集不同时间点的DCs。①找出LPS刺激DCs发生自噬的最强时间点;②用IL-10预处理DCs后,加入LPS(100 ng/ml)刺激,在上述得出的最佳时间点收集细胞,用冷PBS洗涤后,加入细胞裂解液冰上裂解半小时,4℃离心机12 000 r/min离心10 min后吸取上清。BCA法测定蛋白浓度并将浓度配平后,加入准备好的上样缓冲液,于100℃水浴锅煮沸5 min,各取30 μg蛋白进行12%SDS-PAGE电泳,60 V电泳30 min后以120 V电泳60 min,再以100 V、90 min恒压转移到NC膜上。再用5%脱脂奶粉/TBST室温下封闭1.5 h,分别用羊源的α-actin抗体(1∶500),兔来源的P62抗体(1∶3 000),LC3 Ⅱ(1∶1 000),4℃孵育过夜。次日用相对应的二抗在室温孵育1 h后,加入AB液曝光。
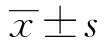
2 结果
2.1 IL-10能抑制DCs功能且能被自噬促进剂雷帕霉素逆转
2.1.1 IL-10能抑制DCs表面活化标记 在细胞培养第5天时,将IL-10预处理DCs后,再用LPS刺激后发现,LPS能明显刺激DCs活化,而用IL-10处理后则能明显抑制DCs表面共刺激分子CD80,CD40的表达(图1A、B),并且差异均具有统计学意义(各组间比较,FA=21.28,FB=48.29;PA,B<0.000 1)。且IL-10对DCs的抑制能够被雷帕霉素部分逆转(图1A、B)。结果显示IL-10可以抑制LPS对DCs的活化。
2.1.2 IL-10抑制DCs分泌细胞因子 ELISA检测细胞因子也发现,LPS刺激组DCs分泌IL-6、TNF-α水平明显增高。而IL-10处理后的DCs分泌这两种细胞因子的能力均明显下降(图2),并且具有统计学意义(各组间比较,FA=46.25,FB=904.9;PA,B<0.000 1)。重新加入自噬刺激剂雷帕霉素后却能部分逆转DCs分泌这两种细胞因子的功能(如图2所示,DCs+LPS+IL-10组与DCs+LPS+IL-10+repa组相比差异都具有统计学意义)。
2.1.3 IL-10增加DCs摄取OVA抗原 未成熟DCs具有更好的摄取抗原能力,而随着DCs的不断成熟,DCs抗原摄取能力不断下降而抗原处理和递呈能力不断增加,从而刺激T细胞增殖。结合之前的结果显示,LPS虽然能明显活化DCs,其摄取OVA抗原的能力却是明显下降的,但是 IL-10处理DCs后,DCs摄取OVA的能力又开始增加(图3A),并且具有统计学意义(各组间比较,F=19.48,P=0.002 4,图3B),这也表明IL-10能够抑制DCs的活化及成熟。
2.1.4 IL-10抑制T细胞增殖及T细胞活化 将不同组的DCs与DO11.10小鼠来源的脾脏T细胞,即OVA323~339特异性的CD4+细胞(OT2细胞),共培养72 h后,流式检测CFSE+CD4+T cell增殖情况发现:加入DCs后,CFSE染色的OT2细胞增殖明显增强,LPS则能进一步促进DCs刺激T细胞的增殖,而IL-10处理后的DCs组,CFSE增殖的比例则明显减少,但IL-10对DCs的这一抑制过程可以被自噬刺激剂雷帕霉素部分逆转(图4A)。并且差异具有统计学意义(图4B,各组间比较,F=112.7,P<0.000 1)。
2.2 IL-10能抑制DCs自噬 目前认为细胞发生自噬时,LC3蛋白合成后,其羧基端会被Atg4所剪切,产生细胞浆定位的LC3-Ⅰ,LC3-Ⅰ会被包括Atg7和Atg3在内的泛素样体系所修饰和加工,产生LC3-II并定位到自噬小体中。这样LC3-Ⅱ/LC3-Ⅰ含量与发生自噬的程度成正比,并且作为细胞自噬的标记[12]。在体外用LPS刺激DCs诱导自噬,观察不同时间点树突状细胞的自噬情况。发现LPS刺激12 h后DCs发生自噬最强(图5A)。而用IL-10处理DCs发现,相比于阳性对照组,LC3Ⅱ/LC3Ⅰ明显下降,即提示DCs自噬减弱(图5B),用Image Pro-Plus6软件测量灰度值后统计分析显示IL-10能明显降低LC3Ⅱ/LC3Ⅰ的比值,统计具有统计学意义(图5C,各组间比较,F=57.77,P=0.000 1)。
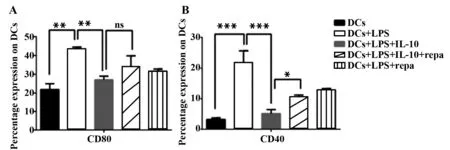
图1 IL-10抑制LPS诱导DCs的活化Fig.1 IL-10 inhibits DC activation induced by LPSNote: **.P<0.01;**.P<0.001;***.P<0.000 1.
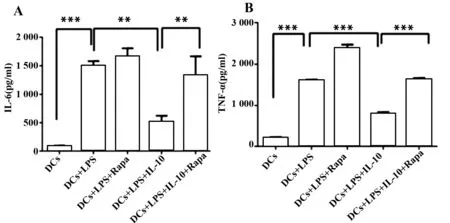
图2 IL-10抑制DCs分泌细胞因子Fig.2 IL-10 inhibits ability of DCs to secret cytokinesNote: **.P<0.01;**.P<0.001;***.P<0.000 1.
图3 IL-10影响DCs摄取OVA抗原Fig.3 IL-10 influences process of DCs taking in OVA antigenNote: A.OVA antigen taken by DCs in different situation as deter-mined by FACS;B.Data are representative of two or three independent experiments.Data were analyzed with analysis of variance (ANOVA).*.P<0.005;**.P<0.001.
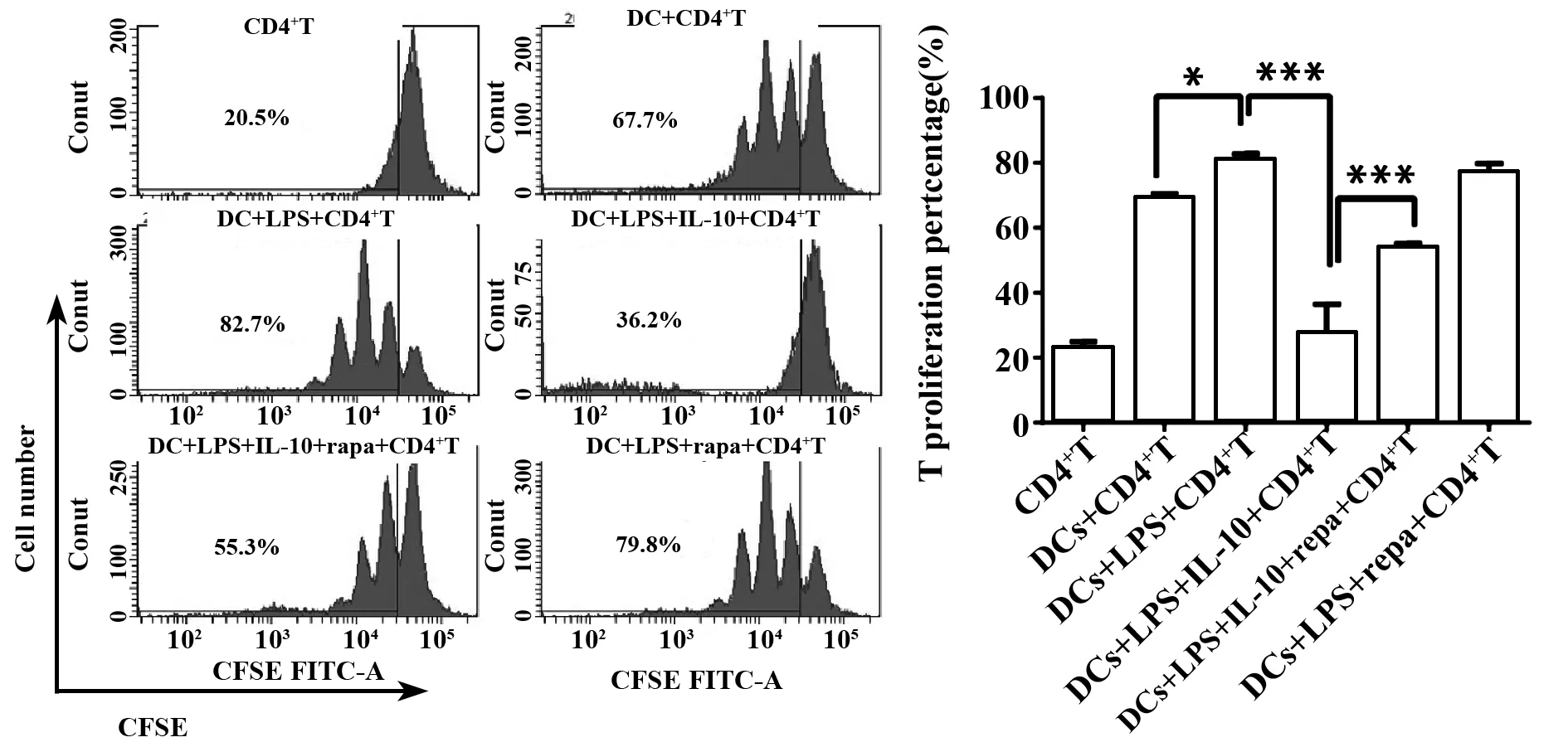
图4 IL-10抑制DCs刺激T细胞增殖的能力Fig.4 IL-10 suppresses ability of DCs to stimulate T cells proliferationNote: A.Inhibition of naive CD4+ OVA-specific transgenic DO11.10 T cells cultured with DCs in different situation pulsed with pOVA323-339(DC∶CD4+T =1∶10).Negative CFSE percentage indicate the proliferation of CD4+T cells.One of three independent experiments are shown;B.Histograms show CFSE gated CD4+T proliferation by DCs in different situation.Data shown are representative of three independent experiments.Data were analyzed with analysis of variance(ANOVA).*.P<0.05;***.P<0.000 1.
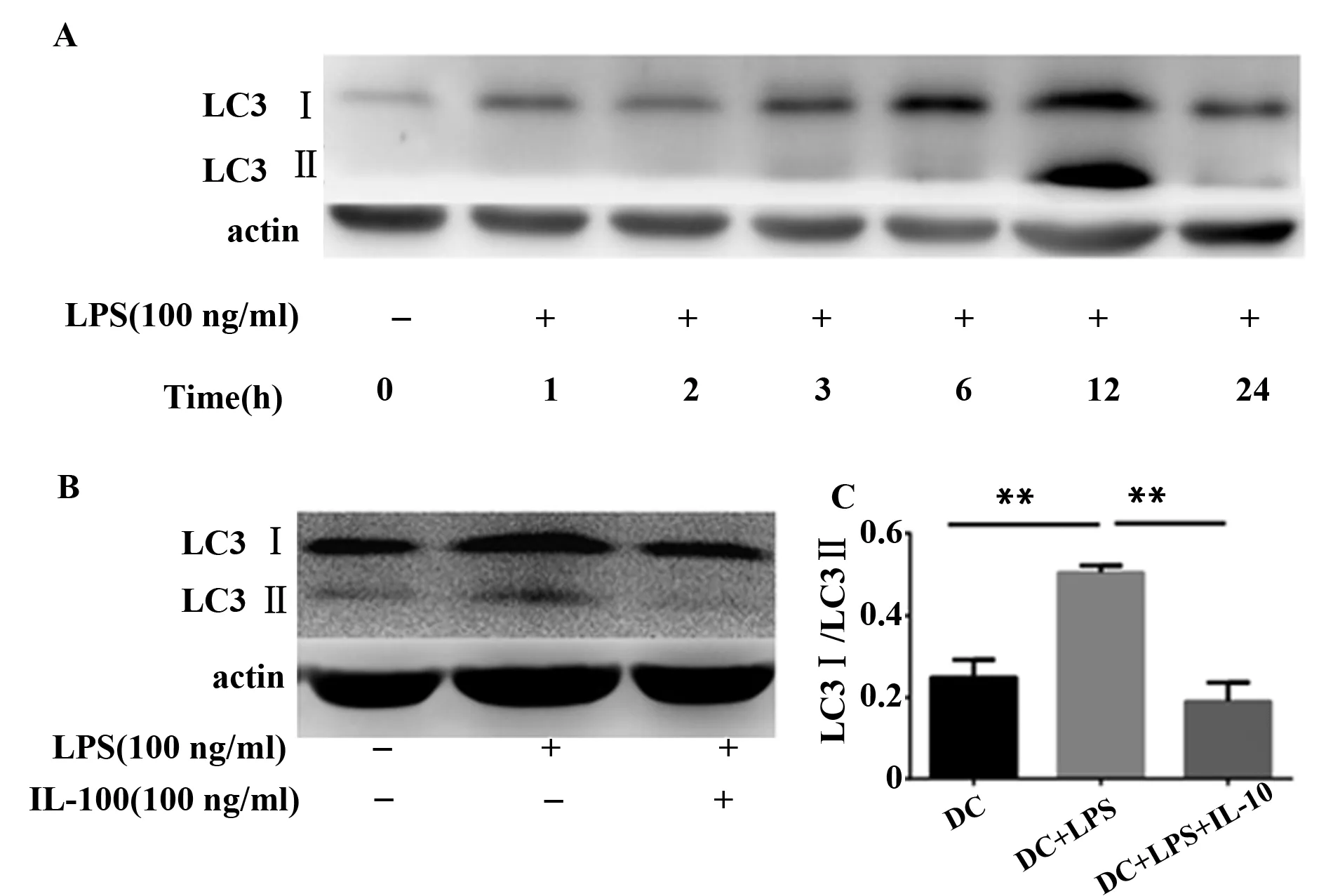
图5 IL-10抑制LPS诱导DCs的自噬Fig.5 IL-10 disrupts autophagy reaction of DCs induced by LPSNote: A.Western blot of autophagy related protein LC3 from ctr-DC stimulated in different time and not stimulated with LPS;B.Western blot of autophagy related protein LC3 from ctr-DC and IL-10 conditioned DC,stimulated and not stimulated with LPS at 12 h are shown.Anti-β-actin was used as control.One of three independent experiments are shown;C.Histograms show the ratio of LC3Ⅱ/LC3Ⅰin ctr-DC and in MSC-conditioned DC after 12 h of LPS stimulation.Data shown are representative of three independent experiments.Data were analyzed with analysis of variance(ANOVA).**.P<0.001.
3 讨论
自噬作为一种通过自我消化错误折叠蛋白或者细胞碎片获取“营养”,实现细胞自我更新及发挥功能的重要途径,是大自然普遍存在的生命现象,自噬不仅参与体内稳态及细胞功能的维持,自噬的紊乱也与多种疾病密切相关。既往研究表明,包括阿尔茨海默病、帕金森氏病在内的多种神经退行性病变的患者中都存在自噬体的聚集,而在肝脏疾病、衰老等患者的相应部位也能发现此现象[13]。自噬与感染、免疫反应,以及炎症性疾病更是密不可分的。有研究认为,自噬在活化的天然免疫和适应性免疫反应中都具有重要作用。在适应性免疫反应中,DCs等抗原提呈细胞在处理内源性或者外源抗原至MHC分子时都需要自噬的参与。那么,在某些可能由于自噬水平增加引起免疫反应增强的疾病中,抑制自噬的水平显得尤为重要。IL-10作为目前认为最强的免疫抑制性的细胞因子,在多种细胞或者药物缓解疾病的过程中表达也明显增高[14]。那么IL-10是否通过抑制自噬水平从而抑制免疫反应?本研究以最重要的抗原提呈细胞DCs为干预对象,展开研究。结果发现IL-10预处理DCs后, LPS活化DCs的能力明显下降:DCs表面共刺激分子的表达,炎症因子的分泌,刺激T细胞增殖能力均明显下降。这与既往研究是保持一致的[2]。然而IL-10对DCs的功能抑制,在加入自噬刺激剂雷帕霉素之后,DCs表面共刺激分子CD80、CD40的表达水平,刺激T细胞增殖以及分泌细胞因子的能力都出现了完全或者部分逆转。这表明IL-10可能通过抑制细胞自噬实现对DCs功能的抑制。Western blot进一步对自噬相关蛋白LC3进行检测发现,IL-10处理组能明显降低LC3-Ⅱ/LC3-Ⅰ的比值,表明IL-10能抑制DCs自噬。初步得出结论:即IL-10可能通过抑制DCs自噬下调DCs的功能。既往研究已经提示自噬在DCs的发育过程中起着重要的作用,外周血单核细胞在向DCs分化的过程中自噬不断增强。而IL-10处理后,这个过程可被抑制,使得DCs停留在其前体单核细胞的阶段[8]。但是该研究对DCs的功能未做讨论,以及外界环境对DCs的影响引起的DCs的自噬是否能被IL-10抑制以及与DCs功能的关系也未做探讨。也有研究发现DCs能够选择性地利用自噬机制,如ATG5,摄取及处理胞外抗原,通过MHCⅡ分子递呈给CD4+T细胞,从而发生免疫反应[15]。本研究则在体外模拟炎症环境,通过LPS刺激未成熟的DCs促进其成熟活化,并探讨其与DCs自噬的关系发现,LPS刺激DCs功能增强至最大的时间点DCs自噬的时间点基本是吻合的。 并发现IL-10预处理DCs后,LPS对DCs的活化作用明显降低,而这也是伴随着DCs自噬的下降的。当再次加入自噬刺激剂雷帕霉素时,这种抑制作用出现了部分逆转。这些证据均提示:IL-10可能通过抑制DCs自噬下调DCs的功能的,为IL-10如何调控DCs的功能做了进一步的机制研究。但是自噬是一个复杂的过程,对于IL-10到底通过什么抑制DCs自噬,是某一明星分子扮演了重要角色还是IL-10抑制了自噬过程中某一环节,仍然值得进一步探讨。但是值得肯定的是DCs自噬和其功能存在一定关系,一定范围内,自噬越强,DCs功能越强。自噬是把双刃剑,适当的自噬能够促进细胞的生存及代谢,过度自噬则会引起细胞凋亡增加,从而降低细胞功能[16,17]。因此,如何合理调节自噬,游刃有余地控制自噬,从而调节细胞的功能显得尤为重要。深入研究IL-10如何影响DCs功能有助于更好地研究这一科学问题。
[1] Steinman RM,Banchereau J.Taking dendritic cells into medicine[J].Nature,2007,449(7161):419-426.
[2] Mosser DM,Zhang X.Interleukin-10:new perspectives on an old cytokine[J].Immunol Rev,2008,226:205-218.
[3] Parcina M,Miranda-Garcia MA,Durlanik S,etal.Pathogen-triggered activation of plasmacytoid dendritic cells induces IL-10-producing B cells in response to Staphylococcus aureus[J].J Immunol,2013,190(4):1591-1602.
[4] Doz E,Lombard R,Carreras F,etal.Mycobacteria-infected dendritic cells attract neutrophils that produce IL-10 and specifically shut down Th17 CD4 T cells through their IL-10 receptor[J].J Immunol,2013,191(7):3818-3826.
[5] Ryter SW,Mizumura K,Choi AM.The impact of autophagy on cell death modalities[J].Int J Cell Biol,2014,2014:502676.
[6] Mizumura K,Choi AM,Ryter SW.Emerging role of selective autophagy in human diseases[J].Front Pharmacol,2014,5:244.
[7] Hurley JH,Schulman BA.Atomistic autophagy:the structures of cellular self-digestion[J].Cell,2014,157(2):300-311.
[8] Martin C,Espaillat MP,Santiago-Schwarz F.IL-10 restricts dendritic cell(DC)growth at the monocyte-to-monocyte-derived DC interface by disrupting anti-apoptotic and cytoprotective autophagic molecular machinery[J].Immunol Res,2015,63(1-3):131-143.
[9] Morris S,Swanson MS,Lieberman A,etal.Autophagy-mediated dendritic cell activation is essential for innate cytokine production and APC function with respiratory syncytial virus responses[J].J Immunol,2011,187(8):3953-3961.
[10] Oh JE,Lee HK.Pattern recognition receptors and autophagy[J].Front Immunol,2014,5:300.
[11] Delgado MA,Elmaoued RA,Davis AS,etal.Toll-like receptors control autophagy[J].EMBO J,2008,27(7):1110-1121.
[12] Munz C.Autophagy proteins in antigen processing for presentation on MHC molecules[J].Immunol Rev,2016,272(1):17-27.
[13] Levine B,Kroemer G.Autophagy in the pathogenesis of disease[J].Cell,2008,132(1):27-42.
[14] Mittal SK,Roche PA.Suppression of antigen presentation by IL-10[J].Curr Opin Immunol,2015,34:22-27.
[15] Lee HK,Mattei LM,Steinberg BE,etal.In vivo requirement for Atg5 in antigen presentation by dendritic cells[J].Immunity,2010,32(2):227-239.
[16] Shintani T,Klionsky DJ.Autophagy in health and disease:a double-edged sword[J].Science,2004,306(5698):990-995.
[17] Oral O,Akkoc Y,Bayraktar O,etal.Physiological and pathological significance of the molecular cross-talk between autophagy and apoptosis[J].Histol Histopathol,2016,31(5):479-498.
[收稿2016-08-13 修回2016-10-25]
(编辑 张晓舟)
Interleukin-10 regulates functions of dendritic cell through autophagy inhibition
QUYu-Lan,DENGJie-Wen,DENGChang-Wen,XIAFu-Can,GUOZhen-Hong,BAIChong.
DepartmentofRespiratoryCriticalCareMedicine,ChanghaiHospital,SecondMilitaryMedicalUniversity,Shanghai200433,China
Objective:To study the mechanism of interleukin-10(IL-10)inhibiting the function of dendritic cells(DCs).Methods: Cultured C57BL/6 mouse bone marrow-derived DCs were divided into 5 groups:control group,LPS stimulated group,IL-10 treated group,IL-10+Rapamycin treated group and Rapamycin treated group.The regulatory mechanism of IL-10 on dendritic cells were evaluated from DCs function,Flow cytometry was used to analyse the expression of DCs surface co-stimulator CD80,CD40 expression,the ability of uptaking antigen and stimulating T cell to proliferate;ELISA was used to detect the cytokines IL-6 and TNF-α .Western blot was used to analyse the autophagy related protein LC3.Compared the differences between the groups.Results: (1)Compared to LPS stimulated group,IL-10 treated group,DCs surface co-stimulator CD40,CD80 were decreased,IL-6 and TNF-α secretion level and the ability to stimulate T cell to proliferate were decreased,the ability to capture OVA antigen was increased.Compared to IL-10 treated group,the DCs surface co-stimulator CD80 was decreased(P<0.05),IL-6 and TNF-α secretion level and the ability to stimulate T cell to proliferate were increased(P<0.000 1)in IL-10+rapamycin treated group.In addition,autophagy related proteins LC3Ⅱ/LC3Ⅰ was decreased in IL-10 treated group.Conclusion: IL-10 may regulate functions of DCs through inhibiting the autophagy of DCs.
Interleukin-10;Dendritic cells;Autophagy;Functions regulation
10.3969/j.issn.1000-484X.2017.03.003
①本文受国家自然科学基金面上项目(81270073,81570019)资助。
屈玉兰(1990年-),女,在读硕士,主要从事慢性气道疾病与树突状细胞相关性的机制研究。
及指导教师:白 冲(1964年-),男,博士,教授,主要从事慢性呼吸道疾病的相关研究,E-mail:bc7878@sohu.com。
R392.12
A
1000-484X(2017)03-0333-05
②共同第一作者。
③第二军医大学医学免疫学国家重点实验室,上海200433。
④浙江大学医学院免疫研究所,杭州310058。
