不同产地炮天雄的质量考察与比较
2017-04-10邓广海陈艳红龚又明
覃 军,邓广海,陈艳红,龚又明
(广州中医药大学第二附属医院药学部,广东 广州 510120)
·实验研究·
不同产地炮天雄的质量考察与比较
覃 军,邓广海,陈艳红,龚又明
(广州中医药大学第二附属医院药学部,广东 广州 510120)
目的考察不同产地炮天雄的质量,测定双酯型生物碱和单酯型生物碱的差异。方法色谱柱采用Kromasil100-5-C18柱(250mm× 4.6mm,5 m),以乙腈-四氢呋喃(25∶15)为流动相A,以0.1mol/L醋酸铵溶液为流动相B,进行梯度洗脱,流速为1m L/min,检测波长为235 nm,柱温为30℃。结果 四川、湖北的炮天雄单酯型生物碱含量最高,毒性成分较大的双酯型生物碱则以四川、香港的为最低。结论 不同产地的炮天雄受当地原药材的影响,更受炮制经验、工艺的影响,应尽快制订炮天雄相关标准。
炮天雄;酯型生物碱;产地;高效液相色谱法
天雄来源于毛茛科乌头 Acontum carmichaeliDebx.个大形长的附子,是乌头类中药的一种[1],主产于广东、广西、四川、湖南、湖北等。其性味辛、热,归肾经,有大毒,具祛风散寒、益火补阳的功效,用于治疗关节痛、中风、四肢拘挛、风湿寒痹、心腹冷痛等[2]。附子在《神农本草经》中列为下品,药典中也明确标注有毒,但临床应用甚广,因其同时还有显著的药理作用[3-4],是“为最有用亦最难用”之药[5]。炮天雄是岭南特色炮制品种,亦是岭南地区常用的附子饮片之一,东南亚、港台等地区的人民通常将岭南炮天雄作为滋补食疗的佳品。炮天雄的基本炮制过程虽与炮附片一致,但两者在砂烫程度上不一样。炮天雄岭南特色炮制工艺难度较高,各地区现主要依靠工人经验来确定炮制浸漂、蒸制、炒制时间与火候的程度,造成不同地区炮天雄在质量上有所差异。本研究中就不同地区炮天雄的含量差异进行测定,为保证中药材成品的质量及毒性的可控性及建立炮天雄的质量标准提供参考。
1 仪器与试药
1.1 仪器
Agilent1260型高效液相色谱仪(美国Agilent公司;BS110S型天平(万分之一,赛多利斯公司),BS200SWEI型天平(千分之一,赛多利斯公司),XP26型天平(百万分之一,Mettler Toledo);HWS28型恒温水浴锅(上海一恒科技有限公司);RV10型旋转蒸发仪(德国IKA公司);SHZ-DⅢ型循环水式真空泵。
1.2 试药
苯甲酰新乌头原碱(批号为111795-201102,含量以 97.0%计),苯甲酰乌头原碱(批号为 111794-201102,含量以96.5%计),苯甲酰次乌头原碱(批号为111796-201002,含量以97.3%计),新乌头碱(批号为110799-201106,含量以98.5%计),次乌头碱(批号为110798-201106,含量以 99.8%计),乌头碱(批号为110720-201111,含量以98.8%计),均购自中国食品药品检定研究院。炮天雄样品采自广东广州、湖北竹山、陕西兴平县、广东韶关、四川安县、香港、云南丽江,取样大小均匀,经鉴定均为正品。
2 方法
2.1 色谱条件与系统适用性试验
色谱柱:Kromasil100-5-C18柱(250mm×4.6mm,5μm);流动相:乙腈-四氢呋喃(25∶15)为流动相A,0.1mol/L醋酸铵溶液(每1 000m L加冰醋酸0.5 mL)为流动相B,进行梯度洗脱,见表1;流速:1m L/min;检测波长:235 nm;柱温:30℃;进样量:10μL。在此色谱条件下的色谱图见图1。
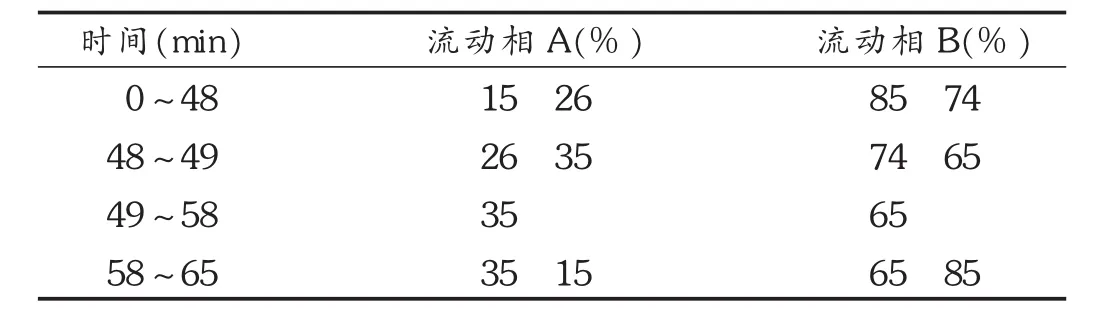
表1 流动相梯度洗脱程序
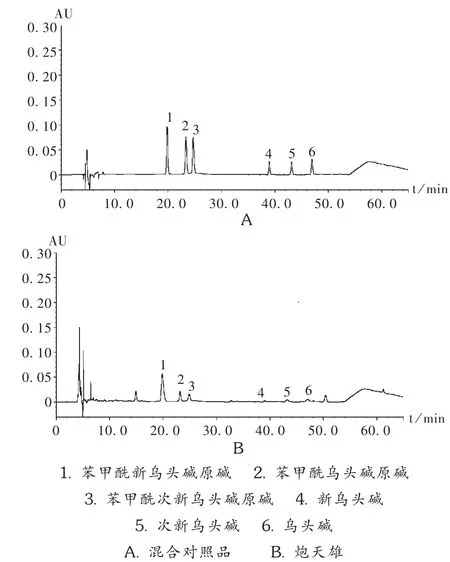
图1 高效液相色谱图
2.2 溶液制备
对照品溶液:取单酯型生物碱(苯甲酰新乌头原碱对照品、苯甲酰乌头原碱对照品、苯甲酰次乌头原碱)对照品及双酯型生物碱(新乌头原碱对照品、乌头原碱对照品、次乌头原碱)对照品适量,精密称定,加异丙醇-二氯甲烷(1∶1)混合溶液制成每1mL各含25μg的混合溶液,即得。
供试品溶液[1]:取本品粉末(过3号筛)约2 g,精密称定,置具塞锥形瓶中,加氨试液3m L,精密加入异丙醇-乙酸乙酯(1∶1)混合溶液50 m L,称定质量,超声处理(功率 300 W,频率 40 kHz,水温在 25℃以下)30 min,放冷,再称定质量,用异丙醇-乙酸乙酯(1∶1)混合溶液补足减失的质量,摇匀,滤过。精密量取续滤液25 mL,40℃以下减压回收溶剂至干,残渣精密加入异丙醇-二氯甲烷(1∶1)混合溶液3m L溶解,滤过,取续滤液,即得。
2.3 方法学考察
线性关系考察:取单、双酯型生物碱对照品溶液适量,按拟定色谱条件分别将0.5,1,2,4,8,12,20μL注入液相色谱仪,测定,记录峰面积,以峰面积积分值(A)与对照品溶液含量(X)进行线性回归,结果详见表2。
精密度试验:精密吸取供试品溶液10μL,注入液相色谱仪,重复进样6次。结果苯甲酰新乌头原碱、苯甲酰乌头原碱、苯甲酰次乌头原碱的 RSD分别为1.97%,1.92%,1.94%(n=6),表明仪器精密度良好。详见表3。
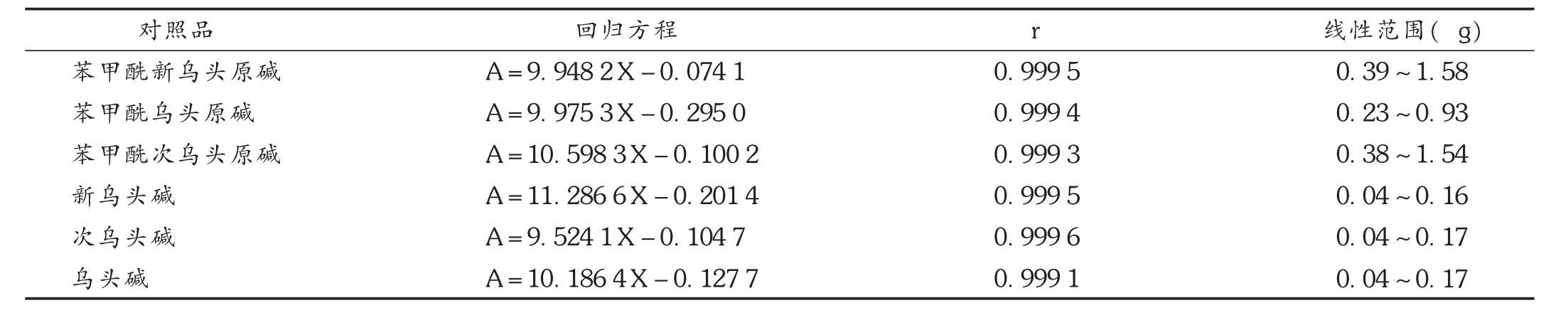
表2 线性关系考察结果(n=7)
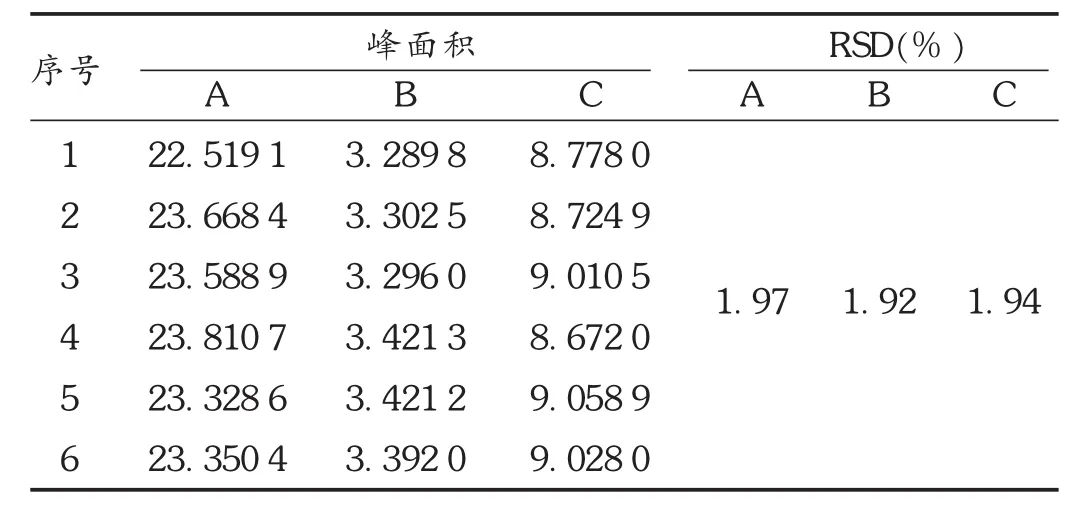
表3 单酯型生物碱精密度试验结果(n=6)
稳定性试验:取同一供试品溶液,按拟订色谱条件,分别于0,2,4,6,12,24 h时进样10μL。结果苯甲酰新乌头原碱、苯甲酰乌头原碱、苯甲酰次乌头原碱的 RSD分别为0.65%,0.95%,1.71%(n=6),表明供试品溶液在24 h内稳定。详见表4。
重复性试验:取同一批样品6份,按2.2项下方法平行制备供试品溶液6份。结果峰面积积分值苯甲酰新乌头原碱的 RSD为0.41%(n=6),苯甲酰乌头原碱的RSD为1.68%(n=6),苯甲酰次乌头原碱的 RSD为0.36%(n=6),表明方法重复性良好。详见表5。
加样回收试验:取己知含量的样品约1.0 g,共6份,精密称定,精密加入所测成分约等量的对照品,照含量测定项下操作,计算加样回收率。结果见表6。

表4 稳定性试验结果(n=6)
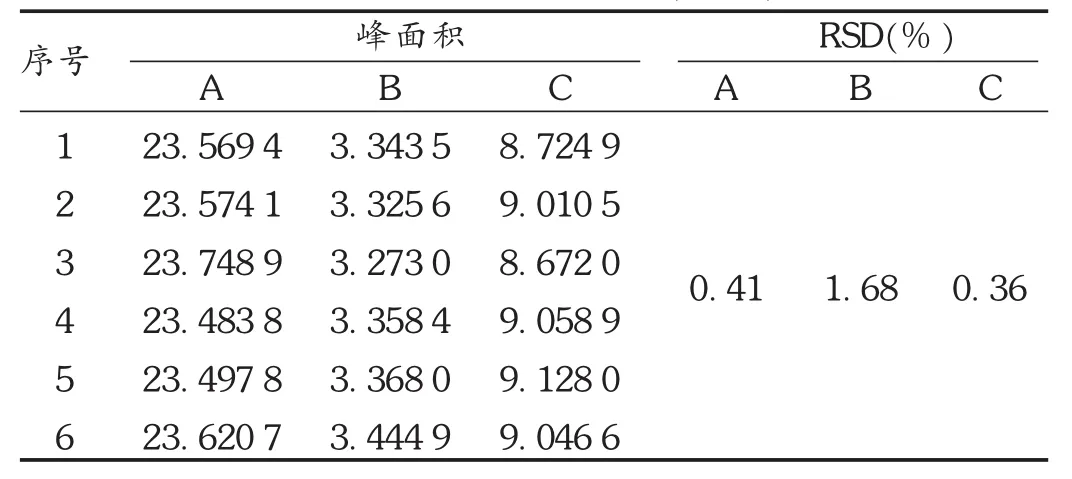
表5 重复性试验结果(n=6)
2.4 样品含量测定
取炮天雄粉末(过3号筛)约2 g,按2.2项下方法制备供试品溶液,按拟订色谱条件,分别测定各产地样品中酯型生物碱的含量,计算干燥品含单、双酯型生物碱的总量。结果见表7。

表6 加样回收试验结果(n=6)
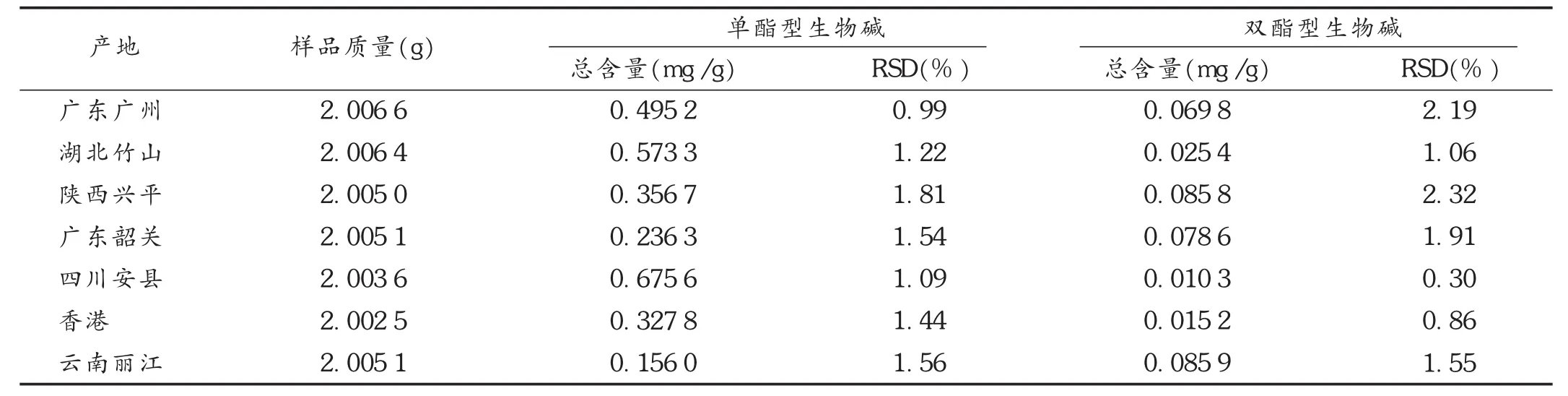
表7 各产地样品含量测定结果
3 讨论
炮天雄不单是岭南地区的习用中药,在民间的传统食用历史也较为悠久,是滋补食疗佳品,具有补肾助阳的作用。其中,天雄散主要治疗男性病、不孕症、男性尿频等[6-9]。因中药的同名异物、异物同名的问题,药典中尚未在附子一项下收载天雄,仅收录了常用几种炮制品,天雄商品和饮片规格不为人所熟悉,但港澳、东南亚地区仍习惯沿用“炮天雄”入方治疗元阳素虚、肾亏阳虚证[10]。
附子等乌头类的中毒反应在临床并不少见[11-12],而炮天雄作为附子制品的一种,无论是少数民族药或地方习用品,只要临床上有使用的需要则其炮制规范和质量标准亟待规范[13]。目前,乌头碱类药物的单酯型生物碱、双酯型生物碱及总生物碱的含量测定方法主要有高效液相色谱法、反相高效液相色谱法、液-质联用法、双波长薄层扫描法、高效毛细管电泳法和分光光度法[14-15],本研究中考察了炮天雄乌头类生物碱的特性,采用高效液相色谱法,操作简便,精确度高,重复性好。
单酯型生物碱含量由高到低为四川安县、湖北竹山、广东广州、陕西兴平、香港、广东韶关、云南丽江。双酯型生物碱限量由低到高为四川安县、香港、湖北竹山、广东广州、广东韶关、陕西兴平、云南丽江。这与炮天雄在炮制过程中受到环境、工艺条件等因素影响而产生质量差异有关,炮天雄的原药附子在四川、湖北种植历史悠久,质量好。本研究结果显示,四川、湖北的炮制品单酯型生物碱含量最高。不同地区的炮制工艺不同,也是导致炮天雄质量差异的主要原因。炮天雄主要经过切制、闷润姜汁、蒸煮、热砂拌炒等加工过程[16],不同地区炮制人员经验的差异导致其质量有差异。
综上所述,不同产地炮天雄的质量不仅体现在炮制工艺上,更体现在炮制质量的差异上。苯甲酰乌头碱毒性约为乌头碱的1/200,苯甲酰乌头原碱的毒性仅为乌头碱的1/2 000,不仅是附子的毒性成分,同时也是药效成分。相对于炮附子、炮天雄的双酯型生物碱成分含量更低,而毒性较弱的单酯型生物碱含量更高,故有效成分含量比重更高。炮附片的质量标准不适用炮天雄,建议尽快制订炮天雄的质量标准。
[1]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2015:192.
[2]李德斌,黄志芳,刘云华,等.炮天雄质量标准研究[J].中国实验方剂学,2013,12(19):76-81.
[3]黄 超,张学顺,朱日然.附子、半夏现代药学研究进展及配伍变化[J].中国药业,2012,21(4):19-21.
[4]周 刚,龚千锋,徐 刚 .天雄的本草考证[J].中药材,2003,26(6):441-443.
[5]黄勤挽,周子渝,王 瑾,等.附子商品规格梳理及形成模式研究[J].成都中医药大学学报,2011,34(2):83-85.
[6]梁松涛.黑水城出土西夏文古医方“天雄散”考述[J].云南中医学院学报,2012,35(2):46-47.
[7]谈伟伟,赵 晶.天雄散治疗男性病验案举隅[J].河北中医,2011,33(11):1693.
[8]徐 潘.天雄散加味治疗男科疾病三则[J].浙江中医杂志,2013,48(4):277.
[9]山 佳.天雄散治疗老年性尿频、尿急[J].国外医学:中医中药分册,1998(2):32-33.
[10]曹 晖,王时桃,吴连英,等.香港市售天雄补肾助阳药效学研究[J].中国中药杂志,2001,26(6):9-12.
[11]贺丽英.中西医结合治疗急性重度乌头碱中毒致心律失常50例及综合护理[J].中国药业,2013,22(21):92-94.
[12]马 林,李丛芬.13例乌头碱中毒的急救[J].中国药业,2000,9(9):48.
[13]鞠爱华,王晓琴,闫 明.正交设计法优选蒙药草乌的炮制工艺[J].中国药业,2002,11(6):58-59.
[14]陆燕萍,巩晓宇,陈秋燕,等.乌头碱类生物碱的含量测定方法概述[J].中国药业,2016,25(7):1-3.
[15]冯自立.中药附子反相高效液相和RAPD指纹图谱及质量评价研究[D].咸阳:西北农林科技大学,2006.
[16]曹 晖,王春燕,王孝涛.毒性中药天雄炮制历史沿革研究[J].中国中药杂志,1998,23(6):34.
Quality Com parison of Pao Tianxiong from Different Producing Places
Qin Jun,Deng Guanghai,Chen Yanhong,Gong Youming
(Pharmaceutical Department,The Second Affiliated Hospital of Guangzhou University of Chinese Medicine,Guangzhou,Guangdong,China 510120)
Ob jective To study the quality of Pao Tianxiong from different producing places and to determine the difference between mono and di-ester alkaloids.M ethods Kromasil 100-5-C18column(250 mm×4.6 mm,5μm)was used;the acetonitrile-tetrahydrofuran(25∶15)was used as mobile phase A with 0.1 mol/L ammonium acetate solution as mobile phase B,gradient.The flow rate was 1 mL/min;detection wavelength is 235 nm;column temperature is 30℃.Results Pao Tianxiong from Sichuan and Hubei had the highest amount of mono-ester alkaloid content;Pao Tianxiong from Sichuan and Hong Kong had the lowest amount of di-ester alkaloids which were toxic.Conclusion Pao Tianxiong produced in different places are affected by local indigenous herbs;more importantly,it is affected by the processing experience and technology.Therefore,we need to make relevant standards for Pao Tianxiong as soon as possible.
Pao Tianxiong;ester alkaloids;place of origin;HPLC
R282.5;R284.1
A
1006-4931(2017)03-0011-04
2016-09-07;
2016-10-17)
10.3969/j.issn.1006-4931.2017.03.004
广东省科技计划项目[2016A040403104]。
覃军,男,副主任中药师,研究方向为中药饮片质量管理与控制,(电话)020-81887233(电子信箱)qinkum@163.com。
龚又明,男,硕士研究生,主管中药师,研究方向为中药质量监控与中药炮制,(电子信箱)4896318@qq.com。
