不同方法提取嗜酸氧化亚铁硫杆菌胞外聚合物的比较分析
2017-04-08顾卫华白建峰卢亮张洁娜王景伟
顾卫华,白建峰,卢亮,张洁娜,王景伟
(上海第二工业大学a.电子废弃物研究中心;b.上海电子废弃物资源化协同创新中心,上海201209)
不同方法提取嗜酸氧化亚铁硫杆菌胞外聚合物的比较分析
顾卫华,白建峰,卢亮,张洁娜,王景伟
(上海第二工业大学a.电子废弃物研究中心;b.上海电子废弃物资源化协同创新中心,上海201209)
从嗜酸氧化亚铁硫杆菌(Acidithiobacillus ferrooxidans,A.f菌)中提取胞外聚合物(Extracellular Ploymeric Substances,EPS)的方法有很多,但不同方法提取的EPS成分及含量都有较大区别。通过对比NaOH法、EDTA法、超声法、离心法提取A.f菌EPS的研究,分析高效提取A.f菌EPS方法的同时,得到EPS成分及含量在不同提取方法下的变化情况。实验结果表明,对于未驯化和驯化处理的实验组,超声法提取的EPS最多,分别达到37.1 mg·g-1、55.3 mg·g-1;同时其对细菌自身的破坏最小,测得的核酸占比分别为8.7%、8.1%。4种提取方法在A.f菌驯化前后,提取的EPS中多糖与蛋白质的比例范围分别为2.71~3.49和3.24~5.58。该实验结果可为模拟EPS来探索EPS对A.f菌浸出电子废弃物中金属的影响提供参考。
电子废弃物;嗜酸氧化亚铁硫杆菌;胞外聚合物;提取
0 引言
EPS(Extracellular Ploymeric Substances,胞外聚合物)指的是细菌或真菌在一定条件下分泌于细胞外的一些高分子有机物,主要包括蛋白质、多糖、核酸[1-2]。A.f菌(Acidithiobacillus ferrooxidans,嗜酸氧化亚铁硫杆菌)是一种化能自养菌,专性好氧,革兰氏阴性,最佳生长pH值为1.5~3.5,最佳生长温度为25~35°C[3]。作为一种典型的浸矿细菌,A.f菌会根据生长环境的变化分泌一些EPS来保护自身更好的繁殖。目前,细菌EPS的提取方法主要有物理法(离心法、加热法、超声法)、化学法(EDTA法、NaOH法、阳离子交换树脂提取法),提取对象主要是好氧/厌氧污泥、生物膜等常见物质[4-6]。关于A.f菌EPS的研究主要集中于EPS介导的A.f菌浸矿机制上。王利等[7]研究了在添加Fe3+及A.f菌与否、A.f菌失活与否、EPS脱离菌活体细胞与否等6组组合条件下,紫金山铜矿样浸矿过程中氧化还原电位变化的规律,结果表明,EPS对金属硫化矿的生物浸矿过程离不开分泌它的活体细胞。Yu等[8]研究了A.f菌浸出黄铜矿中氧化还原电位、黄钾铁矾和EPS的关系和影响,结果表明,细菌氧化的铁离子容易吸附在黄铜矿表面的EPS表层,而有黄钾铁矾的EPS层是弱离子扩散壁垒,会阻碍生物进一步浸出黄铜矿中的金属。为了深入探究A.f菌浸出电子废弃物中金属的作用机理,鉴于金属在矿物和电子废弃物中的不同存在形态[9],有必要先对A.f菌EPS进行高效提取,对比分析A.f菌驯化前后,其EPS成分组成及变化情况,为下一步揭示A.f菌浸出电子废弃物中金属的机理做准备。
1 材料与方法
1.1 材料
实验用菌种筛选自江西德兴某铜矿酸性废水中,所用9K培养基成分包括:(NH4)2SO43.0 g, K2HPO40.5 g,MgSO40.5 g,KCl 0.1 g,Ca(NO3)20.01 g,FeSO4·7H2O 42 g,去离子水1 L。培养液经H2SO4调节初始pH值为2.0,所得菌种经16S RNA鉴定为A.f菌[10]。驯化用覆铜板购自上海某线路板厂。实验过程中使用的其他试剂主要有EDTA、氢氧化钠、蒽酮、葡萄糖、无水碳酸钠、酒石酸钠、碳酸氢钠、硫酸铜、牛血清白蛋白、二苯胺、冰醋酸、脱氧-D-核糖、2,2’-联喹啉-4,4’-二羧酸。
1.2 方法
1.2.1 EPS提取法
分别用离心法、超声法、EDTA法、氢氧化钠法4种方法对驯化前后的A.f菌EPS进行提取。每种提取方法的优劣以胞外聚合物提取后细胞的破壁程度来表征,即溶液中测得的核酸量越大,细胞破裂的程度就越大,其对应的提取方法越差[11]。
1.2.2 EPS成分分析法
本实验针对每种提取方法得到的EPS进行了成分分析。采用Bicinchoninic Acid(BCA)法测定EPS中蛋白质的含量[12],蒽酮法测定EPS中多糖的含量[13],二苯胺法测定EPS中核酸(DNA)的含量[14]。实验过程中得到的数据采用Excel及Origin8.0软件进行处理。
2 结果与分析
2.1 EPS提取效率
前期的研究结果表明,A.f菌在9K培养基中生长4~5天后可达到稳定期[15]。实验过程中设置对照组,以覆铜板作为驯化因子对其中一组菌种做驯化处理,另一组不做处理。待A.f菌正常生长至第5天时,分别用不同方法提取其EPS,结果如图1所示。当A.f菌不做驯化处理时,用超声法提取的EPS含量最高,达到37.1 mg·g-1,用NaOH法提取的EPS含量最少,只有24.5 mg·g-1,两者差了12.6 mg·g-1;而当A.f菌经过驯化处理后,相应地,超声法提取的EPS含量变为55.3 mg·g-1,NaOH法提取的EPS含量则为39.6 mg·g-1。从2种条件下提取的EPS含量来看,不论A.f菌驯化与否,用超声法都能提取最多的EPS含量,而NaOH法提取的EPS含量最少。此外,驯化后,A.f菌EPS的提取量得到了不同程度的增加。有研究表明,微生物EPS的分泌可以降低外界环境对该微生物正常生长的影响,并且外界环境越恶劣,其分泌的EPS就越多[16]。Jiao等[17]研究表明,在细菌浸出矿物时,细菌EPS除了含有蛋白质、多糖、核酸等大分子有机物外,还含有无机金属离子。在本实验中,向培养液中加入覆铜板作为驯化因子,因培养液中Cu2+含量的不断增加,一方面,A.f菌需要不断地产生EPS来抵抗外界环境的影响,另一方面,增加的Cu2+含量也会被EPS所吸附,最终导致产生的EPS含量高于未驯化的A.f菌。这一现象可以被前人的研究结果很好的解释。
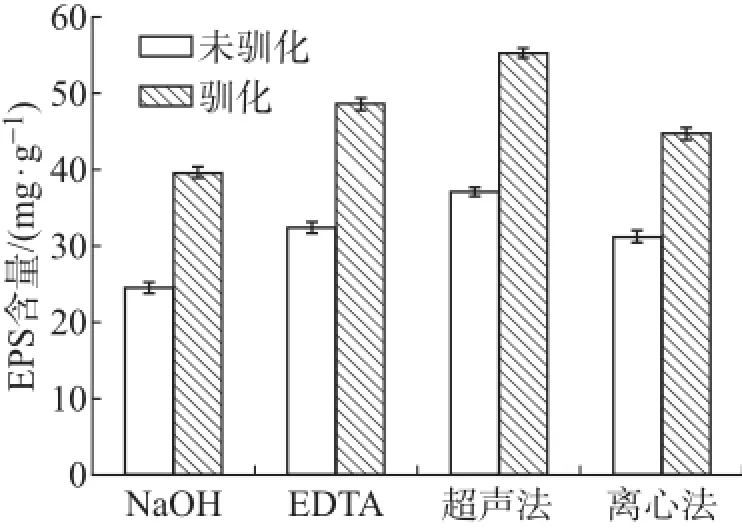
图1 不同方法提取A.f菌EPS含量对比Fig.1Comparison of EPS contents in different extraction methods
2.2 EPS提取效果
不同提取方法会导致提取的EPS成分及含量有所差别。由于溶液中DNA的含量只能来源于已破裂的细胞,因此,测溶液中DNA的含量可以反映出每种提取方法对细胞本身的破坏程度。Liao等[18]研究认为,溶液中DNA在EPS中的比例在2%~15%内属正常。因而DNA在EPS中的比例常常被用来判断每种提取EPS方法的优劣。本实验对于溶液中核酸含量的测定结果如图2所示。在A.f菌未驯化组中,NaOH法提取的EPS中核酸含量高达17.3%,这已超出其正常范围,超声法提取的EPS中核酸含量则为8.7%;而在A.f菌驯化组内,NaOH法提取的EPS中核酸含量为14.1%,较驯化前有了一定程度的下降,超声法提取的EPS中核酸含量则变为8.1%。从图中可以看出,A.f菌驯化组内,不同方法提取的EPS中核酸含量普遍低于A.f菌未驯化组。可能的原因为A.f菌驯化后,其对Cu2+的抗性增强,A.f菌细胞自身不容易破裂,导致溶液中核酸含量普遍低于A.f菌未驯化组。4种提取方法中,除了NaOH法在提取过程中对A.f菌自身伤害较大外,其余3种方法提取的A.f菌EPS中含有的核酸含量基本都在10%左右。结合已得到的结论,即超声法对于A.f菌EPS的提取效率最高,在本次对比实验中,超声法在提取A.f菌EPS的过程中,在提取出较多EPS的同时,对A.f菌自身伤害最小。因此,后续在提取A.f菌EPS时,可以选择超声波法高效温和的提取。

图2 不同方法提取A.f菌EPS中核酸含量对比Fig.2Comparison of nucleic acid contents in different extraction methods
2.3 EPS成分分析
分别采用蒽酮法、BCA法、二苯胺法测定A.f菌EPS中多糖、蛋白质、核酸的浓度。相应标准物质在不同波长条件下吸光度的线性关系如图3所示。

图3 相应标准物质在不同波长条件下的吸光度曲线Fig.3The absorbancy curves of standard substances under different wavelengths
由图3(a)可见,葡萄糖含量与625 nm波长下的吸光度线性关系可近似拟合成:

式中,相关系数R2=0.997>0.99,说明该标准曲线拟合程度较好[19],可以用作本次实验A.f菌EPS中多糖含量的测定。
图3(b)表示的是不同蛋白质含量在650 nm波长下吸光度的标准曲线,可由下列方程表示:

相关系数R2=0.995>0.99,说明该拟合方程适合本次实验A.f菌EPS中蛋白质含量的测定。
图3(c)表示的是不同核酸含量在595 nm波长下吸光度的标准曲线,线性方程如下:

相关系数R2=0.996>0.99,表明该线性方程可以用于本实验A.f菌EPS中核酸含量的测定。
依据图3中各标准曲线的方程,将实验过程中测得的A.f菌EPS样品中各有机物的吸光度分别代入其中,得到蛋白质、多糖、核酸在A.f菌EPS中的含量,结果如图4所示。

图4 不同方法提取A.f菌EPS中各有机物含量对比Fig.4Comparison of organic substance contents in different extraction methods
由图4可见,不论A.f菌驯化与否,其EPS中多糖的含量最高,其次是蛋白质,核酸含量在A.f菌EPS中最低。对于4种不同的提取方法,超声法提取的多糖含量高于其余3种方法。经计算,在未驯化的A.f菌中,超声法、EDTA法、离心法、NaOH法提取的EPS中多糖与蛋白质含量比例分别为3.26,3.49, 2.71,3.17,其多糖与蛋白质的比例范围在2.71~3.49之间。而在驯化的A.f菌中,对应的多糖与蛋白质含量比例分别为3.24,4.23,5.58,5.41,其多糖与蛋白质的比例范围则在3.24~5.58之间。这说明A.f菌驯化与否对其EPS中多糖、蛋白质的含量会产生较大影响,特别是对驯化后的A.f菌EPS,其多糖与蛋白质的比例普遍高于未驯化处理组。产生这一现象可能的原因为驯化后A.f菌为了耐受更高Cu2+浓度,产生了更多的EPS来抵御高浓度Cu2+对A.f菌自身生长的影响。此外,多糖在EPS保护细菌自身生长过程中可能起到非常重要的作用。Gehrke等[20]的研究表明,A.f菌EPS中多糖的组成为:甘露糖、木糖、葡萄糖、鼠李糖、海藻糖等糖类。结合本实验的研究结果,可以通过模拟A.f菌EPS的形式来探索EPS对A.f菌浸出电子废弃物中金属的影响,排除了在浸出过程中,A.f菌自身对EPS产生的干扰。
3 结语
不论A.f菌驯化与否,NaOH法、EDTA法、超声法、离心法4种方法中,提取EPS效率最高的为超声法,驯化前后分别能提取到37.1 mg·g-1、55.3 mg·g-1的EPS。在提取过程中,超声法对A.f菌自身的伤害最小,驯化前后,培养液中检测到的核酸占比分别为8.7%、8.1%。4种提取方法在A.f菌驯化前后,提取的EPS中多糖与蛋白质的比例范围分别为2.71~3.49和3.24~5.58。依据前人的研究结果,结合本实验得到的相关数据,可通过模拟A.f菌EPS来探索EPS对A.f菌浸出电子废弃物中金属的影响。
[1]LASPIDOU C S,RITTMANN B E.A unif i ed theory for extracellularpolymericsubstances,solublemicrobialproducts,and active and inert biomass[J].Water Resource, 2002,36(11):2711-2720.
[2]SHENG G P,YU H Q,LI X Y.Extracellular polymeric substances(EPS)of microbial aggregates in biological waste water treatment systems:A review[J].Biotechnology Advances,2010,28(6):882-894.
[3]白建峰,顾卫华,张承龙,等.嗜酸氧化亚铁硫杆菌研究及在电子废弃物中应用进展[J].安全与环境学报, 2014(4):181-185.
[4]严杰能,许燕滨,段晓军,等.胞外聚合物的提取与特性分析研究进展[J].科技导报,2009,27(20):106-110.
[5]罗曦,雷中方,张振亚,等.好氧/厌氧污泥胞外聚合物(EPS)的提取方法研究[J].环境科学学报,2005,25(12): 1624-1629.
[6]曹勇.生物膜及活性污泥胞外聚合物的提取及其对重金属离子的吸附研究[D].安徽:安徽大学,2013.
[7]王利,温健康.嗜酸氧化亚铁硫杆菌胞外聚合物浸矿作用研究[J].金属矿山,2011,40(7):86-89.
[8]LAN Y R,ZHONG D L,MIAO L,et al.Relationship and effect of redox potential,jarosites and ectracellular polymeric substances in bioleaching chalcopyrite by Acidithiobacillus ferrooxidans[J].Transactions of Nonferrous Metals Society of China,2011,21(7):1634-1640.
[9]VEIT,HUGO M,MOURA B,et al.Electronic waste recycling techniques[M].Berlin,Germany:Springer,2015:87-127.
[10]WANG J W,BAI J F,XU J Q,et al.Bioleaching of metals from printed wire boards by Acidithiobacillus ferrooxidans and Acidithiobacillus thiooxidans and their mixture [J].Journal of Hazardous Materials,2009,172(2/3):728-734.
[11]葛利云,王红武,马鲁铭,等.好氧活性污泥胞外聚合物的影响因素研究[J].环境科学与技术,2007,30(2):8-9.
[12]WEI X,FANG L C,CAI P,et al.Inf l uence of extracellular polymeric substances(EPS)on Cd adsorption by bacteria [J].Environmental pollution,2011,159(5):1369-1374.
[13]ADAV S S,LEE D J,TAY J H.Extracellular polymeric substances and structural stability of aerobic granule[J]. Water Research,2008,42(6/7):1644-1650.
[14]ADAV S S,LEE D J,LAI J Y.Effects of aeration intensity on formation of phenol-fed aerobic granules and extracellular polymeric substances[J].Applied Microbiology and Biotechnology,2007,77(1):175-182.
[15]GU W H,BAI J F,DAI J,et al.Characterization of extreme acidophile bacteria(Acidithiobacillus ferrooxidans) bioleaching copper from f l exible PCB by ICP-AES[J]. Journal of Spectroscopy,2014(33):1-8.
[16]BO F,RIKKE P,KRISTIAN K,et al.Extraction of extracellular polymers from activated sludge using a cation exchange resin[J].Water Research,1996,30(8):1749-1758.
[17]JIAO Y,CODY G D,HARDINGA K,et al.Characterization of extracellular polymeric substances from acidophilic microbial biof i lms[J].Applied and Environmental Microbiology,2010,76(9):2916-2922.
[18]LIAO B Q,ALLEN D G,DROPPO I G,et al.Surface properties of sludge and their role in biof l occulation and settleability[J].Water Research,2001,35(2):339-350.
[19]蒋勗欣,李军,马挺,等.好氧污泥颗粒化中胞外聚合物(EPS)的动态变化[J].环境科学学报,2014,34(5):1192-1198.
[20]GEHRKE T,TELEGDI J,THIERRY D,et al.Importanceofextracellularpolymericsubstancesfromthiobacillusferrooxidans for bioleaching[J].Applied and Environmental Microbiology,1998,64(7):2743-2747.
Comparison on Different Methods Extracting Extracellular Polymeric Substances from Acidithiobacillus ferrooxidans
GU Weihua,BAI Jianfeng,LU Liang,ZHANG Jiena,WANG Jingwei
(a.WEEE Research Centre;b.Shanghai Collaborative Innovation Centre for WEEE Recycling,Shanghai Polytechnic University,Shanghai 201209,China)
Many methods can extract extracellular polymeric substances(EPS)from Acidithiobacillus ferrooxidans(A.ferrooxidans), and the components and contents are different when treated with different methods.The variation of EPS components and contents was obtained,and the high eff i ciency of extracting EPS from A.ferrooxidans was also analyzed through comparing the methods of NaOH,EDTA,ultrasound and centrifugation in extracting EPS from A.ferrooxidans.The experimental results indicated that ultrasound method could extract the highest EPS content,and there were 37.1 mg·g-1,55.3 mg·g-1EPS in the unacclimated and domesticated A.ferrooxidans groups,respectively.Accordingly,the nucleic acid proportion was 8.7%and 8.1%respectively,which illustrated that ultrasound method was more friendly to A.ferrooxidans itself.The proportional regions of polysaccharide and protein were 2.71—3.49 and 3.24—5.58 in EPS which had already extracted by four extraction methods among the unacclimated and domesticated A.ferrooxidans groups.These results can provided a reference for exploring the effect of simulated EPS in A.ferrooxidans bioleaching metals from electronic waste.
electronic waste;Acidithiobacillus ferrooxidans;extracellular polymeric substances;extraction
Q89
A
1001-4543(2017)01-0001-05
10.19570/j.cnki.jsspu.2017.01.001
2016-11-23
白建峰(1978—),男,江苏泰兴人,教授,博士,主要研究方向为电子废弃物资源化、环境微生物技术、污染土壤修复。E-mail:jfbai@sspu.edu.cn。
国家自然科学基金项目(21307080),上海第二工业大学重点学科建设项目(XXKZD1602),上海第二工业大学校基金项目(EGD16XQD09)资助
