DFMG调节TLR4信号通路对氧化损伤的内皮细胞诱导巨噬细胞增殖的影响
2017-04-07杨舒婷王如波符晓华
杨舒婷,张 勇,王如波,曾 菲,符晓华
(湖南师范大学医学院心血管疾病研究室,长沙 410113)
DFMG调节TLR4信号通路对氧化损伤的内皮细胞诱导巨噬细胞增殖的影响
杨舒婷,张 勇,王如波,曾 菲,符晓华
(湖南师范大学医学院心血管疾病研究室,长沙 410113)
目的:观察7-二氟甲氧基-5,4’-二甲氧基金雀异黄素(DFMG)对氧化应激损伤人脐静脉内皮细胞(HUVE-12)诱导的THP-1(人单核细胞系)源性巨噬细胞(MΦ)增殖的影响及探索其可能的发生机制。方法:制备溶血性磷脂酰胆碱(LPC)氧化损伤HUVE-12与MΦ共培养模型,浓度梯度DFMG、TLR4特异性拮抗剂(CLI-095)、TLR4特异性激动剂(LPS)干预LPC氧化损伤HUVE-12与MΦ共培养;MTT法观察MΦ的增殖;western blot检测HUVE-12 TLR4蛋白的表达水平。结果:LPC氧化损伤HUVE-12诱导巨噬细胞增殖,DFMG抑制LPC氧化损伤HUVE-12诱导巨噬细胞的增殖,上调TLR4表达进一步促进LPC氧化损伤HUVE-12诱导巨噬细胞的增殖,下调TLR4表达抑制LPC氧化损伤HUVE-12诱导巨噬细胞的增殖。结论:DFMG可能通过下调LPC氧化损伤HUVE-12的TLR4蛋白表达水平,抑制炎症反应,从而抑制巨噬细胞增殖。
7-二氟甲氧基-5,4’-二甲氧基金雀异黄素;人脐静脉内皮细胞;人单核细胞系源性巨噬细胞;共培养
动脉粥样硬化属于血管慢性炎症疾病,病理变化始发于内皮细胞损伤[1]。当血管内皮受损时低密度脂蛋白聚集在内皮下层,同时单核细胞粘附于内皮细胞并受趋化因子影响募集于内皮下层[2]。而这些单核细胞受血管微环境中的炎症因子诱导分化成为巨噬细胞并吞噬脂滴,形成泡沫细胞[3,4]。泡沫细胞凋亡或者裂解的碎片聚集在一起形成粥样斑块[5]。内皮细胞和其周围基质细胞的相互作用贯穿动脉粥样硬化的发生与发展的全过程,而与单核巨噬细胞的相互作用最为关键[6,7]。
DFMG是本课题组自主设计、合成并筛选得到的一种活性新化学实体(专利号:ZL200710104389. 4),前期研究表明,DFMG可以有效降低TNF-α损伤HUVE-12诱导THP-1迁移黏附于内皮细胞的作用[8]。本实验旨在探讨DFMG对氧化应激损伤人脐静脉内皮细胞(HUVE-12)诱导的THP-1(人单核细胞系)源性巨噬细胞(MΦ)增殖的影响及其可能的发生机制。
1 材料与方法
1. 1 材料与试剂 人脐静脉内皮细胞(human umbilical vein endothelial cells. HUVE-12)购自武汉市中国典型培养物保藏中心。人单核细胞(THP-1)购于中国科学院上海细胞生物学研究所细胞库。DFM G由本实验室合成并保存;LPC购自美国 Sigma公司;TLR4、NFkBp65一抗均购买于中国proteintech公司;GAPDH一抗购自中国CMCTAG公司;Transwell共培养板购自美国康宁公司。
1.2 实验方法与步骤
1.2.1 氧化损伤内皮细胞与THP-1源性巨噬细胞共培养模型的制备 HUVE-12 1×104种板与0.4μm Transwell上,融合度至60%左右加LPC(0,10,20,30,40,50μM)处理24h,弃掉含LPC培基,与50ng/L PMA诱导THP-1 96h后极化形成的MФ共培养。模型的最佳浓度通过统计学分析HUVE-12活性氧含量,western blot检测NF-kBp65的表达水平得到。DFMG与CLI-095、LPS都是预孵育30min后,再加最佳浓度LPC处理。
1.2.2 ROS检测HUVE-12活性氧含量 HUVE-12以1×104种板于24孔板,过夜贴壁后,用不同浓度LPC损伤HUVE-12 24h后,换含10%胎牛血清的新鲜培基继续孵育24h按照1:1000用无血清培养基稀释DCFH-DA,使终浓度为10μM。去除细胞培养液,加入500μl稀释好的的DCFH-DA。37℃细胞培养箱内孵育20分钟。用无血清培养基洗涤细胞三次,充分去除未进入细胞内的DCFH-DA。488nm激发波长,525nm发射波长检测荧光强度。计算得到单位荧光强度。
1.2.3 MTT检测MФ增殖情况 用24孔板Transwell得到上述1.2描述的共培养模型,将MTT粉末用PBS配成5mg/mL工作液,避光储存。PBS洗涤MФ 3次,24孔板中MTT工作液1ml,37℃培养箱孵育4h,PBS洗涤3次,DMSO1.5mL充分摇晃溶解10min,490nm检测OD值。
1.2.4 Western Blot检测HUVE-12 TLR4、NF-kBp65的表达量 收集各组细胞,RIPA 裂解,BCA 法测定蛋白浓度,100℃变性5min,每孔蛋白上样量为20μg。蛋白电泳到凝胶底部,200MA,1.5h冰上转至PVDF 膜;5% 脱脂奶粉室温封闭1h;一抗(GAPDH 1:10000;NF-kBp65 1:2500;TLR4 1:1000)4℃孵育过夜;PBST洗3次,10min/次;二抗(1:10000)室温孵育1h;洗膜;显影。GAPDH为内参对照,NF-kBp65、TLR4蛋白相对表达量以其灰度值与GAPDH的灰度值相比得到。
1.2.5 统计学分析 采用SPSS13.0 统计软件对数据进行方差齐性检验、单因素方差分析的统计学分析。若方差齐,则使用SNK法进行多样本之间的两两比较,若方差不齐,则使用Dunnett-t进行多样本之间的两两比较。当P<0.05则认为差异具有统计学意义。
2 结果
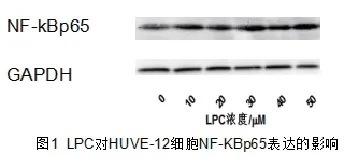
2.1 LPC氧化损伤HUVE-12上调NF-kBp65的表达水平 如图1所示,LPC损伤HUVE-12细胞NF-kBp65蛋白表达明显升高,在LPC为30μM时表达量与0μMLPC组相比有统计学差异(P<0.05),且NF-kBp65表达量与LPC浓度呈剂量依赖性上调。
2.2 LPC氧化损伤HUVE-12促进活性氧的释放 如图2所示,LPC损伤HUVE-12细胞释放活性氧的量明显增加,在LPC为20μM时活性氧释放量与0μMLPC组相比有统计学差异(P<0.05),且释放量与LPC浓度呈剂量依赖性下降。
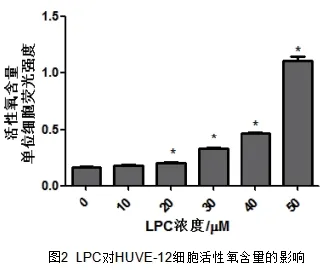
与0μMLPC组比较,P<0.05.
2.3 共培养条件下LPC、LPS对MФ增殖的影响如图3所示,共培养条件下30μMLPC孵育HUVE-12后促进了MФ的增殖,与空白组相比有统计学差异(P<0.05),LPS进一步促进MФ的增殖情况,与30μMLPC组相比差异有统计学意义(P<0.05)。
2.4 共培养条件下DFMG、CLI-095对MФ增殖的影响 如图3所示,在共培养条件下,DFMG和CLI-095抑制了LPC诱导MФ增殖,0.3μM DFMG+30μMLPC组、CLI-095+30μMLPC组与30μMLPC组比较差异有统计学意义(P<0.05),且与DFMG呈浓度依赖性。3.0μMDFMG也可以逆转LPS进一步促进增殖作用,3.0μMDFMG+LPS+30μM LPC组与LPS+30μM LPC相比有统计学(P<0.05).
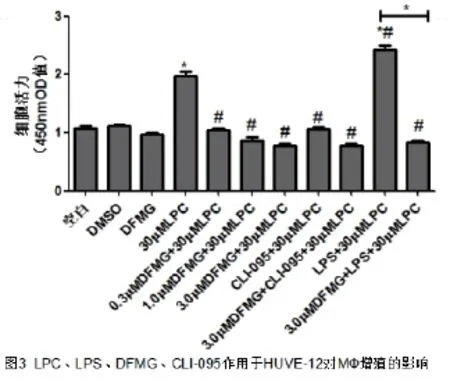
与空白、DMSO、DFMG组比较,*P<0.05,与LPC组比较,#P<0.05,表示相邻两组比较P<0.05。
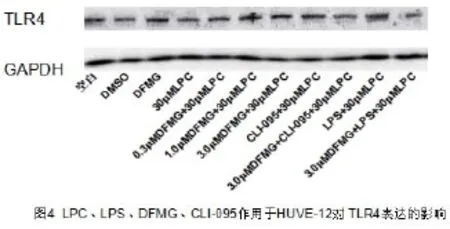
2.5 共培养模型中LPC、LPS作用对HUVE-12细胞TLR4表达影响 如图4所示,30μM LPC显著上调HUVE-12细胞TLR4蛋白的表达量,与空白对照组相比有统计学意义(P<0.05),LPS进一步上调HUVE-12细胞TLR4的表达量,与30μMLPC组相比有统计学差异(P<0.05)。
2.6 共培养模型中DFMG、CLI-095对HUVE-12细胞TLR4的表达影响 如图4所示,DFMG、CLI-095逆转了LPC上调HUVE-12细胞TLR4蛋白的表达水平,1.0μMDFMG+30μMLPC、CLI-095+30μMLPC与30μMLPC相比有统计学差异(P<0.05),并与DFMG呈浓度依赖性。3.0μMDFMG也可以逆转LPS进一步促进TLR4表达上调的作用,3.0μMDFMG+LPS+30μMLPC组与LPS+30μMLPC相比有统计学差异(P<0.05)。
3 讨论
动脉粥样硬化斑块中TLR4是内皮细胞、平滑肌细胞释放炎症因子的重要调节器,ox-LDL损伤内皮细胞上调TLR4表达,在体内敲除TLR4,可以有效降低小鼠对巨噬细胞细胞的募集[9]。TLR4对巨噬细胞活化、胞吞、聚集脂滴形成泡沫细胞都发挥枢纽作用[10]。受损的内皮细胞与其周围基质细胞的相互作用促进了动脉粥样硬化的发生发展[11],Ian W. Tattersall[6]利用Transwell共培养技术在体外构建内皮细胞与巨噬细胞相互作用的模型,所以本实验采用Transwell共培养模型在体外模拟动脉粥样硬化时内皮细胞与巨噬细胞相互作用。
我们根据HUVE-12细胞NF-kBp65的表达水平和活性氧的含量来选用合适浓度的LPC制备氧化损伤HUVE-12与THP-1源性MФ共培养的模型。我们发现用不同浓度LPC损伤HUVE-12 24h后去除含LPC培基继续孵育24h,在LPC浓度为30μM时HUVE-12细胞NF-kBp65的表达量显著上升,并呈浓度依赖性。在LPC浓度为20μM时HUVE-12的活性氧含量显著增加,呈浓度依赖性。为确定LPC氧化损伤HUVE-12的作用,我们选用30μM LPC氧化损伤HUVE-12与MФ共培养,此体外共培养模型模拟氧化损伤后的内皮细胞通过旁分泌释放炎症因子引发巨噬细胞的功能改变,排除了LPC对MФ的直接诱导作用,而是通过损伤HUVE-12后促进MФ增殖,模拟动脉粥样硬化发展过程中氧化损伤的内皮细胞诱导巨噬细胞炎症的微环境,本实验构建的体外模型于文献报导一致[6]。
30μMLPC组与空白组相比,LPC损伤HUVE-12后显著上调MФ的增殖,而不同浓度DFMG预孵育HUVE-12后,再用30μMLPC损伤,DFMG以剂量依赖性降低了受损HUVE-12对MФ的增殖,该实验证实:DFMG可能通过保护内皮损伤,从而抑制MФ增殖。TLR4特异性激动剂(LPS)可以进一步促进MФ的增殖,Western blot结果显示LPC和LPS都上调TLR4的表达。CLI-095是新型特异性TLR4拮抗剂,通过抑制TLR4表达阻断下游炎症因子的释放,抑制脂质的摄取,在体外具有抗内皮损伤作用,体内具有抗动脉粥样硬化形成的潜在作用,CLI-095拮抗LPC和LPS上调TLR4表达与文献报导一致[12,13]。本实验结果显示CLI-095拮抗LPC损伤HUVE-12从而进一步抑制损伤HUVE-12诱导MФ增殖的作用。LPC损伤HUVE-12之前用DFMG预孵育30min,在拮抗LPC和LPS上调TLR4表达的同时抑制MФ的增殖,与CLI-095作用类似,本实验结果证明DFMG可能与CLI-095一样通过下调受损HUVE-12的TLR4表达抑制MФ增殖。
文献报导多种因素可以上调TLR4表达,促进内皮损伤及动脉粥样硬化的形成,而抑制TLR4表达可以抗动脉粥样硬化形成[14]。本实验结果证明LPC和LPS上调HUVE-12细胞的TLR4表达,促进MФ的增殖,DFMG和CLI-095下调HUVE-12细胞的TLR4表达,抑制MФ的增殖。初步证明DFMG可能通过下调受损HUVE-12的TLR4表达抑制MФ增殖,从而发挥抗炎作用,但是DFMG对共培养系统中MФ的吞噬功能的影响和其具体机制有待进一步的研究。
[1] Suzuki Y, Tada-Oikawa S, Hayashi Y, et al. Single- and double-walled carbon nanotubes enhance atherosclerogenesis by promoting monocyte adhesion to endothelial cells and endothelial progenitor cell dysfunction[J]. Particle and Fibre Toxicology.2016 Oct 13; 13(1): 54.
[2] Sovershaev TA, Egorina EM, Unruh D, et al. A novel role of bone morphogenetic protein-7 in the regulation of adhesion and migration of human monocytic cells[J]. Thromb Res.2016 Nov; 147: 24-31.
[3] Ramachandran S, Vinitha A, Kartha CC. Cyclophilin A enhances macrophage differentiation and lipid uptake in high glucose conditions: a cellular mechanism for accelerated macro vascular disease in diabetes mellitus[J]. Cardiovasc Diabetol.2016 Nov 3; 15(1): 152.
[4] Giunzioni I1, Bonomo A1, Bishop E, et al. Cigarette smoke condensate affects monocyte interaction with endothelium[J]. Atherosclerosis, 2014 , 234(2): 383-390.
[5] Cao Y1, Long J1, Ji Y1, et al. Foam cell formation by particulate matter(PM)exposure: a review[J]. Inhal Toxicol, 2016, 28(13): 583-590.
[6] Tattersall IW, Du J, Cong Z, et al. In vitro modeling of endothelial interaction with macrophages and pericytes demonstrates Notch signaling function in vascular microenvironment[J]. Angiogenesis, 2016, 19(2): 201-15.
[7] Yahagi K, Kolodgie FD, Lutter C, et al. Pathology of Human Coronary and Carotid Artery Atherosclerosis and Vascular Calcification in Diabetes Mellitus[J]. Arterioscler Thromb Vasc Biol(in press), 2016, Dec 1.
[8] 张婧, 张勇, 刘诗炜,等. DFMG对内皮细胞COX-2表达和黏附功能的影响[J]. 湖南师范大学学报(医学版), 2015, 02: 1-4.
[9] Roshan MH, Tambo A, Pace NP. The Role of TLR2, TLR4, and TLR9 in the Pathogenesis of Atherosclerosis[J]. Int Jf Inflam, 2016: 1532832.
[10] Yao S1, Tian H1, Zha L, et al. Oxidized high-density lipoprotein induces macrophage apoptosis via toll-like receptor 4-dependent CHOP[J]. Lipid Res(in press), 2016 Nov 28.
[11] Li Y, Guo Y, Chen Y, et al. Establishment of an interleukin-1betainduced inflammation-activated endothelial cell-smooth muscle cellmononuclear cell co-culture model and evaluation of the anti-inflammatory effects of tanshinone IIA on atherosclerosis[J]. Mol Med Rep, 2015, 12(2): 1665-76.
[12] Tsui-Chun Tsoua, Saou-Hsing Lioua, Szu-Ching Yeh, et al. Crucial role of Toll-like receptors in the zinc/nickel-induced inflammatory response in vascular endothelial cells[J]. Toxicology and Applied Pharmacology, 2013; 273(3): 492-499.
[13] Wang XQ1, Wan HQ2, Wei XJ3, et al. CLI-095 decreases atherosclerosis by modulating foam cell formation in apolipoproteinE-deficient mice[J]. Mol Med Rep.2016; 14(1): 49-56.
[14] Barua RS, Sharma M, Dileepan KN. Cigarette Smoke Amplifies Inflammatory Response and Atherosclerosis Progression Through Activation of the H1R-TLR2/4-COX2 Axis[J]. Frontiers in Immunology, 2015; 6: 572.
DFMG inhibited Proliferation of MФ by LPC-induced Injured HUVE-12 through Depressing TLR4
Yang Shu-ting , Zhang Yong , Wang Ru-bo , Zeng Fei , Fu Xiao-hua
(Medical College of rlunan Normal University , Chang sha 410006 , China)
Objective To observe whether the change of TLR4 expression in the oxidation-damaged Human umbilical vein endothelial cells(HUVE-12)regulated by 7-Difluoromethyl-5, 4’-dimethoxygenistein(DFMG)can influence the proliferation THP-1 derived Macrophages(MΦ). Methods Oxidation-damaged HUVE-12-MΦ co-culture model was prepared which intervened by concentration gradient DFMG、CLI-095、LPS . Proliferation of was detected by 3-(4, 5-dimethiazol-2yl)-2, 5-diphenyltetrazolium bromide(MTT). The expression level of NF-kBp65, TLR4 was detected by western blot. Results DFMG concentration-dependently reduced proliferation of MΦ which was induced by oxidation-damaged HUVE-12. Conclusion DFMG inhibited proliferation of MФ by LPC-induced injured HUVE-12 may through depressing TLR4.
7-Difluoromethyl-5, 4’-dimethoxygenistein; Human umbilical vein endothelial cells; THP-1 derived Macrophages; co-culture
R725.6
A
1673-016X(2017)01-0001-04
2016-12-13
国家自然科学基金资助项目(81370382)
符晓华,E-mail:fuxh1@126.com
