大孔树脂对刺葡萄酒渣中提取的白藜芦醇的纯化工艺研究
2017-04-07吴佳王燕刘婷宁毅龙
吴佳,王燕*,刘婷,宁毅龙
大孔树脂对刺葡萄酒渣中提取的白藜芦醇的纯化工艺研究
吴佳1,王燕1*,刘婷2,宁毅龙1
(1.湖南农业大学食品科技学院,湖南长沙410128;2.中国检验认证集团湖南有限公司,湖南长沙410128)
通过静态吸附-解吸试验从6种大孔树脂中筛选出最适合刺葡萄酒渣中白藜芦醇纯化的大孔树脂,并对其进行静态、动态吸附-解吸工艺条件优化,结果表明:供试树脂中,大孔树脂H103为最适树脂,其静态吸附-解吸最优条件为:上样液质量浓度为0.65 mg/mL,上样液pH值为3,洗脱液为体积分数70%乙醇;动态吸附-解吸最优条件为:上样流速1.5 mL/min,上样液体积6 BV;洗脱流速0.5 mL/min,洗脱液体积6 BV,在此条件下,树脂H103对白藜芦醇的吸附量为55.7 mg/g,解吸率为89.86%,经树脂H103纯化后,样品纯度由11.54%提高至59.76%。
刺葡萄;纯化;提取;白藜芦醇
白藜芦醇是一种含有芪式结构的多酚类化合物,天然的白藜芦醇有顺、反两种结构,自然界中主要以反式构象(生理活性强于顺式异构体)存在,两种结构都可与葡萄糖结合,分别形成顺式和反式白藜芦醇糖苷[1-2]。白藜芦醇存在于葡萄、虎杖、花生、桑椹、松树、朝鲜槐等12科、31个属的72种植物中,在葡萄中含量较高,葡萄中的白藜芦醇主要存在于果皮、种子和葡萄藤中,果肉中几乎没有[3]。研究表明,白藜芦醇具有抗肿瘤、抗过敏、抗心血管疾病、抗血小板聚集、抗病原微生物等[4-7]多种生理及药理活性,已被喻为继紫杉醇后又一新的绿色抗癌药物[8-9]。因其显著的抗癌、降血压、预防心血管疾病等功效受到国内外学者的广泛关注[10-11],有关白藜芦醇的体内抗氧化活性研究已有较多报道。
刺葡萄(Vitis davidiiFoex)是我国南方主要野生葡萄品种之一,其果实具有产量高、果汁丰富、酸甜适度等优点,但果粒小、果皮厚、果籽多,不便作为鲜食,但却为酿酒的好原料[12],因此蓬勃发展的葡萄酒产业也带来了大量副产物——葡萄酒渣,约占葡萄加工总量的20%~30%[13]。常年来由于我国葡萄酒生产的季节性强及技术研究的不足,这些废弃物往往来不及处理就被随意抛弃或作为废料处理,造成了极大的环境污染和资源浪费,因此,开发一种经济高效的刺葡萄酒渣综合利用技术,变废为宝,具有重要的社会意义和经济价值。
大孔吸附树脂是一类以丙酸酯和苯乙烯为单体,外加制孔剂与交联剂形成的具有多孔骨架结构的有机高分子聚合物,具有选择性好、吸附容量大、解吸条件温和、再生简便、成本低、使用寿命长等优点,被广泛应用于天然生物活性物质的分离纯化[14]。本试验从六种大孔树脂中筛选出适合分离酿酒刺葡萄酒渣中白藜芦醇的大孔树脂,采用静态试验与动态试验相结合的方法,对大孔吸附树脂分离纯化白藜芦醇的工艺进行优化,为刺葡萄酒渣白藜芦醇的工业化生产提供理论基础。
1 材料与方法
1.1 材料与试剂
刺葡萄酒渣(紫秋刺葡萄):湖南华淳庄园酒业有限公司;无水乙醇(分析纯):国药集团化学试剂有限公司。
NKA-9型、HPD500型、H103型、ADS-5型、AB-8、D101型大孔树脂:河南郑州勤实科技有限公司。
1.2 仪器与设备
Agilent 1100 Series高效液相色谱仪:安捷伦科技有限公司;SHZ-D(Ⅲ)循环水式多用真空泵:天津华鑫仪器厂;B-260恒温水浴锅:上海亚荣生化仪器厂;RE52CS-1旋转蒸发器:上海亚荣生化仪器厂;TS-200B恒温摇床:上海天呈实验仪器制造有限公司;HL-2B数显恒流泵:上海沪西分析仪器厂有限公司。
1.3 方法
1.3.1 刺葡萄酒渣白藜芦醇提取液的制备
按照刘婷等[15]研究得出的从刺葡萄酒渣中提取白藜芦醇的超临界CO2萃取的最优工艺条件,即在萃取温度32℃,萃取压力36500kPa,萃取时间1.40h,夹带剂用量3.38 mL/g条件下,制备白藜芦醇提取液。然后于48℃条件下真空旋转蒸发至无醇味,回收乙醇,浓缩液用13 mL体积分数30%乙醇溶解,抽滤后得白藜芦醇粗提液,在4℃冷藏备用。
1.3.2 白藜芦醇含量的测定
(1)色谱条件参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》,最终确定高效液相色谱测定条件为:Hypersil ODS C18色谱柱(250 mm×4.5 mm,5 μm);流动相:乙腈+重蒸水(30∶70);柱温:21℃;流速:1.0 mL/min;检测波长:306 nm;进样量:10 μL。
(2)标准曲线制作:精确称取2.000 mg反式白藜芦醇苷标准品于10 mL棕色容量瓶中,加乙醇溶解,定容,得质量浓度为200μg/mL的反式白藜芦醇苷标准储备液。分别准确吸取0.25 mL、0.50 mL、1.00 mL、2.00 mL、4.00 mL于5个不同的10 mL棕色容量瓶中,用乙醇定容,摇匀得5 μg/mL、10 μg/mL、20 μg/mL、40 μg/mL、80 μg/mL的反式白藜芦醇苷系列标准液。取10 μL在上述色谱条件下进样,以吸收峰面积值(y)为纵坐标,反式白藜芦醇苷质量浓度(x,μg/mL)为横坐标绘制标准曲线,得回归方程:y=67.4742x+45.87797(R2=0.999 37)。
(3)样品测定:吸取待测液10 μL,在上述色谱条件下测定,重复3次。用外标法计算出待测液中白藜芦醇的质量浓度,按下式计算含量:

1.3.3 大孔树脂预处理
取适量树脂,用无水乙醇浸泡24 h,使其充分溶胀,再用无水乙醇冲洗树脂,直至流出液用2倍体积水稀释不呈现白色浑浊,且在200~400 nm波长范围内进行紫外扫描,无杂质吸收峰(除乙醇外),蒸馏水洗尽乙醇,然后用2 BV 1 mol/L的HCL溶液浸泡树脂2 h,蒸馏水冲洗至流出液pH为中性,再用2 BV 1 mol/L的NaOH溶液浸泡树脂2 h,然后用蒸馏水冲洗至流出液pH为中性,将树脂保存于无水乙醇中待用,使用前用蒸馏水洗净乙醇。
1.3.4 大孔吸附树脂的筛选
准确称取经预处理的六种大孔树脂NKA-9、HPD500、H103、ADS-5、AB-8、D101各0.5 g,分别装入150 mL的具塞锥形瓶中,加入等浓度的白藜芦醇粗提液50 mL,在45℃、180r/min条件下,于恒温摇床上振荡12 h,取出静置90 min,上清液过0.22 μm有机微孔滤膜,高效液相色谱(high performance liquid chromatography,HPLC)法测定白藜芦醇的质量浓度,按公式2和公式4分别计算吸附量(Qe)和吸附率(E)。将吸附平衡后的大孔树脂过滤,蒸馏水洗净树脂至表面无残留液,加入体积分数70%乙醇50 mL于各瓶中进行解吸,在45℃、180 r/min条件下,于恒温摇床上振荡12 h,上清液过0.22 μm有机微孔滤膜,HPLC法测定白藜芦醇的质量浓度,按公式3和公式5分别计算解吸量(Qd)和解吸率(D)。根据吸附量与解吸率筛选出最佳分离纯化树脂。相关计算公式如下:

式中:Qe为吸附量,mg/g;Qd为解吸量,mg/g;E为吸附率;D为解吸率;C0为初始质量浓度,mg/mL;C1为吸附平衡后浓度,mg/mL;C2为解吸液质量浓度,mg/mL;V为吸附液体积,mL;V1为解吸液体积,mL。
1.3.5 静态吸附与解吸试验
(1)静态吸附动力学研究
准确称取6份经预处理的筛选出的最优树脂0.5 g,加入质量浓度为0.309 mg/mL的白藜芦醇粗提液50 mL,置于45℃、180 r/min的恒温摇床内振荡,每隔1 h吸取少量上清液,过0.22 μm有机微孔滤膜,HPLC法测定上清液中白藜芦醇的质量浓度。
(2)静态吸附等温曲线
准确称取0.5g经预处理的最优树脂6份,分别加入质量浓度为0.10 mg/mL、0.21 mg/mL、0.32 mg/mL、0.43 mg/mL、0.54 mg/mL、0.65 mg/mL、0.75 mg/mL、0.86 mg/mL的白藜芦醇粗提液,置于25℃、35℃、45℃的恒温摇床内振荡(均为180r/min)3h,取上清液,过0.22μm有机微孔滤膜,HPLC法测定上清液中白藜芦醇的质量浓度。
(3)上样液pH值对树脂吸附的影响
准确称取经预处理的最优树脂8份,每份0.5 g,装于150 mL具塞锥形瓶中,加入0.65 mg/mL白藜芦醇粗提液50 mL,分别加入用1 mol/L的盐酸溶液和1 mol/L的氢氧化钠溶液将pH值分别调节为2、3、4、5、6、7、8、9,置于25℃、180 r/min的恒温摇床内振荡3 h,取上清液,过0.22 μm有机微孔滤膜,HPLC法测定上清液中白藜芦醇的质量浓度。
(4)乙醇体积分数对树脂解吸的影响
准确称取同一批吸附平衡的树脂(蒸馏水洗净表面残留液)7份,每份0.5 g,装于150 mL具塞锥形瓶中,分别加入不同体积分数(30%、40%、50%、60%、70%、80%、95%)的乙醇50 mL,置于25℃、180 r/min的恒温摇床内振荡12 h,取上清液,过0.22μm有机微孔滤膜,HPLC法测定上清液中白藜芦醇的质量浓度。
(5)洗脱液pH对树脂解吸的影响
准确称取同一批吸附平衡的树脂(蒸馏水洗净表面残留液)6份,每份0.5 g,装于150 mL具塞锥形瓶中,分别加入体积分数70%乙醇50mL,用1mol/L的盐酸溶液和1mol/L的氢氧化钠溶液将pH值分别调节为3、4、5、6、7、8,置于25℃、180 r/min的恒温摇床内振荡12 h,取上清液,过0.22 μm有机微孔滤膜,HPLC法测定上清液中白藜芦醇的质量浓度。1.3.6动态吸附与解吸试验
(1)上样流速对树脂吸附的影响
准确称取经预处理的最优树脂4.5 g,湿法装柱,柱床体积为15 mL(1 BV),将质量浓度为0.65 mg/mL,pH=3的白藜芦醇粗提液20 BV,分别在0.5 mL/min、1.0 mL/min、1.5 mL/min、2.0 mL/min、2.5 mL/min、3.0 mL/min的流速条件下上样,收集不同流速下的流出液(5 mL/管),过0.22 μm有机微孔滤膜,HPLC法测定流出液中白藜芦醇的质量浓度,当流出液浓度达到上样液浓度的1/10时,认为已达到泄漏点。
(2)洗脱速率对树脂解吸的影响
准确称取经预处理的最优树脂4.5g,湿法装柱,柱床体积为15mL(1BV),使其吸附饱和,用蒸馏水清洗树脂至流出液中检测不到白藜芦醇,分别在0.25mL/min、0.5mL/min、1.0mL/min、1.5mL/min、2.0mL/min、2.5mL/min、3.0mL/min的流速下,以体积分数70%乙醇进行洗脱,收集不同流速下的洗脱液(5 mL/管),过0.22 μm有机微孔滤膜,HPLC法测定流出液中白藜芦醇的质量浓度。
1.3.7 样品纯度的测定
依照上述确定的纯化刺葡萄酒渣提取液中白藜芦醇的最佳吸附与解吸条件,进行三次平行试验。收集洗脱液,经48℃真空旋转蒸、真空冷冻干燥得纯化产物,准确称重后用体积分数80%的乙醇溶解,按1.3.2测定溶液中白藜芦醇含量,计算纯化产物中白藜芦醇的纯度。
2 结果与分析
2.1 大孔吸附树脂的筛选
大孔树脂是同时具有吸附性和筛选性的分离材料,吸附性主要取决于树脂与吸附质之间的范德华力,筛选性主要与树脂的多孔性结构有关。根据白藜芦醇的性质和相关资料,选择6种不同的树脂,考察其对葡萄酒渣中白藜芦醇的吸附与解吸效果。所选树脂的物理结构参数见表1。相同试验条件下,测得6种大孔树脂对白藜芦醇的静态吸附与解吸效果如图1所示。

表1 大孔树脂的物理结构参数Table 1 Physical structure parameters of macroporous resins

图1 大孔树脂的吸附量、解吸量及解吸率Fig.1 Adsorption/desorption capacity and desorption ratio of macroporous resins
白藜芦醇为多酚类化合物,具有3个酚羟基,呈弱极性,理论上更易被极性和弱极性树脂吸附。从图1中结果得出,非极性大孔树脂H103的平衡吸附量最大,吸附量大于极性和弱极性树脂,这可能是因为树脂H103具有远大于其他树脂的比表面积,一般树脂比表面积越大,越有利于吸附。比较各树脂的解吸量和解吸率,树脂H103解吸量最大,解吸率略小于树脂AB-8,综合考虑吸附性与解吸性能,选择树脂H103为最佳分离纯化树脂。
2.2 静态吸附与解吸试验
2.2.1 静态吸附动力学研究
以吸附时间为横坐标,白藜芦醇的吸附量为纵坐标,绘制静态吸附动力学曲线,见图2。由图2可知,树脂H103对白藜芦醇的吸附速率随着时间的增加而逐渐减慢,吸附时间到达3 h时,树脂基本趋于吸附平衡,此时,树脂对白藜芦醇的吸附率已达90.17%,此后,吸附量虽仍有增加,但增加量很小,且5 h后不再增加。综合考虑吸附率与工作效率,选取3 h为静态吸附时间。

图2 静态吸附动力学曲线Fig.2 Static adsorptive dynamics curves
2.2.2 静态吸附等温曲线
以白藜芦醇粗提液质量浓度为横坐标,吸附量为纵坐标,绘制25℃、35℃、45℃条件下的静态吸附等温曲线,见图3。由图可得,随着粗提液中白藜芦醇质量浓度的增加,树脂H103对白藜芦醇的吸附量也逐渐增大,当粗提液中白藜芦醇质量浓度达到0.65 mg/mL时,吸附量的增加趋于平缓,因此,选取0.65 mg/mL作为上样液质量浓度。此外,由图3可见,随着吸附温度的升高,各粗提液质量浓度对应的平衡吸附量均减小,但在25℃与35℃条件下,吸附量相差不大,因此,选取25℃作为吸附温度。

图3 静态等温吸附曲线Fig.3 Adsorptive isotherms at different temperatures
2.2.3 上样液pH值对树脂吸附的影响
大孔吸附树脂的吸附力不仅与树脂的比表面积及其与吸附质之间的范德华力有关,还与能否与吸附质形成氢键等有关,上样液pH对吸附量的影响见图4。由图4可得,在酸性条件下,大孔树脂H103对白藜芦醇的吸附量远大于其在碱性条件下的吸附量,且在pH=3时,白藜芦醇的吸附量最大。这可能是由于白藜芦醇为具有三个酚羟基的多酚类物质,呈弱酸性,在酸性条件下,以分子状态存在,其酚羟基易于与树脂H103形成氢键而被吸附。因此,选取pH=3为上样液最适pH值。
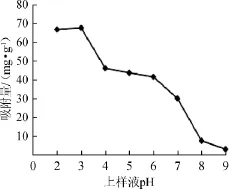
图4 上样液pH对吸附量的影响Fig.4 Effect of sampling pH on adsorptive capacity
2.2.4 乙醇体积分数对树脂解吸的影响
综合考虑洗脱特性及安全性因素,选取不同体积分数的乙醇作为解吸液进行研究,结果见图5。由图5可得,树脂H103对白藜芦醇的解吸率随着乙醇体积分数的增加而逐渐增大,当乙醇体积分数达到70%时,解吸率为93.76%,继续提高乙醇体积分数,解吸率增加不明显,考虑到生产成本及高体积分数乙醇易挥发的特点,选取体积分数70%乙醇溶液作为最适洗脱液。

图5 乙醇体积分数对解吸率的影响Fig.5 Effect of ethanol concentration on desorption ratio
2.2.5 洗脱液pH对树脂解吸的影响

图6 洗脱液pH对解吸率的影响Fig.6 Effect of eluate pH on desorption ratio
洗脱液pH对解吸率的影响见图6。由图6可得,在pH值较低的范围内,树脂H103对白藜芦醇的解吸率随着pH的上升而升高,pH=8时,解吸率最高,达到94.62%,此后,增大pH值,解吸率下降。这可能是由于白藜芦醇偏酸性,碱性条件比酸性条件更有利于其解吸,但又因白藜芦醇在碱性条件下不稳定,所以解吸率随洗脱液pH值的变化整体呈现出先增后减的趋势。选择pH=8条件下进行洗脱。
2.3 动态吸附与解吸试验
2.3.1 上样流速对树脂吸附的影响
上样流速对树脂吸附的影响见图7。由图7可知,随着上样流速的加快,通过树脂的流出液浓度上升也加快,泄漏点提前,说明树脂H103对白藜芦醇的吸附量随着流速的增加而降低。这是因为上样流速直接影响白藜芦醇向树脂内表面的扩散,当流速过快时,白藜芦醇分子来不及与树脂充分接触就随上样液一同流出,没有形成有效吸附,从而导致吸附量降低;当流速较慢时,白藜芦醇分子与树脂有充分的作用时间,有效利用了树脂的吸附活性中心,因而有利于吸附,但流速过慢会影响工作效率,导致试验周期延长。在试验中,流速为0.5 mL/min、1.0 mL/min与1.5 mL/min时,泄漏点都在6~7 BV之间,且吸附率都较高,分别为95.38%、94.15%和94.0%,继续加大流速,泄露点明显提前,且吸附率降低,综合考虑工作效率与树脂吸附性能,选取上样流速为1.5 mL/min,上样液体积为6 BV。

图7 上样流速对树脂吸附的影响Fig.7 Effect of different sampling flow rates on adsorption
2.3.2 洗脱流速对树脂解吸的影响

表2 洗脱流速对解吸率的影响Table 2 Effect of different flow rates on desorption ratio
洗脱流速对解析率的影响见表2。由表2可得,树脂H103对白藜芦醇的解吸率随着洗脱流速的增大而降低,在流速为0.5 mL/min与0.25 mL/min的洗脱条件下,解吸率相近,分别为93.71%与94.19%。这是由于洗脱速度过快,导致洗脱剂与树脂尚未充分接触便流出,从而影响解吸效果。

图8 不同洗脱速率的动态洗脱曲线Fig.8 Dynamic desorption curves at different flow rates
不同洗脱速率的动态洗脱曲线见图8。由图8观察动态洗脱曲线发现,在不同洗脱流速下,流出液中白藜芦醇质量浓度均随着洗脱液体积的增大迅速达到最大值,而后快速下降,以0.5 mL/min与0.25 mL/min的速度洗脱时,两者的洗脱曲线几乎重合,虽然以0.25 mL/min流速进行洗脱所得峰形更为集中,但综合考虑工作效率与解吸效果,选取0.5 mL/min为适宜洗脱速率。从图8可看到,以0.5 mL/min进行洗脱时,当洗脱液体积达6 BV时,白藜芦醇已被大部分洗出,洗脱率可达89.86%,从节约成本方面考虑,将6 BV作为洗脱体积。
2.4 纯化物纯度的测定
经上述试验,确定的刺葡萄酒渣提取液中白藜芦醇的最佳吸附与解吸条件为:大孔树脂H103,上样液质量浓度为0.65 mg/mL,上样液pH值为3,上样流速为1.5 mL/min,上样液体积为6 BV;洗脱液为体积分数70%乙醇,洗脱流速为0.5 mL/min,洗脱液体积为6 BV。在上述条件下进行试验,得出样品纯度为59.76%,与经大孔树脂H103纯化前相比,纯度是原来(11.54%)的5.2倍。
3 结论
本试验从6种不同的大孔树脂中筛选出的H103树脂,对刺葡萄酒渣提取液中的白藜芦醇具有较高的吸附量与解吸率,且达到吸附平衡的速度快,是分离纯化白藜芦醇的理想吸附树脂。在上样液质量浓度为0.65 mg/mL,上样液pH值为3,上样流速为1.5 mL/min,上样液体积为6 BV;洗脱液为体积分数70%乙醇,洗脱流速为0.5 mL/min,洗脱液pH值为8,洗脱液体积为6 BV的条件下,树脂H103对白藜芦醇的吸附量可达55.7 mg/g,解吸率为89.86%,经树脂H103纯化后,样品纯度由11.54%提高至59.76%。
[1]赵克森.白藜芦醇的一般生物学作用[J].国外医学,2002,29(6):374-376.
[2]张健,高年发.影响干红葡萄酒中白藜芦醇含量的因素分析[J].中国酿造,2007,25(2):12-15.
[3]李洁,熊兴耀,曾建国,等.白藜芦醇的研究进展[J].中国现代中药,2013,15(2):100-108.
[4]NDIAYE M,PHILIPPE C,MUKHTAR H,et al.The grape antioxidant resveratrol for skin disorders:Promise,prospects,and challenges[J]. Arch Biochem Biophy,2011,508(2):164-170.
[5]TRINCHERI N F,NICOTRA G,FOLLO C,et al.Resveratrol induces cell death in colorectal cancer cells by a novel pathway involving lysosomal cathepsin D[J].Carcinogenesis,2007,28(5):922-931.
[6]CANTÓ C,AUWERX J.Caloric restriction,SIRT1 and longevity[J]. Trend Endocrinol Metabolism,2009,20(7):325-331.
[7]EKSHYYAN V P,HEBERT V Y,KHANDELWAL A,et al.Resveratrol inhibits rat aortic vascular smooth muscle cell proliferation viaestrogen receptor dependent nitric oxide production[J].J Cardiovasc Pharmacol, 2007,50(1):83-93.
[8]CARUSO F,TANSKI J,VILLEGAS-ESTRADA A,et al.Structural basis for antioxidant activity of trans-resveratrol:ab initio calculations and crystal and molecular structure[J].J Agr Food Chem,2004,52(24): 7279-7285.
[9]彭浩,邓百万,陈文强,等.虎杖内生真菌产白藜芦醇苷菌株的分离鉴定[J].微生物学通报,2011,38(6):889-894.
[10]孙颖,黄明亮,王华.白藜芦醇抗氧化性及安全性的研究进展[J].食品工业,2013,4:177-180.
[11]王爱华,刘向红.白藜芦醇在保护心血管方面的研究新进展[J].中国实用医药,2014(31):251-252.
[12]陈超奇.优选长孢洛德酵母应用于刺葡萄酒增香酿造的效果分析[D].杨凌:西北农林科技大学,2016.
[13]汶海花.葡萄废渣中白藜芦醇的提取与分离纯化研究[D].西安:长安大学,2012.
[14]谭玉晓,邢雅婷,韦广鑫.葡萄酒酿造副产物的综合利用[J].北京农业,2014(21):218-219.
[15]刘婷,王燕,李韵,等.响应面法优化超临界CO2萃取刺葡萄酒渣中白藜芦醇工艺[J].食品工业科技,2015,36(4):193-198.
Purification process of resveratrol fromVitis davidiiFoex wine residues by macroporous resin
WU Jia1,WANG Yan1*,LIU Ting2,NING Yilong1
(1.College of Food Science and Technology,Hunan Agricultural University,Changsha 410128,China; 2.China Certification and Inspection Group Hunan Co.,Ltd.,Changsha 410128,China)
The optimal macroporous resin for purifying resveratrol fromVitis davidiiFoex wine residues was screened from the six macroporous resin with static adsorption-desorption experiments.The conditions for static and dynamic adsorption-desorption processes were optimized.Results showed that macroporous resin H103 was the optimal.The optimal static adsorption-desorption conditions were initial resveratrol concentration in the sample solution 0.65 mg/ml,pH=3,elute solution as 70%ethanol.The optimal dynamic adsorption-desorption conditions were as follows:flow rate 1.5 ml/min and volume 6 BV for adsorption,0.5 ml/min and 6 BV for desorption.Under these conditions,the adsorption capacity of macroporous resin H103 for resveratrol was 55.7 mg/g,the desorption rate was 89.86%.The purity of resveratrol increased from 11.54%to 59.76%.
Vitis davidiiFoex;purification;extraction;resveratrol
TS255.1
0254-5071(2017)03-0144-06
10.11882/j.issn.0254-5071.2017.03.029
2016-11-08
湖南省大学生研究性学校和创新性试验计划项目(DFCXS201302)
吴佳(1994-),女,硕士研究生,研究方向为食品化学与营养。
*通讯作者:王燕(1968-),女,教授,博士,研究方向为食品化学与营养,食品添加剂。
