固相萃取-高效液相色谱串联质谱法测定植物油中6种酚类环境激素
2017-04-07黄荣荣黄金凤寻知庆林森煜李秀英杜伟锋
黄荣荣,黄金凤*,寻知庆,林森煜,李秀英,杜伟锋
(广州质量监督检测研究院,广东广州511447)
固相萃取-高效液相色谱串联质谱法测定植物油中6种酚类环境激素
黄荣荣,黄金凤*,寻知庆,林森煜,李秀英,杜伟锋
(广州质量监督检测研究院,广东广州511447)
建立了一种简单、快速测定植物油中6种酚类环境激素(双酚A、双酚B、双酚F、4-壬基酚、4-n-壬基酚、辛基酚)的固相萃取净化-液相色谱串联质谱的分析方法。样品加入同位素内标后,经正己烷溶解,Carb/NH2固相萃取柱净化,高效液相色谱分离,串联四极杆电喷雾离子源负模式及多反应监测模式检测。双酚A等6种环境激素在0.40~200 μg/L范围内线性关系良好,相关系数均>0.994;方法的检出限为0.4~0.8 μg/kg,定量限为1.2~2.4 μg/kg;平均回收率为87.9%~98.0%,相对标准偏差为4.37%~11.00%。该方法具有净化效果好、定量准确、灵敏快速的特点,适用于植物油中双酚A等6种环境激素的定量分析检测。
植物油;双酚A;壬基酚;辛基酚;固相萃取;高效液相色谱串联质谱法
近年来,在工业、农业快速发展的同时,人类给环境带去了一些生物机体以外的激素,这类激素被称为环境激素[1-3],如双酚A、双酚B、双酚F、4-壬基酚、4-n-壬基酚、辛基酚就属于常见的酚类环境激素,它们具有与雌激素类似的作用,能导致人体内分泌失调。研究表明,摄入体内的壬基酚可使精子数量减少,影响生物体正常的生殖和发育,而且壬基酚可在生物体内不断蓄积,即使每次摄入的浓度很低,也具有相当的危害性;辛基酚和壬基酚也可能导致雌性性早熟和雄性精子数量减少及质量下降等病症[4-7]。由于双酚A、壬基酚等在生产生活中的广泛使用,已在食品中检测到了它们的存在,极大地影响了食品安全[8-9]。因此,许多国家都对双酚A、壬基酚的使用进行了规定。此外,还设定了化妆品中、高分子材料中的双酚A的检测方法,但食品中双酚A和壬基酚等的检测方法仍未健全,只是适用于部分食品基质(如鱼肉、罐头等)。
目前,国内外对于此类环境激素的研究主要方法有液相色谱法[10-11],液相色谱-串联质谱法[12-13],毛细管电泳法[14]、气相色谱法[15]等。但是这些方法主要都是针对其他基质的(如饮用水、纺织品、涂料等),基于植物油基质的处理方法,还是比较少见。液相色谱-串联质谱法[16]相对一般的液相色谱法来说,由于该方法不仅利用保留时间来进行定性,还利用两对特征离子对的响应比例来对目标物进一步定性定量,所以相对其他方法来说液质联用法具有更明显的优势。本实验建立了高效液相色谱串联质谱(high performance liquid chromatography tamdem mass spectrometry,HPLCMC/MC)法测定植物油中双酚A、壬基酚和辛基酚等酚类环境激素的分析方法,具有准确度、灵敏度高的特点,满足了植物油中相关物质的检测要求。
1 材料与方法
1.1 材料与试剂
6种化合物标准品:双酚A(bisphenol A,BPA)、双酚B(bisphenol B,BPB)、双酚F(bisphenol F,BPF)、4-壬基酚(4-nonylphenol,4-NP)、4-n-壬基酚(4-n-nonylphenol,4-n-NP)、辛基酚(octylphenol,OP)(纯度均>98%),内标物4-n-壬基酚-d4(4-n-NP-d4):德国Dr.Ehrenstorfer公司;内标物双酚A-d4(bisphenol-A-3、3'、5、5'-d4,BPA-d4)(纯度>98%):上海安谱科学仪器有限公司;乙腈、甲醇、丙酮、正己烷、二氯甲烷(均为色谱纯):德国Merck公司;氨水(分析纯):广州化学试剂厂;超纯水(18.2 MΩ):实验室自制。
1.2 仪器与设备
1200高效液相色谱仪:美国Agilent公司;4000Qtrap三重四极杆质谱仪:美国AB SCIEX公司;Milli-Q去离子水发生器:美国Millipore公司;MS3 basic漩涡混合器:德国IKA公司;Turbo LV浓缩工作站:美国Biotage公司。
1.3 方法
1.3.1 溶液配制
6种化合物用甲醇溶解,配成单标储备液,再用甲醇配成10 mg/L混标储备液。临用时用甲醇稀释成所需浓度的工作液,每个浓度工作液均含50 μg/L BPA-d4和4-n-NP-d4内标物。
内标物BPA-d4,4-n-NP-d4用甲醇配制,并用逐级稀释成1 mg/L的内标工作液。
1.3.2 样品处理方法
准确称取1.0 g(精确至0.01 g)植物油,加入50 μL内标工作液,混匀,然后加入5 mL正己烷,涡旋1 min,充分混匀。将所得溶液通过已用6 mL正己烷活化平衡好的Carb/NH2固相萃取小柱,然后用6 mL正己烷淋洗,再用6 mL甲醇+丙酮(1∶1,V/V)淋洗,最后用9 mL甲醇+二氯甲烷(3∶7,V/V)洗脱,洗脱液于60℃氮吹至干后,用1mL甲醇溶解,过0.22μm尼龙膜,待测定。
1.3.3 仪器条件
色谱条件:MerckRP-18e色谱柱(50mm×4.6mm,5μm);流动相:A为甲醇,B为0.05%氨水;流速:0.5 mL/min(梯度洗脱程序见表1);进样量:20 μL;柱温:30℃。

表1 梯度洗脱程序Table 1 Program of gradient elution
质谱条件:电喷雾负离子模式(electrospray ionization, ESI);电喷雾电压:-4 500 V;离子源温度:500℃;雾化气:50 psi;辅助气:60 psi;气帘气:20 psi;检测模式:多反应监测(multiple reaction monitoring,MRM)模式;6种化合物和同位素内标的监测离子对(m/z)及去簇电压、碰撞电压等参数见表2,每个离子对的驻留时间均为50 ms。
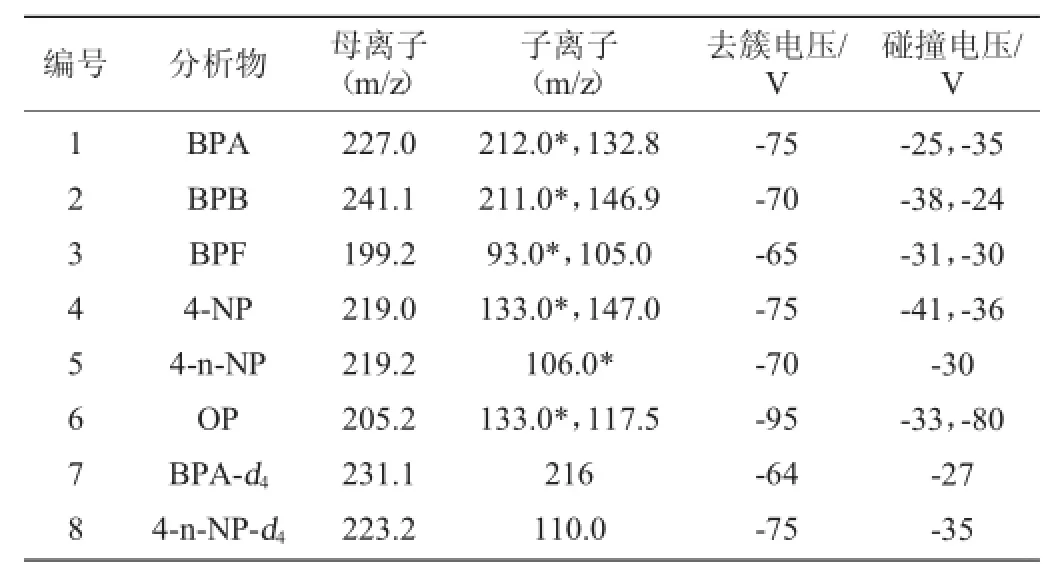
表2 6种化合物的质谱MRM模式优化参数Table 2 Optimized parameters of six compounds of mass spectrum MRM mode
2 结果与分析
2.1 质谱条件的确定
双酚A等目标物结构上的酚羟基在质谱电离时易失去质子,故多采用负离子模式进行检测。采用注射泵直接进样方式,以5 μL/min流速将100 μg/L双酚A等化合物标准溶液注入电喷雾离子源中,获得6种目标化合物的分子离子峰,以该离子峰为母离子进行二级质谱扫描,得到碎片离子信息,选择丰度较高的两个碎片离子为定性、定量离子,并对各个离子对的质谱参数(如去簇电压、碰撞能等)进行优化,使仪器的灵敏度、稳定性和分离效率均处于最佳状态。
2.2 流动相的选择
在分离测定双酚A等环境激素的研究中,多采用乙腈、甲醇、水、0.05%氨水为流动相。本实验研究了流动相对双酚A等的分离效果,结果见图1。
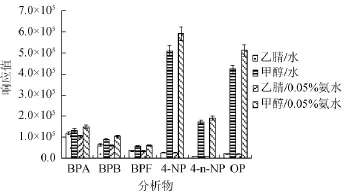
图1 流动相对6种化合物的影响Fig.1 Effect of mobile phases on six compounds
经反复试验,结果表明(如图1)采用甲醇/0.05%氨水的梯度洗脱程序,对6种目标物均有更高的响应,其中对4-NP、4-n-NP、OP的响应有着明显的提高。
2.3 色谱柱的选择
比较了实验室常用的色谱柱YMC-PackODS-A、Merck RP-18e的分离效果,由于2种色谱柱的耐酸碱性不同,实验中分别采用甲醇/水,甲醇/0.05%氨水为流动相。结果见图2。
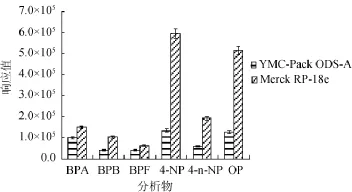
图2 色谱柱对6种化合物的影响Fig.2 Effect of chromatographic columns on six compounds
由图2可知,使用Merck RP-18e时,4-NP、4-n-NP、OP的响应明显大于使用YMC-Pack ODS-A色谱柱时的响应。这不仅是因为柱效因素导致的,还与甲醇/0.05%氨水能够更有效地离子化有关。因此,选择Merck RP-18e色谱柱进行分离。
2.4 固相萃取柱的选择
本实验选用实验室常用的固相萃取柱,有HLB、C18、WAX、MAX、Carb/NH2等固相萃取柱。HLB是通用型的固相萃取柱,可用于酸性、中性和碱性化合物的净化;C18固相萃取柱用于净化非极性或极性较低的化合物;WAX和MAX是阴离子交换固相萃取柱,用于净化离子型的化合物;Carb/NH2固相萃取柱,可去除固醇类化合物,同时可通过弱阴离子交换(水溶液)达到保留作用,当用在非极性溶液中(如正己烷),能与带有-OH、-NH或-SH的官能团形成氢键。本实验针对各个固相萃取柱的性质,通过相应的前处理,对目标物进行回收率实验。采用5种固相萃取柱时,目标物的回收率对比结果见图3。
图3 不同固相萃取柱对6种目标物的回收率比较Fig.3 Comparison of recovery rates of six compounds with different solid phase extraction columns
由图3可知,Carb/NH2固相萃取柱的回收率最好,所以采用固相萃取柱Carb/NH2。
2.5 线性范围与检出限
向空白样品中添加一系列的标准溶液(其线性范围见表3),在本实验条件下,进行HPLC-MS/MS分析。其中BPA、4-n-NP用内标法计算,以目标物定量离子峰面积(A)和内标物的色谱峰面积Ai的比值y对相应的目标物质量浓度(x,μg/L)进行线性回归分析。BPB、BPF、4-NP、OP用外标法计算,以目标物定量离子峰面积(A)对相应的目标物质量浓度(x,μg/L)进行线性回归分析。得到6种目标物的线性方程。根据仪器的检出限(limitofdetection,LOD,S/N=3)及定量限(limit of quantitation,LOQ,S/N=10),结合样品的前处理过程,计算得到方法检出限和方法定量限,结果见表3。
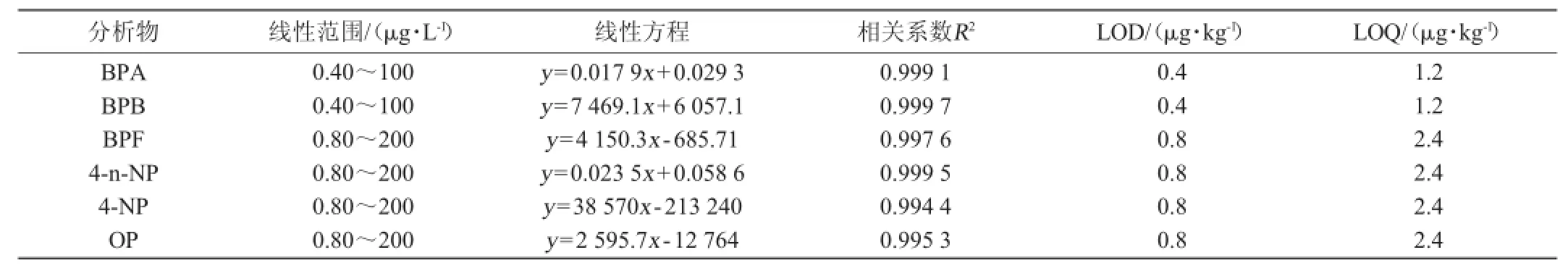
表3 6种目标物的线性方程、相关系数、检出限和定量限Table 3 Linear equations,correlation coefficients,LODs and LOQs of six compounds
由表3可知,相关系数R2均>0.994,表明5种目标物在相应的浓度范围内线性关系良好;方法检出限和定量限分别在0.4~0.8 μg/kg和1.2~2.4 μg/kg之间,表明方法具有较高的灵敏度。
2.6 方法回收率与精密度
为验证方法的准确度,按本实验方法对阴性样品进行了回收率和精密度试验。称取空白样品18份,每份1.0 g(精确至0.01 g),分为6组,分别定量加入6种目标物,按试样处理方法处理后进行测定,结果见表4。
由表4可知,目标物在各自添加浓度范围内,平均回收率为87.9%~98.0%,相对标准偏差(relative standard deviation,RSD)为4.37%~11.00%(n=6)。
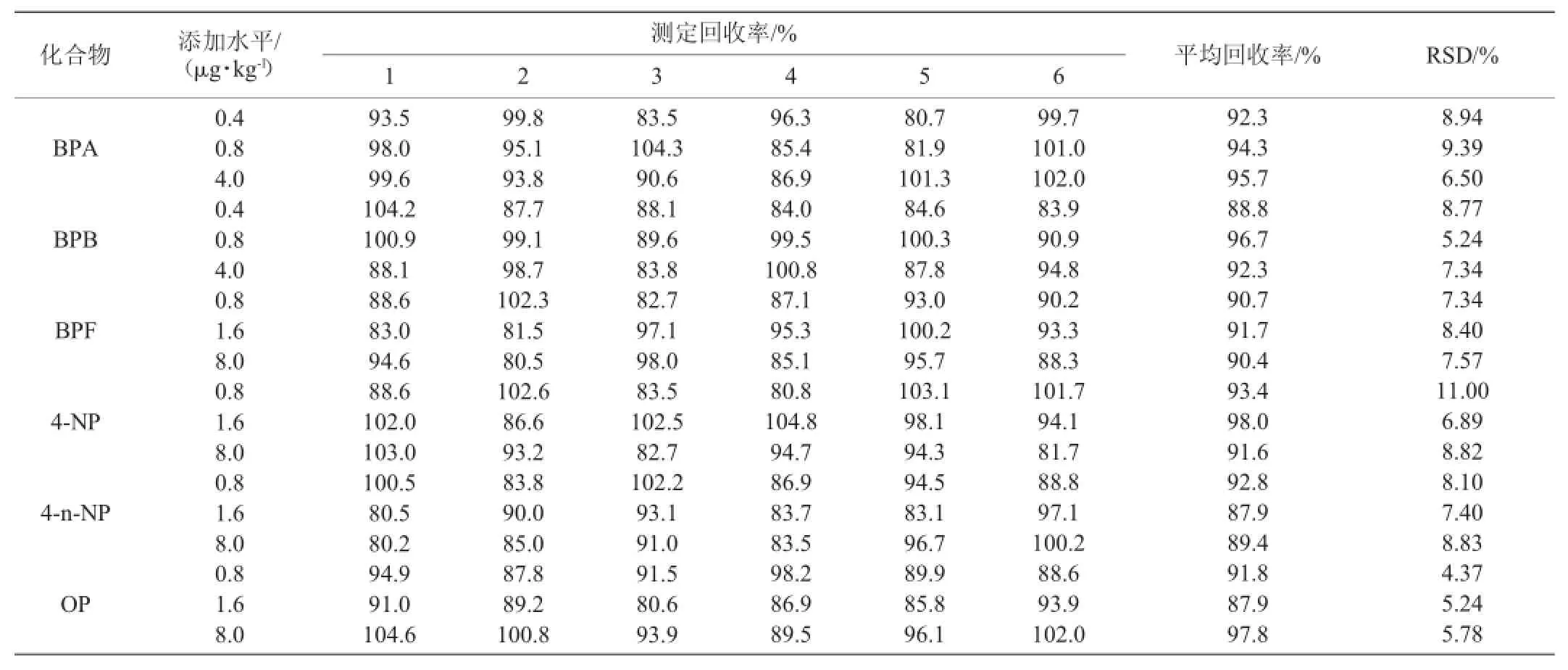
表4 空白样品中6种目标物的加标回收率及精密度Table 4 Adding standard recoveries and precision degree for six compounds in blank sample
2.7 实际样品的测定
采用本方法对从市场购买的50份植物油进行分析,其中11个样品检出4-NP,含量在5.81~185 μg/kg;所有样品均未检出其余5种目标化合物。由此可见,植物油中主要残留着4-NP。
3 结论
对于植物油中的双酚A等6种环境激素,尚未有国标检测方法。本文建立了固相萃取提取净化、高效液相色谱串联质谱仪检测、内标法定量的方法来测定植物油中的6种环境激素。结果表明,6种环境激素在0.40~200 μg/L范围内线性关系良好,相关系数均>0.994;方法的检出限为0.4~0.8 μg/kg,定量限为1.2~2.4 μg/kg;平均回收率为87.9%~98.0%,相对标准偏差为4.37%~11.00%。该方法具有前处理简单,净化效果好、定量准确、灵敏度高的特点,可为测定植物油中的双酚A等环境激素残留量的检测提供方法参考。
[1]张萍,梁高道.环境激素对人类健康的危害及监测方法[J].公共卫生与预防医学,2005,16(6):63-65.
[2]李瑞霞.环境雌激素对动物的影响与对策[J].四川动物,2006,25(3):673-676.
[3]赵美萍,李元宗,常文保.酚类环境雌激素的分析研究进展[J].分析化学,2003,31(1):103-109.
[4]郭金莲,任慕兰.壬基酚对成年雌性SD大鼠生殖功能的影响[J].东南大学学报:医学版,2007,26(4):287-290.
[5]李晖,杨晓燕,陈容.环境雌激素辛基酚和壬基酚对雌性大鼠生殖系统的损伤作用[J].新疆医学,2008,38(10):5-9.
[6]KORTNER T M,VANG S H,ARUKWE A.Modulation of salmon ovarian steroidogenesis and growth factor responses by the xenoestrogen 4-nonylphenol[J].Chemosphere,2009,77(7):989-998.
[7]BROTONS J A,OLEA-SERRANO M F,VILLALOBOS M,et al.Xenoestrogens released from lacquer coatings in food cans[J].Environ Health Perspect,1995,103(6):608-612.
[8]GUENTHER K,HEINKE V,THIELE B,et al.Endocrine disrupting nonylphenols are ubiquitous in food[J].Environ Sci Technol,2002,36 (8):1676-1680.
[9]BONEFELD-JORGENSEN E C,LONG M,HOFMEISTER M V,et al. Endocrine-disrupting potential of bisphenol A,bisphenol A dimethacrylate,4-n-nonylphenol,and 4-n-octylphenolin vitro:new data and a brief review[J].Environ Health Perspect,2007,115:69-76.
[10]刘付建,郭新东,翁乙斌,等.QuEChERS/超高效液相色谱法测定水性涂料中5种酚和酚类衍生物[J].分析测试学报,2014,33(3):329-333.
[11]ZHOU Q,GAO Y,XIE G.Determination of bisphenol A,4-n-nonylphenol,and 4-tert-octylphenol by temperature-controlled ionic liquid dispersive liquid-phase microextraction combined with high performance liquid chromatography-fluorescence detector[J].Talanta,2011,85: 1598-1602.
[12]ASIMAKOPOULOSAG,THOMAIDISN S.Bisphenol A,4-t-octylphenol,and 4-nonylphenol determination in serum by hybrid solid phase extraction-precipitation technology technique tailored to liquid chromatography-tandem mass spectrometry[J].J Chromatogr B,2015,1 (986-987):85-93.
[13]INOUE K,KAWAGUCHI M,OKADA F,et al.Measurement of 4-nonylphenol and 4-tert-octylphenol in human urine by column-switching liquid chromatography-mass spectrometry[J].Anal Chim Acta,2003, 486:41-50.
[14]BABAY P A,GETTAR R T,SILVA M F,et al.Separation of nonylpenol ethoxylates and nontlpjenol by non-aqueous capillary electrophoresis[J]. J Chromatogr A,2006,1116(12):277-285.
[15]张洛红,杜婷,钟佳宇.新型毛细管内固相萃取-气相色谱法检测纺织品中烷基酚类物质[J].色谱,2015,33(10):1065-1070.
[16]何敏恒,李秀英,曾令浩,等.同位素稀释-超高效液相色谱-串联质谱法检测蜂蜜中泛酸含量[J].中国酿造,2015,34(4):157-160.
Determination of six phenol environmental hormones in plant oil by solid-phase extraction coupled with HPLC-MS/MS
HUANG Rongrong,HUANG Jinfeng*,XUN Zhiqing,LIN Senyu,LI Xiuying,DU Weifeng
(Guangzhou Quality Supervision and Testing Institute,Guangzhou 511447,China)
A simple and quick analysis method was established for the determination of six phenol environmental hormones(bisphenol A,bisphenol B, bisphenol F,4-nonylphwnol,4-n-nonylphenol,octylphenol)in plant oil by HPLC-MS/MS and solid phase extraction(SPE).After addition of the isotope internal standard,the samples were dispersed with hexane and cleaned by Carb/NH2solid phase extraction column,and then analyzed by HPLC-MS/MS in the multiple reaction monitoring(MRM)mode.Under the optimal experimental conditions,the calibration curves of six phenol environmental hormones were linear in the range of 0.40-50.0 μg/L with correlation coefficients more than 0.994.The limits of detection and the limits of qualification of the method were 0.4-0.8 μg/kg and 1.2-2.4 μg/kg,respectively.The mean recovery rate of six phenol environmental hormones were 87.9%-98.0%combining with the relative standard deviation ranging from 4.37%-11.00%.The method was suitable for the identification and quantification of six phenol environmental hormones in plant oil due to its simplicity and accuracy.
plant oil;bisphenol A;4-nonylphwnol;octylphenol;solid phase extraction;HPLC-MS/MS
O657.7
0254-5071(2017)03-0178-04
10.11882/j.issn.0254-5071.2017.03.036
2016-12-05
黄荣荣(1986-),女,工程师,本科,研究方向为食品及相关产品检测。
*通讯作者:黄金凤(1979-),女,高级工程师,硕士,研究方向为食品及食品相关产品安全检测、仪器分析技术。
