降胆固醇双歧杆菌BZ11的筛选及其耐受性评价
2017-04-07朱啟会,何腊平,张玲等
降胆固醇双歧杆菌BZ11的筛选及其耐受性评价
朱啟会1,何腊平1,2*,张玲1,高冰3,李翠芹4,熊江1
(1.贵州大学酿酒与食品工程学院,贵州贵阳550025;2.贵州省农畜产品贮藏与加工重点实验室,贵州贵阳550025;3.湖北工业大学生物工程与食品学院,湖北武汉430068;4.贵州大学化学与化工学院,贵州贵阳550025)
采用平板涂布法从贵州特色香猪粪便中筛选具有降胆固醇能力及耐酸、耐胆盐和耐氧性能的双歧杆菌(Bifidobacterium)。从香猪粪便中共筛选出19株具有双歧杆菌形态特征的菌株。采用邻苯二甲醛法测定其降胆固醇率,得到7株降胆固醇能力较高菌株,其中菌株BZ11降胆固醇率最高可达(38.52±0.60)%,并对酸、胆盐和氧具有较高的耐受性。经菌落形态特征、生理生化试验及16S rRNA序列分析,菌株BZ11被鉴定为动物双歧杆菌乳亚种(Bifidobacterium animalissubsp.lactis)。
双歧杆菌BZ11;降胆固醇;筛选;鉴定;耐受性
近年来,随着人们生活水品的提高,胆固醇及脂肪的摄取量也随之增加,从而导致心血管疾病的患病率也不断增加。据报道,全世界每年死于该病的人数约有1 730万,预计到2030年死亡人数将达到2 360万[1]。而导致动脉粥样硬化、冠心病、脑中风等心血管疾病发生的主要原因就是因为血清中的胆固醇含量过高[2]。有研究发现,与含有正常血脂的人相比较,体内胆固醇含量过高的人患有心脑血管疾病的风险是其含有正常血脂人的3倍。双歧杆菌(Bifidobacterium)作为人体肠道内重要的益生菌,除了能调节肠道胃肠道健康、增强免疫应答、抑制病原微生物、抗肿瘤等功能外,也有一定的降胆固醇作用[3-4]。
目前,国内已有双歧杆菌活菌制剂类产品,这些双歧杆菌主要从国外引进,因此有必要开发筛选新的优良双歧杆菌。贵州特色香猪属于小型猪,在消化系统、心血管系统、营养代谢等方面与人类极其相似,是筛选人类易于接受和利用的益生菌的理想模型动物[5]。而且作为人和动物选用的益生菌,必须具有耐酸、耐胆盐等特性,菌种最好来源于人或动物,更有利于菌株在肠道定植[6]。由于双歧杆菌一般属于严格厌氧菌,不过其中有少数具有耐氧性,而耐氧双歧杆菌有利于产品的保藏,所以本试验拟用平板涂布法从贵州特色香猪粪便中分离出具有降胆固醇能力且能耐酸、耐胆盐和耐氧的双歧杆菌,以期为其在口服益生菌制剂的应用方面奠定基础。
1 材料与方法
1.1 实验材料
香猪粪便:来源于贵州省贵阳市花溪区生态园的贵州特色1月龄香猪。
培养基:改良的蛋白胨吐温酵母膏葡萄糖(peptonetween yeast extract glucose,PTYG)培养基[7];莫匹罗星锂盐改良MRS培养基[8];降胆固醇培养基[9]。
牛胆盐(分析纯):国药集团化学试剂有限公司;胆固醇标品(≥99%):美国Sigma公司;β-半乳糖苷(X-gal,分析纯):北京鼎国昌盛科技有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
SW-CJ-10超净工作台:苏州净化有限公司;LS-B75L立式压力蒸汽灭菌器:江阴滨江医疗设备有限公司;WJ-1851司水套式二氧化碳培养箱:上海三腾仪器有限公司;101-1ASB电热鼓风干燥箱:北京科伟永兴仪器有限公司;DW-86L286立式超低温保存箱:青岛海尔特种电器有限公司;CX21SF1奥林巴斯生物显微镜:奥林巴斯(中国)有限公司;TU-1810PC紫外可见分光光度计:北京普析通用仪器有限公司;YQX-T厌氧培养箱:上海新苗医疗器械制造有限公司;pHS-3C pH计:成都世纪方舟科技有限公司。
1.3 试验方法
1.3.1 菌株分离
取新鲜香猪粪便10 g,加入90 mL无菌水中,振荡摇匀后,用生理盐水进行梯度稀释,得到10-2g/mL、10-3g/mL、10-4g/mL稀释液。分别取各稀释浓度样液0.1 mL涂布于莫匹罗星锂盐改良MRS培养基上,37℃培养2~3 d。挑取在莫匹罗星锂盐改良MRS培养基上表面光滑、边缘完整、乳白色、具有柔软质地的菌落接种到涂有X-gal的PTYG平板上37℃培养1 d,挑取深蓝色菌落于PTYG平板上进行纯化培养。为筛选到耐氧的双歧杆菌,若无特别说明,本实验所有的微生物的培养环境皆为20%二氧化碳-80%空气的环境。
1.3.2 形态学鉴定
挑取单菌落进行革兰氏染色,镜检。将具有双歧杆菌典型形态特征的菌落进行传代培养及菌种保藏并进行后续试验。
1.3.3 降胆固醇能力测定
胆固醇降解能力测定采用邻苯二甲醛(o-phthalaldehyde,OPA)法[10]。菌株种子液按3%(V/V)接种于含胆固醇100 μg/mL的MRS液体培养基中,在37℃的二氧化碳培养箱中培养24 h后,12 000 r/min离心10 min,取上清液,测定胆固醇残留量。
1.3.4 耐酸耐胆盐试验
耐酸试验:将待测菌株种子液按5%(V/V)的接种量接种于pH7.0及pH3.0的改良液体培养基中,于37℃二氧化碳培养箱中静置培养2 h后,用生理盐水稀释后取稀释液涂布于改良PTYG平板上,在二氧化碳培养箱中37℃培养48 h后进行活菌计数,每个处理做3个平行。菌株存活率(N)计算公式如下:
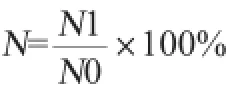
式中:N1表示pH3.0培养2 h的活菌数对数值,lg(CFU/mL);N0表示pH7.0培养2 h的活菌数对数值,lg(CFU/mL)。
耐胆盐试验:将待测菌株种子液按5%(V/V)的接种量接种于含0.3%(W/V)牛胆盐和不含牛胆盐的改良液体培养基中,37℃二氧化碳培养箱培养,且分别在0 h和24 h于改良PTYG平板上进行活菌计数,每个处理做3个平行。
1.3.5 氧耐受性
将待测菌株种子液涂布于PTYG平板上,分别于普通培养箱和20%CO2培养箱中37℃培养24 h后,进行平板计数。对比两者生长情况及活菌数以判断其耐氧性。每个处理做3个平行。
1.3.6 生理生化鉴定
取经革兰氏染色为阳性、具有明显双歧杆菌特性的菌株,按常规方法进行过氧化氢酶试验、糖发酵试验、吲哚试验[11],对菌株做进一步鉴定。
1.3.7 16S rRNA分子生物学鉴定
DNA的提取:采用Ezup柱式细菌基因组DNA抽提试剂盒,方法根据试剂盒说明书。聚合酶链反应(polymerase chain reaction,PCR)扩增:引物为27F:AGTTTGATCMTG GCTCAG1492RGGTTACCTTGTTACGACTT,具体试验方法参照文献[12]报道。PCR产物经1%琼脂糖电泳分析后测序,所得序列在美国国家生物技术信息中心(national center of biotechnology information,NCBI)中比对,选取相似性较高的菌株的16S rRNA序列,用MEGA软件构建系统发育树。
2 结果与分析
2.1 菌株分离纯化及形态学鉴定
从香猪粪便中分离得到19株疑似双歧杆菌菌株。通过菌落形态观察,筛选出的菌株菌落较小、表面光滑、边缘整齐、呈乳白色凸起状。革兰氏染色为阳性,较小,有多种形态:Y型、V型、L型、短杆状、弯曲弧状(图1),与双歧杆菌(Bifidobacterium)形态特征一致[13]。

图1 菌落形态(A)和镜检(B)结果Fig.1 Results of colony morphology(A)and microscopy(B)
2.2 降胆固醇试验
将分离得到的菌株进行降胆固醇试验,结果见表1。由表1可知,分离得到的菌株对胆固醇的降解率在7.29%~38.52%之间,其中胆固醇降解率>20%的菌株有7株,<10%的有3株,10%~20%之间有9株。不同菌株对胆固醇的降解率各不相同。宋小娟等[14]利用平板涂布法从牛干巴中筛选降胆固醇乳酸菌,其胆固醇降解率为8%~26%。赵佳锐等[15]筛选得到的双歧杆菌其胆固醇降解率在7.72%~45.39%之间,有10株菌的胆固醇降解率在30%以上。本试验结果符合常规,丰富了双歧杆菌的菌种资源。但是作为肠道益生菌,还需进行耐酸耐胆盐试验,因此选取胆固醇降解率较高的7株菌(即BZ11、BZ8、BZ12、BZ28、BZ40、BZ44、BZ45)进行耐酸耐胆盐试验,以进一步确定其益生特性。

表1 不同菌株的体外胆固醇降解率Table 1 Cholesterol-lowering rate of different strainsin vitro
2.3 耐酸耐胆盐试验2.3.1耐酸能力

表2 菌株耐酸能力Table 2 Ability of acid tolerance of strains
通过口服补充益生菌时,在到达作用部位前,菌株必然经过胃,并在胃液中短暂停留,而人的胃液呈酸性,pH值为3.0左右,空腹pH值可达1.5[16],作为益生菌需要有较强的耐酸能力。试验选取7株降胆固醇能力较高菌株在pH3.0和pH7.0的模拟人工胃液中进行耐酸试验,根据食物在胃液中的停留时间确定培养时间为2 h,通过测定活菌数计算各菌株存活率,结果见表2。由表2可知,7株试验菌株在pH3.0条件下培养2h活菌率均在90%以上,表明所筛选的7株菌均具有一定的耐酸能力,其中菌株BZ45存活率最高,为98.70%。
2.3.2 耐胆盐能力
双歧杆菌主要定植于肠道,而正常人体的小肠胆汁盐含量在0.03~0.3 g/kg,因此本试验在培养基中加入0.3%(W/V)牛胆盐模拟肠液,测定菌株对胆盐的耐受能力,检测结果见图2。

图2 菌株在含有0.3%的牛胆盐培养基和不含胆盐培养基中培养24 h后菌落数Fig.2 Colony count of strains in medium wit 0.3%bile salt medium and without bile salt medium for 24 h
由图2可知,菌株BZ11对胆盐有一定的耐受能力,在含有0.3%胆盐的培养基中培养24 h后活菌数对数值为7.81,与不含胆盐的培养基中培养24 h后活菌数对数值8.43相比仍有92.65%的存活率。这可能是因为分离筛选出的菌株均来自于动物肠道,作为肠道内的正常菌群,本身就会具有一定的耐胆盐能力。但是不同菌株对胆盐耐受能力不同,菌株BZ40、BZ28、BZ44在含有0.3%胆盐的培养基中的活菌数是在不含胆盐培养基中活菌数的82.81%。为挑选出更适于添加到食品中的菌株,需进一步测定菌株的耐氧能力。
2.4 氧耐受性
双歧杆菌是一种专性厌氧、不产芽孢的革兰氏阳性杆菌[17]。当将其作为功能性成分添加到食品中时,由于周围环境中氧化压力的存在,不可避免的会对其活菌数及益生特性产生影响。为判断所筛选菌株的耐氧性能,本实验进一步对比了所筛菌株在普通培养箱和20%CO2培养箱培养24 h后其生长状况及活菌数,结果见表3。由表3可知,所分离的菌株都有一定的耐氧能力,不过菌株BZ11耐氧性能和生长性能均最好的,结合菌株的降胆固醇率、耐酸耐胆盐性能,选择菌株BZ11作为目标菌株,进行生理生化特征及分子生物学鉴定。

表3 菌株耐氧能力Table 3 Ability of oxygen tolerance of strains
2.5 生理生化鉴定
对菌株BZ11进行生理生化鉴定,结果见表4。由表4可知,菌株BZ11吲哚试验为阴性,不产过氧化氢酶,不产硫化氢,与双歧杆菌属的特征相符。结合菌株形态特征与国标GB 4789—2014《食品安全国家标准食品微生物学检验》及伯杰氏细菌鉴定手册进行对比,表明菌株BZ11被初步鉴定为动物双歧杆菌(Bifidobacterium animalis)。

表4 菌株BZ11的生理生化试验鉴定结果Table 4 Identification results of physiological and biochemical experiments of strain BZ11
2.6 16S rRNA鉴定
采用琼脂糖凝胶对菌株BZ11的PCR扩增产物进行电泳检测。将所测得的16S rRNA基因序列提交到NCBI,通过Blast工具在GenBank数据库中进行比对,选取20株同源性较高菌株构建系统发育树,结果见图3。
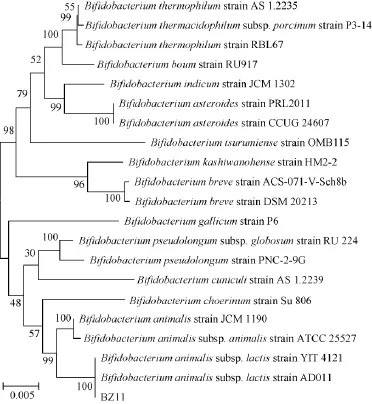
图3 基于16S rRNA序列菌株BZ11的系统发育树Fig.3 Phylogenetic tree of strain BZ11 based on 16S rRNA sequence
由图3可知,菌株BZ11所在的最大分支中其所包括的菌株均为双歧杆菌,菌株BZ11的16SrRNA序列与动物双歧杆菌乳亚种(Bifidobacterium animalissubsp.lactis)AD011以及动物双歧杆菌乳亚种(Bifidobacterium animalissubsp. lactis)YIT 4121的同源性达到100%,且属于同一个最小分支中,因此菌株BZ11的鉴定结果为动物双歧杆菌乳亚种(Bifidobacterium animalissubsp.lactis),并进行了专利保藏(保藏号:CGMCC No.10224)。
3 结论
本研究采用含有莫匹罗星锂盐的MRS培养基和含有X-gal的PTYG培养基,在20%二氧化碳~80%空气环境中培养,根据菌落菌株形态特征,对香猪粪便样品进行初筛,然后采用邻苯二甲醛(OPA)法对所筛选菌株进行降胆固醇试验,选取胆固醇降解率高的菌株。再将降胆固醇性能好的菌株分别进行耐酸性、耐胆盐和耐氧试验,最终从贵州省特色小香猪粪便样品中分离筛选出一株降胆固醇能力高,耐酸、耐胆盐和氧耐受好的菌株BZ11,并经形态学、生理生化试验和16SrRNA序列分析,菌株BZ11被鉴定为动物双歧杆菌乳亚种(Bifidobacterium animalissubsp.lactis),丰富了双歧杆菌的菌种资源,为其在口服益生菌制剂方面的应用奠定基础。
[1]NAPOLI C,CRUDELE V,SORICELLI A,et al.Primary prevention ofatherosclerosis:a clinical challenge for the reversal of epigenetic mechanisms[J].Circulation,2012,125(19):2363-2373.
[2]ALOGLU H S,,ÖZER E D,ÖNER Z.Assimilation of cholesterol and probiotic characterisation of yeast strains isolated from raw milk and fermented foods[J].Int J Dairy Technol,2016,69(1):116-124.
[3]陈路清,李青青,马鎏鏐,等.体外筛选降胆固醇双歧杆菌实验[J].食品工业科技,2010,31(7):333-335.
[4]周发友,吴晓玉,刘好桔,等.温度对双歧杆菌及其产品质量影响研究进展[J].广东农业科学,2013,40(13):110-112.
[5]王超凡,杨关林.小型猪动脉粥样硬化模型研究进展[J].辽宁中医药大学学报,2014,16(5):69-71
[6]杜慧真.肠道微生态与人体健康[J].中国中西医结合学会,2013(4):71-74.
[7]旭日花,马世敏,刘丽莎,等.培养条件对双歧杆菌EPS各组分产量及比例的影响[J].微生物学通报,2013,40(11):2066-2074.
[8]蔡芷荷,宋曼丹,周蔼怡,等.莫匹罗星锂盐改良MRS检测双歧杆菌的应用研究[J].中国卫生检验杂志,2011(6):1409-1412.
[9]秦翠丽,刘文静,王德舜,等.降胆固醇合生元组合的体外筛选[J].食品研究与开发,2012,33(10):166-169.
[10]NAKA H.Determination of serum cholesterol using O-phthalaldehyde reagent[J].Rinsho Byori Jap J Clin Pathol,1972,20(4):291-294.
[11]熊强,杨青丽,韩浩.人源双歧杆菌的分离纯化及鉴定[J].生物加工过程,2013,11(6):38-41.
[12]GUO X H,KIM J M,NAM H M,et al.Screening lactic acid bacteria from swine origins for multistrain probiotics based onin vitrofunctional properties[J].Anaerobe,2010,16(4):321-326.
[13]吕锡斌,何腊平,张汝娇,等.双歧杆菌生理功能研究进展[J].食品工业科技,2013,34(16):353-358.
[14]宋小娟,何腊平,李翠芹,等.牛干巴中降胆固醇、降亚硝酸盐乳酸菌的分离筛选及其发酵性能[J].食品工业科技,2016,37(9):159-164.
[15]赵佳锐,杨虹.益生菌降解胆固醇的作用及机理研究进展[J].微生物学报,2005,45(2):315-319.
[16]SHOICHIRO T,SHIZUKA S.Diet and the risk of gastric cancer:review of epidemiological evidence[J].Gastric Cancer,2007,10(2):75-83.
[17]陈晨,刘平平,张青,等.双歧杆菌BB-12的功能特性及研究进展[J].高师理科学刊,2016,36(4):43-45.
Screening and tolerance evaluation of cholesterol-loweringBifidobacteriumBZ11
ZHU Qihui1,HE Laping1,2*,ZHANG Ling1,GAO Bing3,LI Cuiqin4,XIONG Jiang1
(1.School of Liquor and Food Engineering,Guizhou University,Guiyang 550025,China;2.Key Laboratory of Agricultural and Animal Products Store&Processing of Guizhou Province,Guizhou University,Guiyang 550025,China; 3.College of Bioengineering and Food Science,Hubei University of Technology,Wuhan 430068,China; 4.School of Chemistry and Chemical Engineering,Guizhou University,Guiyang 550025,China)
Bifidobacteriumwith the ability of cholesterol-lowering and the tolerance of acid,cholate and oxygen was screened from Guizhou Xiang pig faeces by spread-plate method.A total of 19 strains were screened.The cholesterol-lowering rate of strains was detected by phthalic aldehyde method,and 7 strains with high cholesterol-lowering ability were obtained.The cholesterol-lowering rate of strain BZ11 was up to(38.52±0.60)%, and the strain had higher tolerance of acid,cholate and oxygen.By colonial morphology,physiological biochemical experiments and 16S rRNA sequence analysis,strain BZ11 was identified asBifidobacterium animalissubsp.lactis.
BifidobacteriumBZ11;cholesterol-lowering;screening;identification;tolerance
TS261.1
0254-5071(2017)03-0054-05
10.11882/j.issn.0254-5071.2017.03.012
2016-11-24
国家自然科学基金(31160002);黔科合重大专项字[2015]6004-5号
朱啟会(1992-),女,硕士研究生,研究方向为发酵工程。
*通讯作者:何腊平(1972-),男,教授,博士,研究方向为发酵工程、生物催化与生物转化。
