利培酮微生物限度检查方法的建立
2017-04-06王玉华徐丽玮
王玉华,沈 岚,赵 静,徐丽玮
(1.上海中医药大学,上海 201203;2.山东绿叶制药有限公司,山东 烟台 264003)
利培酮微生物限度检查方法的建立
王玉华1,2,沈 岚1,赵 静2,徐丽玮2
(1.上海中医药大学,上海 201203;2.山东绿叶制药有限公司,山东 烟台 264003)
目的:建立利培酮微生物限度检查方法.方法:按照《中国药典》2015年版四部1105《非无菌产品微生物限度检查:微生物计数法》中常规法和培养基稀释法对利培酮进行处理,以5种试验菌的回收率对检验方法的有效性进行验证和确认.结果:采用常规方法对利培酮进行微生物限度检查时,发现枯草芽孢杆菌、白色念珠菌在3次平行试验中的回收率均低于50%,其他3种试验菌回收率都高于50%;培养基稀释法(1∶10的样品稀释液,0.2mL/皿)对5种试验菌的回收率均超过50%.结论:本文建立的培养基稀释法可用于利培酮的微生物限度检查.
利培酮;微生物限度检查;验证
利培酮(risperidone)是由比利时杨森制药公司研制的一种新型抗精神病药物.利培酮具有较好的疗效和发生率很低的锥体外系不良反应,是对精神分裂症阳性和阴性症状均有效的药物.在英国作为非典型抗精神病药上市后,被广泛应用于临床[1].
利培酮作为制剂生产的原料,根据其用途,应进行需氧菌、真菌和酵母菌的测定[2].目前文献资料中没有有关利培酮微生物学限度检测方法的报道,本文根据《中国药典》2015年版四部中微生物限度检查法的有关要求,对利培酮的需氧菌、真菌及酵母菌数的检查方法进行方法学验证,建立适合该药品微生物限度检查的方法,从而保证该药品检验方法的科学性和准确性,进一步保证其质量[3-6].
微生物限度检查一般采取常规法,具有抑菌性的品种抑菌性消除方法有中和法[7]、薄膜过滤法[8]、培养基稀释法[9-11]等.根据利培酮的理化性质[12]采取相应的供试品溶液制备方法.
1 仪器、材料与试药
1.1 仪器
BD720恒温培养箱(Binder),KB720低温培养箱(Binder),LMQ.C型压力灭菌器 (新华医疗设备有限公司),HR40-A2生物安全柜(ESCO),SW-CJ-2FD净化工作台(苏州安泰空气净化有限公司).
1.2 验证用菌株
铜绿假单胞菌[ATCC9027]、金黄色葡萄球菌[ATCC 6358]、枯草芽孢杆菌[ATCC6633]、白色念珠菌[ATCC10231]、黑曲霉[ATCC16404]均由美国菌种保藏中心提供.
1.3 培养基
胰蛋白胨大豆琼脂培养基(批号:VM655058435)、沙氏葡萄糖琼脂培养基 (批号:VM657938441)、pH7.0NaCl-蛋白胨缓冲液(批号:VM625982406)均购自MERCK.
1.4 药品
利培酮,浙江华海药业股份有限公司(批号:5341-14-001M、5341-14-002M、5341-14-003M.)
2 实验准备
按照《中国药典》2015版四部1105《非无菌产品微生物限度检查:微生物计数法》进行.
2.1 供试品溶液的制备
取供试品10g,加入20ml二甲基亚砜,制成混悬液,加pH7.0氯化钠-蛋白胨缓冲液至100ml,混匀,作为1:10的供试品溶液.
2.2 菌液制备
取铜绿假单胞菌、金黄色葡萄球菌、枯草芽孢杆菌、白色念珠菌的新鲜培养物,用pH7.0氯化钠-蛋白胨缓冲液制成每1ml含菌数为50~100cfu的菌悬液;
取黑曲霉孢子悬液,用pH7.0氯化钠-蛋白胨缓冲液制成每1ml含菌数小于100cfu的菌悬液.
3 细菌、霉菌和酵母菌检查方法学验证试验
3.1 可接受标准
进行3次独立的平行验证,分别计算菌回收率,菌回收率应在50%~200%范围内.
3.2 试验组
①常规法:取1:10供试品溶液1ml和菌液1ml注入平皿中,再注入培养基,混匀,每个菌株制备2个平皿.结果见表1.
②培养基稀释法:取1:10供试品溶液0.2ml和菌液1ml注入平皿中,再注入培养基,混匀,每个菌株制备2个平皿.结果见表2.
需氧菌在30~35℃培养3天,霉菌和酵母菌在20~25℃培养5天,计数取平均值.
3.2 菌液组
测定试验菌液每毫升中含有的菌落数.
3.3 供试品对照组
按试验组的方法,不加菌液,测定供试品本底菌数.
3.4 稀释剂对照组
按照供试品溶液制备方法,不加入供试品,取稀释液与菌液混合液,分别计数,测定菌落数,结果见表1.
3.5 回收率计算
试验组菌回收率=(试验组平均菌落数-供试品对照组平均菌落数)/菌液组平均菌落数×100%;
稀释剂组菌回收率=稀释剂对照组平均菌落数/菌液组平均菌落数×100%.
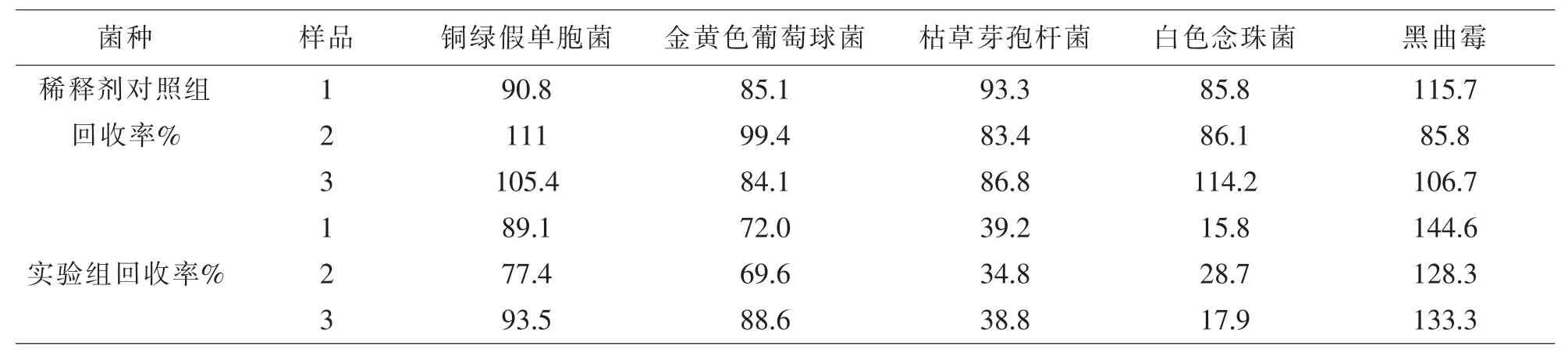
表1 常规法-各菌回收率(1mL/皿)
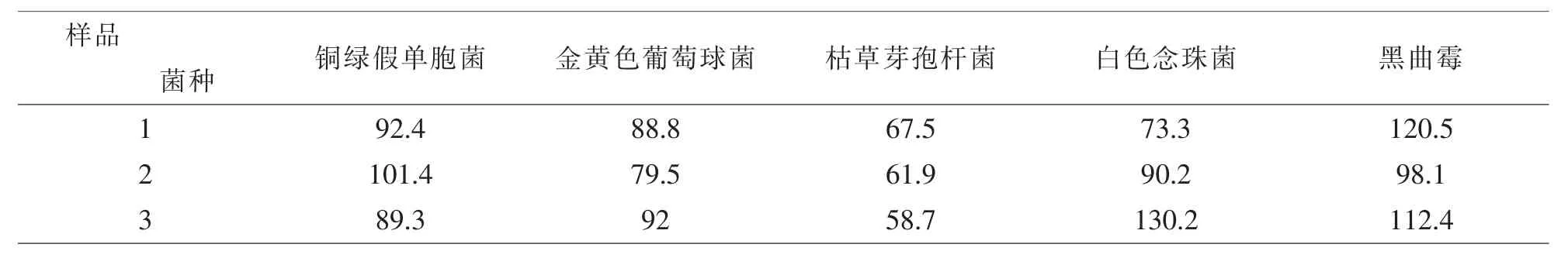
表2 培养基稀释法-各菌的回收率(0.2mL/皿)
4 结果与讨论
4.1 常规注皿法(1ml/皿)验证结果
按照常规注皿法对3批次样品进行细菌、霉菌和酵母菌计数验证,结果见表1常规法-各菌回收率(1mL/皿),验证结果表明稀释剂回收率均在50%以上,说明稀释剂二甲基亚砜对实验过程没有影响,可以用于样品制备;试验组菌回收率中,铜绿假单胞菌、金黄色葡萄球菌、黑曲霉菌回收率均在69~145%范围内,说明供试品对这三种菌没有抑菌性,枯草芽孢杆菌和白色念珠菌菌回收率低于50%,供试品对这两种菌有抑菌性.采用培养基稀释法(0.2ml/皿)对枯草芽孢杆菌和白色念珠菌进行再验证.
4.2 培养基稀释法(0.2ml/皿)验证结果
按照培养基稀释法对三批次样品进行重新验证,两种菌的回收率结果见表2培养基稀释法-各菌的回收率(0.2mL/皿),表明采用培养基稀释法(0.2ml/皿) 检查时,通过降低每个皿中药物浓度,而降低供试品的抑菌作用,使枯草芽孢杆菌和白色念珠菌的回收率均超过50%.验证结果表明,采用培养基稀释法可对利培酮的细菌、真菌及酵母菌进行限度检查.
5 结论
本品按照2015年版《中国药典》四部的要求进行验证,研究结果表明采用培养基稀释法可以有效的消除供试品的抑菌效果,5种试验菌的回收率均大于50%.
·利培酮微生物检验样品制备方法
取供试品10g,加入20ml二甲基亚砜,制成混悬液,加pH7.0氯化钠-蛋白胨缓冲液至100ml,混匀,作为1:10的供试品溶液.
·细菌、霉菌和酵母菌计数方法
取1:10供试液1ml等量分注于5个平皿中,每个平皿0.2ml,注入培养基混匀,培养计数.
〔1〕张华,王翔,等.注射用利培酮微球的制备和体外性质评价[J].中国新药杂志2013,22(20):2423-2430.
〔2〕国家药典委员会.中国药典:四部[S].北京:中国医药科技出版社,2015.140-149.
〔3〕严佳,钟桂香,贺金山,等.我国药品微生物限度检查的发展历程[J].药学实践杂志,2010,28(3):211-214.
〔4〕钟长鸣,陈希,吴燕红.微生物限度检查和无菌检查方法验证中存在问题[J].中国药品标准,2011,11(1):12-13.
〔5〕张国庆,程龙,杜建红,等.稀戊二醛溶液的微生物限度检查方法的建立及方法学验证 [J].中国现代应用药学, 2014,31(8):977-981.
〔6〕李趣嫦,江艳芳.《中国药典》2010版与2015版微生物限度检查法对四种药物检测结果的比较[J].中国药品标准, 2015,16(2):86-90.
〔7〕赵丽元,张兴哲,刘英慧.中和法在微生物限度检查中的应用[J].中国现代药学应用,20148(4):5-7.
〔8〕苑思坤,李玉芝,王红云.微生物限度检查薄膜过滤法供试液预处理方法探讨[J].中国药业,2010,19(18):42-43.
〔9〕霍昕,刘波,刘建华,等.抗菌消炎胶囊微生物限度检查法的建立及方法学验证[J].中国现代应用药学2012,29(12): 1121-1124.
〔10〕潘雯,关倩明,林玲.7种具有抑菌成分中成药的微生物限度检查方法验证[J].广州药学院报,2012,28(6):623-627.
〔11〕潘强.六种中药微生物限度检查方法验证[J].中国药品标准,2010,11(1):44-47.
〔12〕蒋超军,杨清敏,胡筱菲,等.新型微球PLGA微球制剂及体外释放研究[J].中国药学杂志,2011,46(2):124-127.
R446.5
A
1673-260X(2017)03-0166-02
2016-12-19
