维持性血液透析患者血管钙化与维生素K2摄入关系的研究
2017-04-06刘倩孟晓燕罗春明宋雪霞
刘倩+孟晓燕+罗春明+宋雪霞
[摘要] 目的 探讨维生素K2的摄入对降低血透患者血管钙化风险的效果。 方法 选择2014年5月~2016年5月于柳州市工人医院肾内科就诊的维持性血液透析患者75例作为研究对象。采用随机数字表法将其随机分为三组,分别给予不同剂量的维生素K2,即360 μg组、720 μg组及1080 μg组,每组25例,均分别采用维生素K2治疗8周,计算各组患者的血管钙化评分,观察并记录各组患者治疗前后基质Gla蛋白(MGP)的表达水平,并探讨其与维生素K2是否存在浓度相关性。本文所得数据采用SPSS 13.0进行建模处理,采用Spearman作相关性回归分析。 结果 与治疗前比较,治疗后三组血液透析患者血液中血管钙化评分均显著降低(P < 0.05);其中,以1080 μg组患者的下降率(56.16%)最为显著(P < 0.05)。与治疗前比较,治疗后三组血液透析患者血液中MGP水平均明显降低(P < 0.05),其中,以1080 μg组患者的下降率(46.37%)最为显著(P < 0.05)。另外,Spearman回归分析结果显示,摄入维生素K2剂量与MGP水平的变化存在负相关性(r = -0.19,P < 0.01);血清维生素K2浓度与血管钙化评分呈负相关(r = -0.51,P < 0.05)。 结论 摄入维生素K2剂量分别与MGP水平和血管钙化评分的变化存在负相关性,表明维生素K2的摄入可有效降低血液透析患者血管钙化的风险。
[关键词] 维生素K2;血管钙化;肾功能衰竭;血液透析
[中图分类号] R459.5 [文献标识码] A [文章编号] 1673-7210(2017)02(c)-0088-04
肾功能衰竭是指肾脏功能部分或全部丧失的病理状态,根据发病过程的不同可分为急性和慢性肾功能衰竭两种。其中,急性肾功能衰竭简称急性肾衰,是指由多种疾病导致两肾在短时间内丧失排泄功能,慢性肾功能衰竭是指各种原因导致的慢性肾病从发生、发展乃至晚期而出现的一系列临床症状组成的综合征。依照肾功能的损害程度,慢性肾功能衰竭被划分为4期:①患者无明显症状但肾贮备功能下降;②肾功能不全代偿期;③肾功能失代偿期(氮质血症期),表现为患者乏力、食欲不振和贫血;④患者具备典型的尿毒症症状。维持性血液透析(MHD)是肾功能衰竭患者最常采用的治疗方法之一,这类患者较其他人群更容易出现血管钙化,而血管钙化又是导致心血管事件及相关死亡的因素[1-2]。近年来,慢性肾脏疾病(CKD)中血管钙化相关发病机制的研究得到长足进展。以往认为血管钙化是一种与细胞外液钙磷代谢相关的被动过程,而目前认为其受血管平滑肌细胞(VSMCs)调节[1-2]。基质Gla蛋白(matrix Gla protein,MGP)是血管壁中VSMCs的强抑制剂之一[3],有研究显示MGP基因沉默的老鼠在6周内即死于严重的钙化[4]。研究显示血液透析患者维生素K2水平较低,且维生素K2在血管钙化患者体内维生素中所占比例较低[5-6],而维生素K2的补充是否可降低血液透析患者的风险鲜见相关研究。本研究将基于前期结果对MHD患者补充维生素K2,研究其血管钙化的相关情况。
1 资料与方法
1.1 一般资料
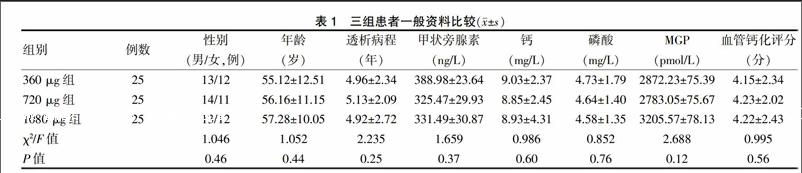
选择2014年5月~2016年5月于柳州市工人医院肾内科就诊行MHD的患者75例为研究对象。采用随机数字表法将其随机分为三组,分别给予不同剂量的维生素K2,即360 μg组、720 μg组及1080 μg组,每组25例。患者纳入标准:①年龄不低于18岁,透析龄≥3年的MHD患者,每周血透2~3次,2周内干体重稳定,透析经过顺利,血清白蛋白>30 g/L;②了解本研究的意义和需要检测的指标,自愿加入研究,入组前均签署知情同意书。排除标准:①在开始血透之前已患多年严重心脑血管疾病患者;②长期服用激素者;③有严重创伤、严重感染、未控制的慢性炎症;④存在严重影响研究的心脑血管疾病及活动性消耗性疾病、严重肝脏疾病;⑤严重低白蛋白血症;⑥患有活动性出血者。所纳入患者男40例,女35例;平均年龄(56.27±11.73)岁;透析病程(5.02±2.03)年;X线钙化评分为(4.19±2.52)分。经统计学分析,三组一般资料比较差异无统计学意义(均P > 0.05),具有可比性,见表1。
1.2 方法
摄入维生素K2前留取研究对象静脉血,采用酶联免疫吸附法(ELISA)检测血清MGP和维生素K2水平。采用飞利浦双板DR X光机完善该患者骨盆正位X光片和双手正位X光检查,评价髂动脉、股动脉、桡动脉及手指动脉钙化情况,并做血管钙化评分。之后每组患者口服相应剂量维生素K2(上海禾健营养食品股份有限公司生产,规格:0.36 mg/粒,批号:20140301),3次/周,共8周。之后再次留取静脉血标本,检测血清MGP和维生素K2水平。
1.3 X线血管钙化评分标准
参照Adragao等[7]提供的方法,采用2条线将骨盆X线平片分为4部分,水平线位于股骨头切面,垂直线位于脊柱位置;双手正位片共分为4部分,先以双手各作为一部分,再以掌骨上方做水平线进行分隔,共8个部位,计数每个部位的钙化,有计为1分,无计为0分,最终钙化评分为0~8分。
1.4 统计学方法
所有分析在SPSS 13.0中完成。计量资料采用均数±标准差(x±s)表示,组内治疗前后比较采用t检验,多组间统计检验采用方差分析,两两比较采用LSD检验。计数资料采用χ2检验,维生素K2与血管钙化的相关性采用Spearman相关分析。以P < 0.05为差异有统计学意义。
2 结果
2.1 三组患者治疗前后的血管钙化评分变化比较
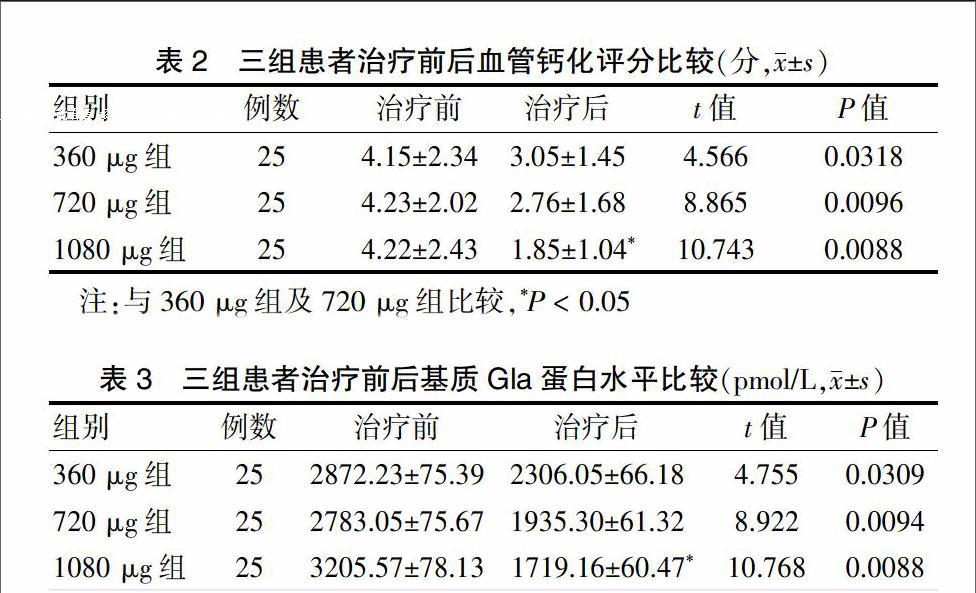
治疗后,三组患者X线钙化评分均较治疗前明显降低,差异均有统计学意义(P < 0.05)。1080 μg组患者治疗后血管钙化评分下降率为56.16%,明顯高于360 μg组(26.51%)及720 μg组(34.75%),差异有统计学意义(P < 0.05)。
2.2 三組患者治疗前后基质Gla蛋白水平比较
经统计学分析发现,三组患者治疗后MGP水平均明显低于治疗前,差异均有统计学意义(P < 0.05)。1080 μg组患者治疗后MGP下降率为46.37%,明显高于360 μg组(19.71%)及720 μg组(30.46%),差异均有统计学意义(P < 0.05)。
2.3 维生素K2与MGP水平、血管钙化评分相关分析
经Spearman相关分析显示,摄入维生素K2剂量与MGP水平的变化存在负相关性(r = -0.19,P < 0.01);血清维生素K2浓度与血管钙化评分呈负相关(r = -0.51,P < 0.05)。
3 讨论
MHD治疗是指采用血液透析或腹膜透析两种手段救治患者(特别是尿毒症患者)生命,或延长其寿命的过渡方法。受各种原因影响,国内外终末期肾病患者的病例呈现逐年递增趋势。目前,进行MHD的患者不但包括慢性肾炎所致的尿毒症,其他疾病(如糖尿病、高血压病等)导致的尿毒症亦是对患者采取维持性透析的常见原因。终末期肾病(ESRD)患者主要致死原因是心血管疾病,而血管钙化是心血管事件发生的主要因素之一[8-10]。所谓血管钙化是一项导致心血管疾病发生的重大危险因素,是一个类似于骨发育的、主动的、可调控的生物学过程。正因为类似于骨发生和代谢,它由内皮细胞、间叶细胞和造血细胞三者相互作用而成,同时也是由机械损伤、炎症、细胞新陈代谢、信号转导等所支配的骨质矿化的过程。动脉发生血管钙化的时候,钙元素以磷酸钙的形式沉积在脉管系统,渐渐积聚变多的磷酸钙能降低主动脉和支动脉的弹回率,机体内心血管系统的血流动力学因而发生改变,导致主动脉瓣狭窄、心脏肥厚、心肌和下肢缺血、高血压,以及充血性心力衰竭的发生,患者病死率大大提高。因此,血管钙化是高血压、糖尿病、血管损伤及CKD发生发展中的重要病理过程,可导致心肌缺血、心力衰竭、心室肥大及心脏顺应性的降低、血管壁硬化程度增加等[11-13]。因此对ESRD患者血管钙化相关因素的研究具有重要意义。
目前已有较多研究显示维生素K2的摄入可对冠状动脉的钙化起到明显缓解作用,但在血液透析的患者中是否具有相似作用,以及其机制并不完全明了[9-10]。目前研究显示MGP为软骨及血管的钙化抑制剂,有研究显示MGP基因沉默的老鼠在6周内即死于严重的钙化[4]。
MGP在对血管钙化缓解作用过程中,主要活性MGP为由维生素K2作为辅酶的未羧化-未磷酸化的MGP(desphosphorylated-uncarboxylated matrix Gla protein,dp-uc-MGP),故在维生素K2减缓血管钙化的过程中dp-uc-MGP起着举足轻重的作用[14-15]。本研究中利用ELISA技术检测的血清MGP实为dp-uc-MGP水平。
本研究通过不同剂量维生素K2的干预,对血液透析患者MGP水平及血管钙化相关性进行了探讨。其结果显示随着摄入维生素K2剂量的增高,血液MGP水平明显下降,提示MGP与维生素K2的水平呈现负相关关系(r = -0.19,P < 0.01);另一方面,血清维生素K2浓度越高,血管钙化评分越低,提示维生素K2是血液透析患者发生血管钙化的保护因素之一(r = -0.51,P < 0.05)。本研究结果与近两年来国内相关报道相吻合[15-17]。
尽管目前临床上已显示出维生素K2可对血管钙化起着抑制作用,但其具体机制仍不十分清楚。目前国内外学界存在以下几种观点[18-20]:①通过其Gla残基结合钙形成羟基磷灰石结晶,阻止钙过饱和及在血管壁中沉积。游离钙离子是MGP调节的重要信号,MGP可通过G蛋白介导的阳离子敏感机制对病理性钙化进行调节。②MGP可触发血管中层平滑肌细胞向骨软骨细胞前体分化,最终转分化为骨细胞和软骨细胞,参与血管钙化。③MGP通过调节碱性磷酸酶活性,参与骨形态发生蛋白2介导的骨发生过程。④研究发现MGP可以通过RNAKL途径调节血管钙化及骨的形成。
综上所述,本研究显示维生素K2的摄入可明显减缓血液透析患者血管钙化的风险,其一定程度范围的摄入剂量与钙化程度呈现负相关关系,但其最佳摄入剂量仍需进一步大样本、多中心临床研究予以证实。
[参考文献]
[1] Chen D,Gan H,Huang X,et al. Effects of peripheral blood mononuclear cells morphology on vascular calcification in uremic patients on maintenance hemodialysis [J]. Ther Apher Dial,2012,16(2):173-180.
[2] Wang XH,Zhang X,Mu CJ,et al. Effects of lanthanum carbonate on vascular calcification in elderly maintenance hemodialysis patients [J]. J Huazhong Univ Sci Technolog Med Sci,2015,35(4):508-513.
[3] Delanaye P,Krzesinski JM,Warling X,et al. Dephosphorylated-uncarboxylated Matrix Gla protein concentration is predictive of vitamin K status and is correlated with vascular calcification in a cohort of hemodialysis patients [J]. BMC Nephrol,2014,10(15):145-146.
[4] Luo G,Ducy P,McKee MD,et al. Spontaneous calcification of arteries and cartilage in mice lacking matrix GLA protein [J]. Nature,1997,386(6620):78-81.
[5] 潘健怡,张炜,胡海棠,等.维持性透析患者血管钙化的相关影响因素分析[J].广东医学,2015,36(19):3029-3031.
[6] Schmidt N,Brandsch C,Schutkowski A,et al. Dietary vitamin D inadequacy accelerates calcification and osteoblast-like cell formation in the vascular system of LDL receptor knockout and wild-type mice [J]. J Nutr,2014,144(5):638-646.
[7] Adragao T,Pires A,Lucas C,et al. A simple vascular calcification score predicts cardiovascular risk in haemodialysis patients [J]. Nephrol Dial Transplant,2004,19(6):1480-1488.
[8] Boger RH,Zoccali C. ADMA:a novel risk factor that explains excess cardiovascular event rate in patients with end-stage renal disease [J]. Atheroscler Suppl,2003,4(4):23-28.
[9] Munguia P,Caramelo R,Rubio MV,et al. Pre-Transplant Assessment of Vascular Calcification as a Risk Factor of Mortality,Graft Loss,and Cardiovascular Events in Renal Transplant Recipients [J]. Transplant Proc,2015,47(8):2368-2370.
[10] Vannini FC,Teixeira AS,Caramori JC,et al. Is Kauppila method able to detect the progression of vascular calcification and predict cardiovascular events in patients undergoing hemodialysis? [J]. Clin Nephrol,2016,85(2):84-91.
[11] Henaut L,Sanchez-Nino MD,Aldamiz-Echevarria CG,et al. Targeting local vascular and systemic consequences of inflammation on vascular and cardiac valve calcification [J]. Expert Opin Ther Targets,2016,20(1):89-105.
[12] 潘殊方,金領微,郑淑蓓,等.维持性血液透析患者冠脉钙化的影响因素分析[J].中国中西医结合肾病杂志,2016, 17(6):529-530.
[13] 张萍,杨丽南,阮一哲,等.透析后血压变化的影响因素及与血管钙化的相关性研究[J].西南国防医药,2015, 25(7):719-722.
[14] Malhotra R,Burke MF,Martyn T,et al. Inhibition of bone morphogenetic protein signal transduction prevents the medial vascular calcification associated with matrix Gla protein deficiency [J]. PLoS One,2015,10(1):e117098.
[15] 丁燕平,石宏斌.影响维持性血液透析患者生存率的相关因素[J].中国临床新医学,2015,8(3):286-290.
[16] 涂曦文,彭佑铭,唐东兴,等.维持性血液透析患者血管钙化及相关因素分析[J].中国动脉硬化杂志,2015,23(6):613-616.
[17] 宁雪飞,郭影丽,王术花,等.维持性透析患者血管钙化的相关影响因素研究[J].中外女性健康研究,2016,1(9):29-30.
[18] Yoshikawa K,Abe H,Tominaga T,et al. Polymorphism in the human matrix Gla protein gene is associated with the progression of vascular calcification in maintenance hemodialysis patients [J]. Clin Exp Nephrol,2013,17(6):882-889.
[19] 李剑莹,郝丽,张江淮,等.维持性血液透析血管通路现状及影响因素分析[J].安徽医科大学学报,2015,50(4):555-557.
[20] 尹飞挺,周婷婷,周岩,等.腹膜透析患者心血管钙化的发生率及影响因素[J].肾脏病与透析肾移植杂志,2015, 24(5):435-440.
(收稿日期:2016-11-08 本文编辑:张瑜杰)
