莲雾RNA提取方法的比较
2017-04-05马华青
沈 雁,刘 欢,马华青,陈 萍
(热带作物种质资源保护与开发利用教育部重点实验室/海南大学 园艺园林学院,海南 海口 570228)
莲雾RNA提取方法的比较
沈 雁,刘 欢,马华青,陈 萍*
(热带作物种质资源保护与开发利用教育部重点实验室/海南大学 园艺园林学院,海南 海口 570228)
用莲雾成熟的果实作为实验材料,选用方法1(试剂盒法)、方法2(改良的CTAB法1)、方法3(改良的SDS法1)等5种不同的方法提取莲雾果实的RNA,并且比较了它们的提取效果。实验结果表明:方法4(改良的CTAB法2)对莲雾果实RNA的提取效果最好,不仅能够有效地抑制多糖、多酚以及次生代谢产物对莲雾果实RNA提取的影响,而且所提取的RNA完整性较好且纯度较高。
莲雾;果实;RNA;提取方法;SDS;CTAB
莲雾,别名金山蒲桃、洋蒲桃、水蒲桃等,是桃金娘科蒲桃属热带常绿乔木果树。原产地为马来半岛及安达曼群岛。目前,我国台湾、广东、福建、海南、广西、云南和四川均有栽培,其中台湾栽培最多[1]。莲雾的用途很广,其树姿优美,花期长,是园林绿化、观光和盆景栽培的优良树种;而且它的果实富含多种营养成分,有“水果皇帝”之称。其具有经济、营养、食用、药用、保健、观赏等多种价值[2]。
国内外在莲雾种质资源遗传多样性、异地引种育种、生物学特性、生理生化特性、营养成分及代谢机制、栽培管理技术、遗传特性、病虫害防治、贮藏保鲜及采后生理代谢等方面的研究均有报道,目前没有对莲雾的起源、演变、品种选育、抗病机理等方面的研究报道[1]。从莲雾果实中提取RNA是进行莲雾分子生物学研究的重要环节之一,要进行Northern(印迹)杂交分析、纯化mRNA以用于体外翻译或建立cDNA文库、RT- PCR及差示分析等分子生物学研究[3],都需要高质量的RNA。因此,从莲雾果实中提取纯度高、完整性好的RNA是顺利进行上述研究的关键所在。但是莲雾果实富含多糖、多酚、次生代谢产物等物质[2],而且果实中水分含量极高,这导致提取RNA难度增大,产率低。针对莲雾的这些特点,本文比较了改进的CTAB法、SDS法、RNA提取试剂盒等5种不同的提取方法。在改良CTAB法的基础上,针对莲雾果实中富含多酚和多糖的特点加以改进,获得了纯度和完整性较理想的RNA,可用于cDNA文库构建、DDRT-PCR(差示分析)和Northern Blot等研究[4]。
1 材料与方法
1.1 实验材料
RNA容易降解,所以提取难度较大,要求所用材料一定要新鲜。本试验所用的是莲雾的果实,采自海南大学儋州校区东门的红宝石莲雾果树上,果实较为新鲜,采回后一直放于冰箱中保鲜。在做实验时,采用-180 ℃液氮将供试莲雾果实研磨成粉末状,现磨现用,能够满足本实验的要求。
1.2 实验主要用具
剪刀、移液管、蒸馏水桶、烧杯、量筒、容量瓶、试剂瓶、2 mL Eppendorf管、药匙、玻璃棒、离心管架、电泳槽,1~10、1~40、20~200、40~200、100~1000 μL移液枪及其配套移液枪吸嘴,中号研钵及研棒、液氮罐、一次性PE手套、一次性口罩、称量纸等。
1.3 实验主要仪器
TGL-16G-A型高速冷冻离心机(上海安亭科学仪器厂);核酸蛋白分析仪(美国GE, NanoVue); HH-8数显恒温水浴锅(金坛市富华仪器有限公司);格兰仕WD750型微波炉(佛山市格兰仕微波炉电器有限公司);电泳仪(Germany);凝胶成像系统(美国DBT-2000W);101-3型干燥箱(上海市实验仪器厂);HVE-50型立式全自动高压灭菌锅(Japan);纯水机(WP-UP-|||-20,四川,沃特尔);电子天平(PB 303-N,梅特勒-托利多仪器有限公司);冰箱(Hair BCD-241WE);搅拌机(HJ-6多头磁力加热搅拌器)等。
1.4 实验主要试剂
EDTA、Tris-HCl、Tris碱、PVP、β-巯基乙醇、酚、氯仿、异戊醇、75%酒精、氯仿、无水乙醇、2% CTAB、NaCl、SDS、NaAc、Tris-苯酚、氯仿、冰乙酸、异丙醇、浓HCl、液氮、KAc、双蒸水、天根RNAPLANT试剂盒、70%无水乙醇。
1.5 实验试剂的配制
1.5.1 常规实验试剂在室温下的配制 1 mol/L的Tris-HCl (pH 8.0):称取12.11 g Tris碱,加80 mL水溶解,用浓HCl调节pH至8.0,加水定容至100 mL,高压灭菌。1 mol/L的Tris-HCl (pH 7.4):称取12.11 g Tris碱,加80 mL水溶解,用浓HCl调节pH至8.0,加水定容至100 mL,高压灭菌。0.5 mol/L EDTA (pH 8.0):称取18.61 g二水乙二胺四乙酸二钠(EDTANa2·2H2O),加80 mL水溶解,用NaOH调节pH至8.0,定容至100 mL,高压灭菌。10%SDS:称取10 g SDS,加80 mL水溶解,再加水定容至100 mL。10%CTAB:称取10 g CTAB,加80 mL水溶解,再加水定容至100 mL。氯仿-异戊醇(24∶1):按体积比例量取需要的氯仿和异戊醇,相互混合拌匀。酚-氯仿-异戊醇(25∶24∶1):取一定体积的氯仿-异戊醇混合溶液,再和同体积的酚混合。75%乙醇:量取75 mL无水乙醇,与20 mL水混合,再加水定容至100 mL。3 mol/L KAc (pH 4.8):称取29.442 g KAc晶体,加入80 mL双蒸水,再用冰乙酸调节pH为4.8,定容至100 mL,高压灭菌,4 ℃保存。NaCl (5 mol/L):称取NaCl 29.22 g,加90 mL双蒸水,加热80 ℃溶解,冷却,再用双蒸水定容至100 mL,高压灭菌20 min。NaAc (3 mol/L, pH 5.2):称取NaAc晶体40.824 g,加60 mL双蒸水,用冰乙酸调节pH为5.2,加双蒸水定容至100 mL,高压灭菌20 min,4 ℃保存。NaAc (1 mol/L, pH 5.5):称取NaAc晶体13.608 g,加60 mL双蒸水,用冰乙酸调节pH为5.5,加双蒸水定容至100 mL,高压灭菌20 min,4 ℃保存。10%PVP-40:称取10 g PVP,加80 mL水溶解,再加水定容至100 mL。
1.5.2 提取缓冲液的配制
1.5.2.1 方法2(改良的CTAB法1)提取缓冲液 其主要试剂成分为:2%CTAB、0.02 mol/L EDTA (pH 8.0)、1.4 mol/L NaCl、2%PVP、0.1 mol/L Tris-HCl (pH 8.0)、2%β-巯基乙醇。该提取液的配制:10%的CTAB 5 mL、0.5 mol/L EDTA(pH 8.O) 1 mL、5 mol/L NaCl 7 mL、10%PVP 5 mL、1 mol/L Tri-HCl (pH 8.0) 2.5 mL,加双蒸水定容到25 mL;β-巯基乙醇现用现加。
1.5.2.2 方法3(改良的SDS法1)提取缓冲液 其主要试剂成分为:0.1 mol/L Tris-HCl (pH 7.4)、2%SDS、1.4 mol/L NaCl、2%PVP、0.05 mol/L EDTA (pH 8.0)、2%β-巯基乙醇。该提取液的配制:10%SDS 5 mL、0.5 mol/L EDTA (pH 8.0) 2.5 mL、1 mol/L Tris-HCl (pH 7.4) 2.5 mL、5 mol/L NaCl 7 mL、10%PVP 5 mL,加双蒸水定容至25 mL;β-巯基乙醇为用前加入。
1.5.2.3 方法4(改良的CTAB法2)的提取缓冲液 称取CTAB 0.5 g、NaCl 2.0445 g,量取0.5 mol/L EDTA 1 mL、1 mol/L Tris-HCl (pH 8.0) 2.5 mL,先用10 mL双蒸水溶解,再定容至25 mL;β-巯基乙醇为用前加入。
1.5.2.4 方法5(改良的SDS法2)提取缓冲液 取用1.25 mL 1 mol/L Tris-HCl(pH 8.0)、0.7 mL 5 mol/L NaCl、0.5 mL 0.5 mol/L EDTA、5 mL 10%SDS、12.5 mL 10%PVP,加双蒸水定容至25 mL;β-巯基乙醇为用前加入。
1.6 RNA的提取方法
1.6.1 方法1(改良的天根RNAPLANT试剂盒提取法) 其基本步骤如下:(1)取不多于0.1 g的新鲜的莲雾果实粉末,移入无RNase的2 mL Eppendorf管中,加700 μL提取试剂(4 ℃),再加入20 μL 10%SDS、30 μL 10%PVP,震荡至彻底混匀;(2)室温平放离心管5 min;(3)在4 ℃以12000 r/min离心10 min。将上清转入无RNase离心管;(4)加入150 μL 5 mol/L NaCl,温和混匀;(5)加入450 μL氯仿/异戊醇(24∶1),上下颠倒混匀;(6)在4 ℃下以12000 r/min离心10 min。取上层水相转入新的无RNase离心管;(7)加与所得水相等体积的异丙醇,混匀,室温放置30 min;(8)4 ℃,12000 r/min,离心25 min。弃掉上清。加1 mL 70%无水乙醇;(9)4 ℃,5000 r/min,离心3 min,倒出液体,不要倒出沉淀。将剩余的少量液体短暂离心,然后用枪头吸出,室温晾干2~3 min;(10)加15 μL双蒸水,反复吹打、混匀,充分溶解RNA,-20 ℃保存备用。
1.6.2 方法2(改良的CTAB法1) 基于叶开玉[5]的方法并有所改动。操作步骤:(1)将800 μL 2% CTAB抽提液加入2 mL离心管中,65 ℃水浴预热30 min;(2)称取0.1 g样品,加入液氮研磨至粉末状,迅速转入2 mL离心管,加入10 μL β-巯基乙醇,充分混匀,65 ℃水浴1.5 h;(3)4 ℃下以12000 g离心10 min;(4)取上清液于新的离心管中,加入等体积的水饱和酚/氯仿/异戊醇(25∶24∶1),上下颠倒混匀,冰上放置15 min,在4 ℃下以12000 g离心5 min;(5)取上清液于新的离心管中,加入1/20体积5 mol/L KAc (pH 5. 0)、1/10体积的无水乙醇、等体积的氯仿/异戊醇(24∶1),轻轻混匀,冰上放置15 min,在4 ℃下以12000 g离心10 min;(6)重复步骤(5),直到上下相之间无明显界面为止;(7)取上清液,分装入新的2 mL离心管中,加入等体积的异丙醇,室温放置30 min;(8)以10000 r/min离心25 min,去上清,用70%乙醇洗1次;(9)弃上清液,风干,加入15 μL双蒸水溶解,放入冰箱内备用。
1.6.3 方法3(改良的SDS法1) 基于叶开玉[5]的方法并有所改动。操作步骤:(1)取0.1 g莲雾组织材料,于液氮中充分研磨成粉末状,迅速移到2 mL离心管中,加入800 μL提取液,再加入10 μL β-巯基乙醇,充分混匀。冰上静置5 min,4 ℃下以12000 r/min离心10 min;(2)取上清液于新的离心管中,加入等体积的水饱和酚/氯仿/异戊醇(25∶24∶1),上下颠倒混匀,在4 ℃下以12000 r/min离心10 min;(3)取上清液于新的离心管中,加入1/20体积5 mol/L KAc (pH 5. 0)、1/10体积的无水乙醇、等体积的氯仿/异戊醇(24∶1),轻轻混匀,冰上放置10 min,在4 ℃下以12000 r/min离心10 min;(4)取上清液于新的离心管中,加入等体积的氯仿/异戊醇(24∶1)抽提1次;(5)重复步骤(4),直到上下相之间无明显界面为止;(6)取上清液,分装入新的2 mL离心管中,加入等体积的异丙醇,室温放置30 min;(7)以10000 r/min离心25 min,去上清,用70%乙醇洗1次;(8)弃上清液,风干,加入15 μL双蒸水溶解,放入冰箱内备用。
1.6.4 方法4(改良的CTAB法2) 根据周鹏的CTAB法[6]并有所改动。基本步骤如下:(1)取装有0.1 g莲雾果实粉末的2 mL离心管2个,分别加入800 μL CTAB提取缓冲液、36 μL 10%PVP、10 μL β-巯基乙醇,轻轻上下晃动,充分混合;(2)65 ℃水浴30 min;(3)放入离心机内以10000 r/min离心10 min。取上清,加入等体积的酚∶氯仿∶异戊醇(25∶24∶1)溶液,在4 ℃下以12000 r/min离心10 min;(4)取上清转入新的离心管,加入等体积的氯仿/异戊醇(24∶1),以10000 r/min离心10 min;(5)重复步骤(4),直到无明显分层;(6)取上清液,加入等体积的异丙醇,室温放置30 min;(7)以10000 r/min离心25 min,去上清,用70%乙醇洗1次;(8)弃上清液,风干,加入15 μL双蒸水溶解,放入冰箱内备用。
1.6.5 方法5(改良的SDS法2) 根据张今今[4]的SDS法并有改动。基本步骤如下:(1)取装有0.1 g莲雾果实粉末的2 mL离心管2个,分别加入800 μL的提取缓冲液,再加入23 μL 10%SDS、34 μL 10%PVP、10 μL β-巯基乙醇,轻轻充分摇匀;(2)65 ℃水浴10 min;(3)取上清,加入等体积的酚∶氯仿∶异戊醇(25∶24∶1)溶液,在4 ℃下以12000 r/min离心15 min;(4)取上清转入新的离心管,加入等体积的氯仿/异戊醇(24∶1),以10000 r/min离心15 min;(5)取上清,加入等体积的异丙醇,室温放置30 min;(6)在4 ℃下以10000 r/min离心20 min;(7)弃上清液,用70%乙醇洗1次;(8)弃上清液,自然风干,用15 μL双蒸水溶解,放入冰箱备用。
1.7 RNA纯度和完整性的检测方法
1.7.1 RNA完整性的检测 采用1%的琼脂糖凝胶电泳[7]检测莲雾果实RNA的完整性。具体步骤如下:将制胶用具用70%乙醇冲洗1遍,晾干备用;称取1.0 g琼脂糖,置入干净的200 mL锥形瓶中,加入100 mL 0.5×TBE电泳缓冲溶液,微波炉内加热1 min使琼脂糖彻底溶化均匀;待胶冷却至60~70 ℃时,向其中加入10 μL核酸染料,混合均匀,小心倒入胶膜内,凝成1 cm左右的厚度,在室温下放置30 min;待凝胶形成后,将其置于0.5×TBE电泳缓冲液中,将抽提的RNA分别取3 μL与1 μL 6×溴酚蓝上样缓冲液混合均匀后用移液枪点样;在电泳槽内加入0.5×TBE缓冲液,于200 V/mL的电压下电泳;电泳结束后,在紫外灯下检查结果。
从完整的RNA图谱上可以清晰看到28sRNA、18sRNA和5sRNA三条带,并且28sRNA的亮度大概是18sRNA亮度的两倍,表明所提取的RNA样品比较完整,没有多少降解[8-9]。如果两条带的亮度反过来,则说明28sRNA已经降解成18sRNA的大小;如果没有清晰的带状,则说明样品已经发生了严重的降解;如果在点样槽内或其附近有荧光物质,则说明RNA样品已经被DNA所污染[9]。
1.7.2 RNA纯度的检测方法 可以用紫外分光光度计进行RNA纯度的检测,以评价各种方法提取的RNA的质量。即可用OD260/OD280比值来鉴定RNA纯度,纯的RNA溶液的OD260/OD280值应该在1.7~2.0之间[9]。如果RNA的OD260/OD280<1.8,则说明有蛋白质、酚的污染;如果OD260/OD280大于2.0,则说明RNA有所降解[10]。对于RNA纯制品,其 OD260/OD280≈2.0。OD260/OD280<2.0可能是蛋白污染所致[10-11],可以通过适当增加PVP的量[12]以及增加酚的抽提次数[13]来改善。
2 结果与分析
电泳图谱结果(图1)显示,所选用的5种方法都能够从莲雾的果实中提取出RNA。
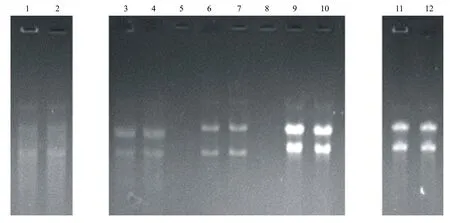
泳道1和2:方法1提取的RNA;泳道3和4:方法2提取的RNA;泳道6和7:
实验结果表明:用方法4提取的RNA完整性好、纯度高、RNA产率高,OD260/OD280接近2.0,满足实验的要求。从凝胶图谱(图1)上可以清晰地看到用方法4所提取RNA的28sRNA和18sRNA两条明亮的带,且28sRNA的亮度是18sRNA亮度的2倍;同时还可以看到5sRNA带,说明所提取的RNA完整性好,没有发生降解[14]。由表1可知,用方法4提取的RNA的OD260/OD280接近2.0,浓度为384.4 μg/mL,说明所提取的RNA纯度较高。从实验所用时间来看,方法4所用时间最短,实验操作更为简便。方法1即天根试剂盒法虽然也能提取出RNA,但是28sRNA和18sRNA两条带亮度相近且两条带不明显;通过紫外分光光度法进行RNA纯度检测,其OD260/OD280为2.289,大于2.0,说明RNA降解严重。用方法2提取的18sRNA和28sRNA两条带明显,但是亮度相近[15],其OD260/OD280值大于2.0,说明RNA发生了降解。方法2实验耗时4.9 h之久,步骤繁多。从图1可以明显看到方法3所提取的18sRNA和28sRNA亮度明显,RNA的完整性较好,但是其OD260/OD280值为1.554,小于1.80,说明有杂质(蛋白质、酚等)未去除,纯度较差[16]。方法5所提取的28sRNA和18sRNA两条带亮度都很明显,但是这两条带亮度相近,说明RNA已经发生了降解;且两条带的带型不整齐,呈向上凸起拖尾状,说明其中有杂质;且点样孔中有荧光物质,说明RNA已经被DNA污染。综上所述,方法4提取莲雾果实RNA的效果最显著,耗时短,所得RNA纯度较高且比较完整,可以用于后续的分子生物学实验。

表1 5种不同方法提取的莲雾果实总RNA 纯度的比较
3 小结与讨论
3.1 小结
本实验采用了5种不同的方法,每种方法都有各自的特点。方法4实用、经济,步骤少,耗时短,比一般的试剂盒要便宜得多,所得RNA产率及纯度也很高,对莲雾果实RNA的提取效果明显,是提取莲雾果实RNA的最佳方法。天根试剂盒法虽然简便,但是价格昂贵且有毒,对莲雾果实RNA的提取效果不明显,产量低。而其他3种方法都是常用的RNA提取方法,对莲雾果实RNA的提取效果较差,所提取的RNA不能满足后续分子生物学研究的要求。
3.2 讨论
莲雾果实中富含多糖、酚类以及蛋白质[2]。这些成分的存在都会对莲雾RNA的提取造成一定的影响。在莲雾果实成熟后,果实内的次级代谢产物增多,在研磨后果实内的酚类物质会释放出来,酚类物质很容易被氧化,氧化后会使匀浆液变为褐色,并随氧化程度的增加而加深,产生褐化效应[3]。同时酚类能与RNA稳定结合,从而影响RNA的提取;加之成熟后果实内水分含量增加,样品的产率降低,这些对莲雾果实RNA的提取造成了很大的障碍。阻止酚类物质与RNA结合[16],是莲雾果实RNA提取的关键。PVP是一种高效的螯合剂[5],它与酚具有很强的结合能力,能抑制酚类氧化成醌类物质,有效地防止其与莲雾果实RNA的结合[4,17]。同时β-巯基乙醇是一种强还原剂,能防止多酚氧化[4,19]。这两者结合使用可以有效地控制酚类物质与RNA结合。
本实验所用的方法4即改良的CTAB法2,其提取液中的CTAB能有效地和蛋白质结合;β-巯基乙醇可以很好地防止褐变效应[20];PVP能很好地抑制多酚氧化物的产生[21];高浓度的NaCl可以有效去除多糖的影响[21]。用氯仿/异戊醇(24∶1)抽提2次可以有效除去残留的DNA,防止DNA对RNA的污染[22],所以用这种方法提取的RNA完整性好,纯度较高,能满足后续实验的要求。其他几种方法提取RNA的效果较差,可能是因为莲雾果实中富含多酚、多糖,可在后续试验中进一步改良,适当多加PVP、CTAB可有效除去多酚、多糖的影响。
3.3 本实验的改良之处
将实验步骤中的用氯仿抽提改为用氯仿∶异戊醇(24∶1)抽提,这样分层更明显、效果更好。将提取液、材料混匀水浴或冰浴后的直接抽提改为先离心再抽提,这样抽提效果更好,去除DNA和蛋白质的效果明显。
在最后一步用70%的乙醇洗涤RNA沉淀时,若吸取乙醇废液困难,则可将样品在4 ℃下以5000 r/min离心5 min;然后先用大移液枪,再用小移液枪,轻轻地把乙醇给吸取出来,尽量把离心管内的乙醇吸取干净。这样做的好处是干燥RNA沉淀时所用的时间短,可以降低RNA沉淀的损失以及污染,同时减少乙醇对后续操作的不利影响。
针对莲雾果实中多糖、多酚的特性,适当加大PVP和提取液的量,有效控制多糖、多酚及蛋白质对提取效果的影响。
在抽提上清的过程中,动作一定要轻,不能取到中间层,这关系到所提取RNA的质量。
在加完异丙醇后,室温静置30 min,然后再离心;离心时间改为30 min左右,这样沉淀效果更明显。
[1] 杨荣萍,陈贤,张宏,等.莲雾研究进展[J].中国果菜,2009(1):41-43.
[2] 周红玲,郑加协,陈石.浅谈莲雾的价值[J].中国园艺文摘,2011(8):156-157.
[3] 李宏,王新力.植物组织RNA提取的难点及对策[J].生物技术通报,1999(1):36-39.
[4] 张今今,王跃进,王西平,等.葡萄总RNA提取方法的研究[J].果树学报,2003(3):26-29.
[5] 叶开玉.龙眼组织总RNA提取与纯化方法的研究[J].农业科技:园艺,2008(3):208-211.
[6] 杜道林,马文儒,苏杰,等.SDS、CTAB和PVP法提取香蕉基因组DNA的比较研究[J].海南师范学院学报:自然科学版,2003(1):76-82.
[7] 冯图,黎云祥.几种药用植物基因组DNA提取方法研究[J].毕节学院学报,2011,29(8):98-101.
[8] 朱东阳,尹继庭,丁勇.樟叶越桔叶芽总RNA提取方法比较研究[J].西部林业科学,2013,42(1):81-85.
[9] 王关林,方宏筠.植物基因工程原理与技术[M].北京:科学出版社,1998:611-614.
[10] 王爽.番茄果实总RNA提取方法的定量比较分析[J].西北农业学报,2012,12(12):112-115.
[11] 刘丹,高庆玉,张丙,等.树莓果实总RNA提取方法的比较研究[J].北方园艺,2011(1):136-138.
[12] 葛晓萍,石瑛璨.一种适合富含多糖、多芬植物的RNA提取方法[J].青岛科技大学学报,2007(1):6-8.
[13] 陈晖,何海福.植物总组织RNA提取方法的进展研究[J].甘肃农业,2006(8):226.
[14] 周玉亭,王钰.苹果RNA提取方法的探索[J].运城学院学报,2010,28(5):43-44.
[15] 巩艳明,曹后男,宗成文,等.三种方法提取不同品种梨叶片总RNA[J].湖北农业科学,2011,50(15):3204-3206.
[16] 陈萍,姜成东,卢业凌.番木瓜叶片总RNA提取方法比较研究[J].北方园艺,2010(18):133-185.
[17] 程水源,陈昆松,杜何为,等.银杏RNA的提取[J].果树学报,2005,22(4):428-429.
[18] Ainsworth C. Isolation of RNA from floral tissue ofRumexacetosa(Sorrel)[J]. Plant Mol Biol Reptr, 1994(12): 198-203.
[19] Manning K. Isolation of nucleic acids from plants by differential solvent precipitation [J]. Anal Biochem, 1991, 195: 45-50.
[20] 胡根海,喻树迅.利用改良的CTAB法提取棉花叶片总RNA[J].棉花学报,2007,19(1):69-70.
[21] 杨晓燕.葡萄叶片中提取总RNA的三种方法比较[J].北方园艺,2013(2):87-90.
[22] Fang G, Hammar S, Grumet R. A quick and inexpensive method for removing polysaccharides from plant genomic DNA [J]. Bio Techniques, 1992(1): 52-56.
(责任编辑:黄荣华)
Comparison of Several Methods for RNA Extraction from Wax Apple
SHEN Yan, LIU Huan, MA Hua-qing, CHEN Ping*
(Key Laboratory of Tropical Crop Germplasm Resources Protection and Genetic Improvement, Ministry of Education /College of Horticulture and Landscape Architecture, Hainan University, Haikou 570228, China)
Five different methods, including method 1 (kit method), method 2 (improved CTAB method one) and method 3 (improved SDS method one), were used to extract RNA from the mature fruits of wax apple, and their extraction effects were compared. The experimental results showed that the method 4 (improved CTAB method two) had the best RNA-extracting effect, and it not only could effectively restrain the influences of polysaccharides, polyphenols and secondary metabolites on the RNA extraction from the fruits of wax apple, but also could obtain relatively complete and high-purity RNA.
Wax apple; Fruit; RNA; Extraction method; SDS; CTAB
2016-10-24
海南大学教育教学研究课题立项项目(hdjy1303);海南省教育厅高等学校科学研究项目(教育教学改革研究) (HNJG2014-05);海南省自然科学基金项目(20153061)。
沈雁(1980─),女,助理研究员,硕士,从事热带果树遗传育种研究。*通讯作者:陈萍。
Q522
A
1001-8581(2017)03-0043-05
