水稻HGO基因启动子的克隆及转化鉴定
2017-04-05陈彦成黄丽华支添添任春梅
蔡 薇,陈彦成,黄丽华,支添添,任春梅,3*
(1.湖南农业大学 生物科学技术学院,湖南 长沙 410128;2.湖南省水稻研究所,湖南 长沙 410125;3.作物基因工程湖南省重点实验室,湖南 长沙 410128)
水稻HGO基因启动子的克隆及转化鉴定
蔡 薇1,陈彦成2,黄丽华1,支添添1,任春梅1,3*
(1.湖南农业大学 生物科学技术学院,湖南 长沙 410128;2.湖南省水稻研究所,湖南 长沙 410125;3.作物基因工程湖南省重点实验室,湖南 长沙 410128)
HGO是编码酪氨酸降解途径中尿黑酸1,2双加氧酶的基因。探讨了水稻HGO基因的表达特征,构建了水稻HGO基因启动子与GUS表达载体,采用农杆菌介导的浸花法将该表达载体转入拟南芥中,获得转基因植株。通过GUS组织化学染色法检测,发现水稻HGO基因启动子在拟南芥根、下胚轴、叶柄和子叶中高度表达,在真叶中只有叶脉和叶尖上有微弱的表达。
水稻;HGO基因;启动子;载体构建
酪氨酸降解途径是动物体内必不可少的一条代谢途径[1],在酪氨酸降解途径中,首先是酪氨酸氨基转移酶将酪氨酸催化生成对羟基苯丙酮酸,接着被对羟基苯丙酮酸双氧化酶分解生成尿黑酸,然后在尿黑酸1,2双加氧酶(homogentisate dioxygenase,HGO)的作用下氧化形成马来酰乙酰乙酸,再经马来酰乙酰乙酸异构酶作用形成延胡索酰乙酰乙酸,最后在延胡索酰乙酰乙酸酶(fumarylacetoacetate hydrolase,FAH)的作用下形成乙酰乙酸和延胡索酸进入三羧酸循环彻底分解[2]。在动物体中,FAH的缺乏会导致Ⅰ型遗传性酪氨酸血症,先天缺乏HGO会导致尿黑酸血症。但酪氨酸降解途径在植物中的作用机制尚不完全清楚[3-4]。
前期研究分离得到一个拟南芥短日照依赖型突变体sscd1,它在短日照条件下(8 h光照/16 h黑暗)发生细胞死亡,通过图位克隆的方法得出其编码延胡索酰乙酰乙酸酶FAH是酪氨酸降解途径中最后一个酶[5-6]。尿黑酸1,2双加氧酶(HGO)位于FAH的上游,前期研究发现,拟南芥双突变体sscd1hgo能够抑制sscd1的细胞死亡。进一步研究hgo单突变体,发现其不仅不会出现细胞死亡,且在幼苗期植株长势强于Col-0野生型[7-8]。
水稻作为我国最主要的粮食作物,对其基因启动子的克隆及分析有助于深入了解其基因的功能[9]。此前将水稻HGO基因与拟南芥HGO进行同源性比对,发现两者具有较高的同源性;因此对水稻HGO基因进行克隆并转入拟南芥sscd1hgo双突变体中,细胞死亡表型再次出现,证明水稻HGO基因可互补拟南芥HGO基因[7]。为了深入研究水稻HGO基因的表达特征,克隆水稻HGO基因启动子并转入拟南芥中以观察其表达情况。
本研究构建了水稻HGO基因启动子与GUS表达载体的重组表达载体,将其转入拟南芥中,通过抗性筛选获得了稳定遗传的转基因植株,利用GUS染色检测水稻HGO基因启动子的表达活性,旨在分析水稻HGO基因在拟南芥上的组织表达特征。
1 材料与方法
1.1 实验材料
拟南芥(Arabidopsisthaliana)野生型Col-0、水稻粳稻品种日本晴(OryzasativaL. cv. Nipponbare)、大肠杆菌(Escherichiacoli)DH5α,根癌农杆菌(Agrobacteriumtumefactions)GV3101,载体pCAMBIA1301由作物基因工程湖南省重点实验室植物信号传导课题组保存。
1.2 植物的生长
1.2.1 水稻的生长 剥去成熟水稻种子的外壳,置于70%乙醇中浸泡90 s,弃去乙醇;用0.1% HgCl溶液浸泡种子15 min,倒掉HgCl;在超净工作台上用无菌水清洗4~5次,将种子放置在铺有湿润滤纸的培养皿中,在培养箱中28 ℃,14 h光照/10 h黑暗培养。
1.2.2 拟南芥的生长 用消毒液(20% bleach+0.1% Triton 100)浸泡拟南芥种子10 min后,在超净工作台上用无菌水清洗4~5次,播种在MS固体培养基上,放置4 ℃黑暗处理3 d后,放置培养室生长,培养温度为(22±2) ℃;光周期为16 h光照/8 h黑暗。待生长7 d后,将其移栽到营养土(东北黑土与蛭石的体积比为1∶1)中,盖上透明塑料薄盖生长1~2 d,置于培养室内生长。
1.3pOsHGO∷GUS表达载体的构建
1.3.1 设计引物及目的片段的扩增 在NCBI网站上找到水稻HGO基因的启动子序列,在线分析其包含的顺式作用原件(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)。利用软件Primer Premier 5.0,根据网站上公布的启动子序列设计1对扩增引物HGO-F/HGO-R,分别在上下游引物的5′端分别加上XbaⅠ和NcoⅠ酶切位点及其保护碱基,PCR扩增目的片段大小预期为1514 bp。引物序列如下:
HGO-F,5′-GCTCTAGATGTTTGTTGTGTTGGTGAGAT-3′
HGO-R,5′-CATGCCATGGAGAGGGAGAAGGACAA-3′
引物的预测退火温度为66 ℃,根据预测温度设计PCR的温度梯度分别为64、66和68 ℃,得到最适温度为68 ℃。用CTAB[10]法提取三叶期水稻总DNA,以此为模板进行PCR扩增。扩增后的PCR产物经1.0%琼脂糖凝胶电泳检测后切胶回收并纯化。
1.3.2 载体重组及农杆菌的转化 用XbaⅠ和NcoⅠ限制性内切酶对目的片段及pCAMBIA1301载体进行双酶切,用T4连接酶将带有相同粘性末端的目的片段和载体于37 ℃下过夜连接,使HGO基因启动子替换pCAMBIA1301载体上原有的35 S启动子。通过热激法将连接产物转化至大肠杆菌DH5α,随机挑选阳性克隆进行菌落PCR及酶切检测,酶切正确的送上海铂尚公司进行测序。将测序验证正确的阳性克隆进行摇菌和质粒的提取,通过电击法转化到根癌农杆菌GV3101中,进行菌落PCR鉴定和质粒PCR验证。
1.4 拟南芥的转化与GUS染色
挑选经验证成功转入重组载体的农杆菌阳性菌落置于含有卡那霉素(50 mg/L)、庆大霉素(50 mg/L)、利福平(25 mg/L)的YEB液体培养液中活化处理,在28 ℃下220 r/min振荡培养18~24 h。6000 g离心大量活化菌液2 min,弃上清液,用农杆菌悬浮液(5%蔗糖+1/2MS+0.02% Silwet-L77+0.01% 6-BA)将菌体重悬至OD600在0.6~1.0之间。采用浸花法[11]转化拟南芥。
收取T0代种子,在含有潮霉素(25 mg/L)的MS培养基上筛选成功转入pOsHGO∷GUS表达载体的转基因植株,选取生长7~9 d抗性苗移栽至营养土中生长。收取T1代种子铺种在含潮霉素(25 mg/L)的MS培养基上,得到分离比为3∶1的抗性苗和不抗苗。挑选抗性苗移栽至营养土中生长,得到T2代纯合种子。将T2代的纯合种子铺种在含潮霉素(25 mg/L)的MS培养基上,选取生长7~9 d的抗性苗,同时取相同生长状况的转入pCAMBIA1301质粒的拟南芥幼苗作为阳性对照以及Col-0野生型作为阴性对照,置于GUS染液中完全浸泡,37 ℃染色过夜后用卡诺固定液脱色5~10 h,75%无水乙醇洗涤1~2次,在光学显微镜下观察染色结果并进行拍照。
2 结果与分析
2.1OsHGO启动子序列分析
通过plantcare(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)对OsHGO基因启动子序列进行分析,结果发现其包含了启动子必需的核心原件CAAT-box和TATA-box,还有大量光反应元件,如ACE、AE-box、Box-4、G-Box、I-box等;部分与生物胁迫相关的顺式调控原件,如脱落酸、赤霉素、水杨酸、生长素等激素应答元件(ABRE、GARE-motif、TCA-element、TGA-element),响应真菌刺激的Box-W1;非生物胁迫相关的调控原件有热激反应调控位点HSE,参与干旱胁迫诱导的MYB结合位点(图1)。这表明HGO基因启动子在调控植物生长发育的过程中起到了重要作用。

图1 OsHGO启动子序列分析结果
2.2OsHGO启动子重组表达载体的构建
以3叶期水稻的总DNA为模板,通过引物HGO-F/HGO-R扩增出一段大小约为1500 bp的目的片段
(图2-A),与预期片段大小相符。经过XbaⅠ和NcoⅠ双酶切连接至pCAMBIA1301载体上驱动GUS基因表达。为了验证目的片段是否成功连接至载体上,对重组载体进行双酶切检测,结果出现了2条带:一条带大小约为15 kb,与载体片段大小一致;另一条带大小约为1.5 kb,与目的片段大小一致(图2-B),这表明OsHGO基因启动子成功连接至pCAMBIA1301载体上。
2.3 转基因拟南芥的鉴定及GUS染色分析
采用浸花法转化拟南芥后,将收取到的T0代种子铺种在含潮霉素(25 mg/L)的MS培养基上。因潮霉素对拟南芥真叶的生长具有抑制作用[12],所以只有成功转入带有潮霉素抗性基因的pOsHGO∷GUS重组表达载体,才能在含潮霉素的培养基上正常生长(图3-A),而未转入抗性基因的野生型,在加入潮霉素的培养基上生长将会被抑制(图3-B)。
为了检测OsHGO基因启动子的表达活性,将转基因拟南芥的T2代种子播种于含潮霉素(25 mg/L)抗性的MS固体培养基上,对生长7 d的幼苗进行GUS组织化学染色检测,染色结果显示:GUS基因未在阴性对照幼苗中表达(图4-A),转入pCAMBIA1301质粒的阳性对照(图4-B)幼苗中,GUS基因在根、下胚轴、叶中都高度表达,而转入重组载体的拟南芥幼苗(图4-C)中,真叶内GUS基因的表达非常微弱,只有叶脉和叶尖上有微弱的表达,其他部位与阳性对照相似。

A为HGO基因启动子PCR扩增结果:Line 1为Marker(4K),Line 2~5为HGO启动子片段。B为pOsHGO∷GUS表达载体双酶切检测结果:Line 1为Marker(15K),Line 2为未酶切质粒,Line 3、Line 4 为重组载体酶切
图2pOsHGO∷GUS重组表达载体的构建

A.红色箭头所指为转基因阳性植株;B.未转基因野生型植株
3 结论与讨论
本研究成功构建了水稻HGO基因启动子与GUS载体的重组表达载体,经过电泳及测序检测,证实目的片段与pCAMBIA1301在预测位点重组且插入片段无错配现象、大小正确。对拟南芥遗传转化后代进行筛选,在含有潮霉素(25 mg/L)的MS培养基上获得抗性苗,GUS染色结果表明:OsHGO基因启动子成功转入植株中且具有活性,因此重组载体可用于OsHGO基因在植物中表达情况的观察。
本试验GUS染色的结果显示水稻HGO基因启动子转入拟南芥,在根、下胚轴、叶柄和子叶中的表达量都较高,在真叶中只有叶脉和叶尖上有微弱的表达。根、下胚轴、叶柄和子叶中的表达量较高,说明在这些部位中酪氨酸的含量较高,酪氨酸降解途径较为活跃;而真叶中只有叶脉和叶尖上有微弱的表达,说明酪氨酸在真叶上的积累较少,只在叶脉和叶尖上有少量积累,且酪氨酸降解途径较为缓慢。在植株的不同组织部位,因生命活动及功能的不同会导致同种物质在不同组织中的特异性表达。水稻HGO基因就表现出这一特性,但HGO在酪氨酸降解途径中的具体机理还有待进一步研究。
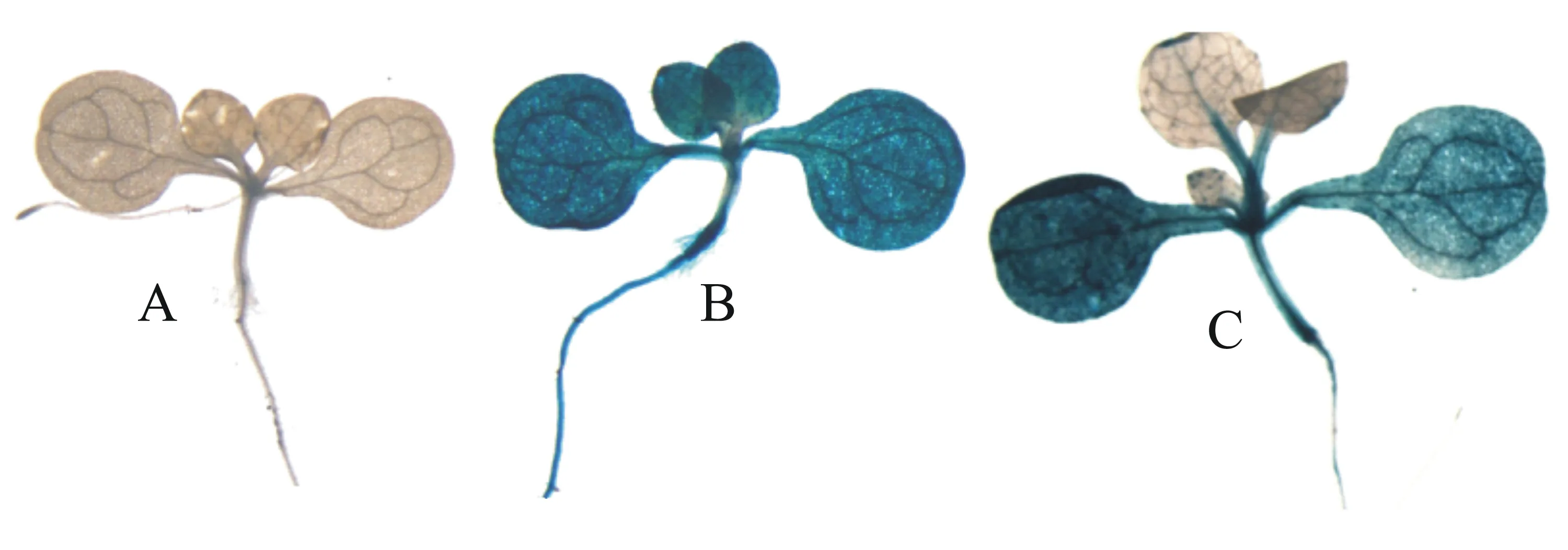
A.阴性对照植株;B.阳性对照植株;C.转基因植株
[1] Colditz P B, Yu J S, Billson F A. Tyrosinaemia Ⅱ[J]. Med J Aust, 1984, 141(4): 244-245.
[2] Dixon D P, Edwards R. Enzymes of tyrosine catabolism inArabidopsisthaliana[J]. Plant Science, 2006, 171(3): 360-366.
[3] Gagné R, Lescault A, Grenier A, et al. Prenatal diagnosis of hereditary tyrosinemia: Measurement of succinylacetone inamniotic fluid[J]. Prenat Diagn, 1982, 2(3): 185-188.
[4] Scriver C R, Clow C L. Phenylketonuria and other phenylalanine hydroxylation mutants in man[J]. Genetics, 1980, 14(14): 179-202.
[5] Han C Y, Ren C M, Zhi T T, et al. Disruption of fumarylacetoacetate hydrolase causes spontaneous cell death under short-day conditions in Arabidopsis[J]. Plant Physiology, 2013, 162(4): 1956-1964.
[6] 支添添,周舟,韩成云,等.台盼蓝染色鉴定拟南芥sdl1突变体的细胞死亡[J].作物研究,2013,27(3):217-218.
[7] 陈彦成.植物HGO基因功能的初步研究[D].长沙:湖南农业大学,2015.
[8] 陈彦成,钱伟超,彭志红,等.酪氨酸及酪氨酸降解途径中HGO基因突变对拟南芥幼苗生长的影响[J].作物研究,2014,28(3):251-253.
[9] 颜彦.水稻组织特异表达启动子的克隆及功能分析[D].武汉:华中农业大学,2013.
[10] Saghai M aroof M A, Solin an K M,Gorgensen R A, et al. Ribosomal DNA spacer-length polymorphism in barley: Mendelian inheritance, chromosomal location and population dynamics[J]. Proceedings of the NationalAcademy of Sciences of the USA, 1984, 81(21): 8014-8018.
[11] Clough S, Bent A. Floral dip: a simpli fied method for Agrobacteriummediated transformation ofArabidopsisthaliana[J]. Plant Journal for Cell & Molecular Biology, 1998, 16(6): 735-743.
[12] 丁笑生,段红英,段志坤,等.潮霉素对拟南芥幼苗真叶形成的影响[J].湖南师范大学学报:自然科学版,2010,38(5):163-166.
(责任编辑:曾小军)
Cloning, Transformation and Identification of GeneHGOPromoter in Rice
CAI Wei1, CHEN Yan-cheng2, HUANG Li-hua1, ZHI Tian-tian1, REN Chun-mei1,3*
(1. College of Bioscience and Biotechnology, Hunan Agricultural University, Changsha 410128, China; 2. Hunan Rice Research Institute, Changsha 410125, China; 3. Hunan Provincial Key Laboratory of Crop Gene Engineering, Changsha 410128, China)
GeneHGOencodes 1,2-homogentisate dioxygenase, which functions in Tyr degradation pathway. In order to further investigate the expression characteristics of theHGOgene in rice, we constructed rice geneHGOpromoter and GUS recombinant expression vector, and transformed this expression vector intoArabidopsisthalianato obtain transgenic plants by usingAgrobacterium-mediated floral dip method. By histochemical GUS staining, we found that the riceHGOgene promoter was highly expressed in the root, hypocotyl, petiole and cotyledon ofA.thaliana, but it was lowly expressed in the euphylla vein and euphylla apex ofA.thaliana.
Rice;HGOgene; Promoter; Vector construction
2016-09-19
国家科技部973前期研究专项(2014CB160308)。
蔡薇(1992─),女,湖南湘潭人,硕士研究生,主要从事植物分子遗传学研究。*通讯作者:任春梅。
Q786
A
1001-8581(2017)03-0018-04
