金银花肌动蛋白基因LjActin的克隆及在花发育过程中的表达分析
2017-04-05亓希武徐道华房海灵李维林梁呈元
亓希武,徐道华,于 盱,房海灵,李维林,梁呈元
(江苏省中国科学院 植物研究所,江苏 南京 210014)
金银花肌动蛋白基因LjActin的克隆及在花发育过程中的表达分析
亓希武,徐道华,于 盱,房海灵,李维林,梁呈元
(江苏省中国科学院 植物研究所,江苏 南京 210014)
本研究在药用植物金银花中克隆得到1条肌动蛋白(Actin)基因序列,命名为LjActin(GenBank登录号:KY114518)。序列分析表明其全长1536 bp,其中编码框1134 bp,编码377个氨基酸残基,理论分子量为41.7 kDa,理论等电点为5.31。序列比对结果表明金银花的Actin和其它植物的Actin在序列上高度保守。进化分析结果表明金银花的Actin与拟南芥的AtACT7和水稻的OsACT2聚为一支。RT-PCR结果显示LjActin在金银花5个不同发育时期的花中表达稳定。
金银花;肌动蛋白;基因;克隆;表达
肌动蛋白(Actin)最早在脊椎动物骨骼肌细胞中被发现,是真核生物中普遍存在的一种蛋白质,具有重要的生物学功能。阎隆飞等首次证明了肌动蛋白在高等植物中的存在[1]。随着分子生物学技术的发展,许多植物的肌动蛋白基因相继被克隆,氨基酸序列的比对分析表明植物的肌动蛋白在长度和序列上高度保守,暗示其在植物生命过程中具有重要的功能[2]。已有研究表明,植物肌动蛋白参与植物细胞形状控制、细胞质流动、细胞器运动、顶端生长、有丝分裂、重力感应等诸多生命过程[3-6]。此外,作为一个管家基因,肌动蛋白在不同的组织和发育时期中表达稳定,因而常被用作基因表达研究中的内参基因[7]。
金银花又称忍冬(LonicerajaponicaThunb.),是忍冬科(Caprifoliaceae)忍冬属(Lonicera)植物。金银花是一种重要的药用植物,临床应用非常广泛,据统计有超过500种中药制剂含有金银花成分[8]。金银花富含多种活性成分,如绿原酸[9]、木犀草苷[10]、黄酮[11]、挥发油[12]等。现代生化和医学研究表明金银花具有重要的生物学活性,包括抗氧化、抗炎症、抗病毒、抗癌等[13]。长期以来,对金银花的研究主要集中于活性成分的分离鉴定和活性分析。近年来,其分子生物学研究也逐步开展,尤其是活性成分生物合成相关基因的研究[14-17]。但是,金银花肌动蛋白基因至今鲜有报道。
1 材料与方法
1.1 材料和主要试剂
供试金银花品种为“四季树型”,保存于江苏省中国科学院植物研究所种质资源圃。根据花的发育程度将其分为5个时期,分别是:幼蕾期(绿色花蕾,长度小于1.5 cm);绿蕾期(绿色花蕾,长度为2~3 cm);白蕾期(白色花蕾,长度为3.5~4.5 cm);银花期(白色花,长度为5.0 cm左右)和金花期(黄色花,长度为5.0 cm左右)。花采摘后进行液氮速冻,之后保存于-80 ℃备用。
RNA提取试剂盒为通用植物总RNA提取试剂盒,购自北京百泰克生物技术有限公司。反转录酶M-MLV购自Promega公司。DNA聚合酶Ex-taq和pMD19-T simple载体购自TaKaRa公司。大肠杆菌感受态细胞Trans-T1购自北京全式金生物技术有限公司。引物合成和测序由南京思普金生物科技有限公司完成。其他试剂均为国产分析纯。
1.2 金银花不同时期花的RNA提取及cDNA第1链的合成
将不同时期的金银花材料置于研钵中,用液氮充分研磨至粉状,参照通用植物总RNA提取试剂盒说明书提取各样品的RNA。在进行质量检测后,取3 μg严格定量的总RNA,参照M-MLV使用说明,反转录合成cDNA第1链。
1.3 金银花Actin基因的克隆及序列特征分析
根据金银花转录组测序中分析得到的候选Actin基因序列,使用Primer Premier 5软件设计引物,上游引物为:5’-AACCCTCCATCTACCTCAT-3’,下游引物为:5’- GCCATAGTAAGTCCGCATC-3’。以金银花不同时期花的混合cDNA为模板进行PCR扩增,PCR反应体系为:10×PCR buffer 5 μL、25 mmol/L MgCl24 μL、20 mmol/L dNTP 4 μL、10 μmol/L上下游引物各2 μL、cDNA模板2 μL、Ex-taq 0.4 μL,用去离子水补充至50 μL。PCR反应程序为:94 ℃预变性4 min;94 ℃变性40 s,55 ℃退火40 s,72 ℃延伸90 s,共30个循环;72 ℃延伸10 min。将PCR产物进行1%琼脂糖凝胶电泳,在紫外灯下用刀片切取含有目的条带的胶条,使用TaKaRa MiniBEST Agarose Gel DNA Extraction Kit Ver 4.0进行DNA回收。将回收产物与pMD19-T simple载体进行连接,将连接产物转化大肠杆菌感受态细胞,涂布含有氨苄抗性的LB平板中。将筛选得到的阳性克隆进行测序验证。
将测序验证的基因序列进行序列特征分析,其中编码区预测和氨基酸翻译用BioEdit完成;理论分子量和等电点预测在ExPASy(http://www.expasy.org/)网站上进行;蛋白质结构域预测在SMART(http://smart.embl-heidelberg.de/smart/set_mode.cgi?NORMAL=1)网站上进行。
1.4 金银花Actin基因的多重序列比对和进化分析
从NCBI(http://www.ncbi.nlm.nih.gov/)中下载其它植物的Actin的序列,与金银花的Actin一起进行多重序列比对,比对使用ClustalX软件进行,使用GeneDoc软件对比对结果进行编辑。使用MEGA 4.0软件构建系统发生树,建树方法选择临近结合法(Neighbor-Joining, NJ),自举检验值设置为1000。
1.5 金银花Actin基因在不同发育时期花中的表达分析
根据已克隆得到的金银花Actin基因序列设计检测其表达水平的特异性引物,上游引物为:5’- TGCCAATCTATGAAGGGTATG-3’,下游引物为:5’- AAGCACTTCCTGTGGACGAT-3’;以金银花5个不同发育时期的花的cDNA为模板,进行PCR扩增。PCR反应体系为:10×PCR buffer 2.5 μL、25 mmol/L MgCl22 μL、20 mmol/L dNTP 2 μL、10 μmol/L上下游引物各1 μL、cDNA模板1 μL、Ex-taq 0.2 μL,用去离子水补充至25 μL。PCR反应程序为:94 ℃预变性4 min;94 ℃变性40 s,55 ℃退火40 s,72 ℃延伸40 s,共30个循环;72 ℃延伸10 min。对PCR扩增产物用1.2%琼脂糖凝胶电泳进行检测。
2 结果与分析
2.1 金银花Actin基因的克隆及序列分析
根据金银花转录组测序中分析得到的候选Actin基因序列设计引物,以不同发育时期的花的混合cDNA为模板进行PCR扩增,得到1条大小约为1.5 kb的条带(图1);克隆后进行测序,验证其为所要克隆的目的基因,将其命名为LjActin,并将序列提交GenBank(登录号:KY114518)。序列分析表明该基因全长1536 bp,其中5’-UTR为183 bp,3’-UTR为219 bp,编码框为1134 bp,编码377个氨基酸残基(图2)。ExPASy在线预测表明该基因所编码的蛋白质的理论分子量为41.7 kDa,理论等电点为5.31。将该基因所编码的氨基酸序列在SMART网站上进行结构域预测,表明其具有典型的ACTIN结构域。在NCBI中进行BLAST比对,显示金银花Actin与其它植物的Actin具有很高的序列相似性,如枣树Actin-7(Ziziphusjujuba,100%)、可可Actin 7(Theobromacacao,100%)、黄瓜Actin-7(Cucumissativus,99%)、棉花Actin-7(Gossypiumraimondii,99%)、猕猴桃ACT1(Actinidiadeliciosa,99%)等。
2.2 金银花Actin的多重序列比对和进化分析
将金银花的Actin序列与其它植物[包括拟南芥(Arabidopsisthaliana)、水稻(Oryzasativa)、烟草(Nicotianatabacum)、玉米(Zeamays)、陆地棉(Gossypiumhirsutum)、大豆(Glycinemax)、高粱(Sorghumbicolor)、胡萝卜(Daucuscarota)和豌豆(Pisumsativum)]的Actin序列进行多序列比对,结果表明金银花的Actin与其它植物的Actin在序列上高度保守(图3)。将金银花的Actin序列与双子叶模式植物拟南芥和单子叶模式植物水稻的Actin序列一起构建进化树,结果表明金银花的Actin与拟南芥的AtACT7和水稻的OsACT2聚为一支(图4)。此外,单、双子叶植物的Actin在进化树中相互交叉,表明被子植物的Actin基因家族起源于单、双子叶植物分化之前的共同祖先。
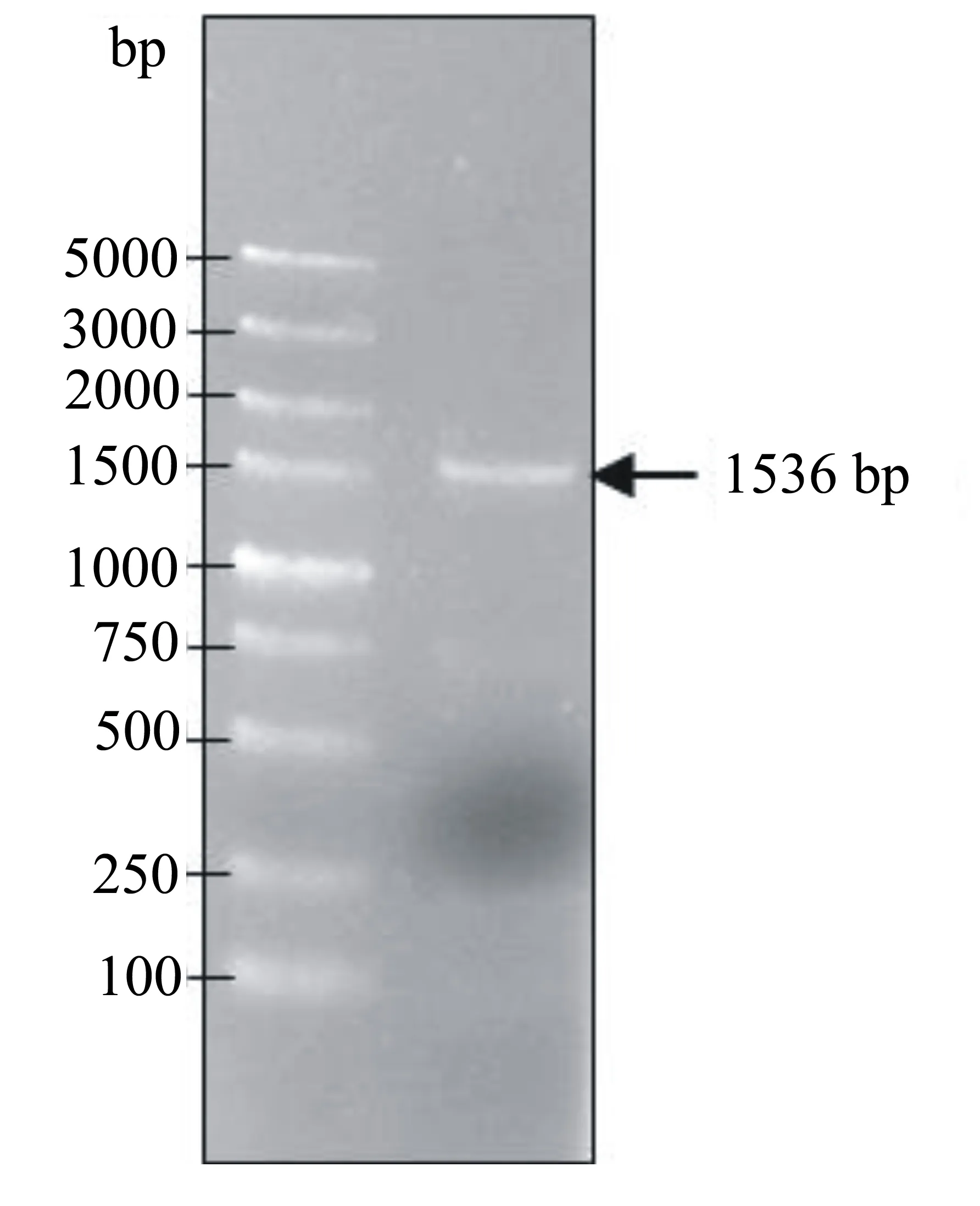
图1 金银花Actin基因的PCR扩增结果

图2 金银花Actin基因及其编码的氨基酸序列
2.3 金银花Actin基因在不同发育时期花中的表达分析
根据克隆得到的金银花Actin基因序列设计引物,以5个发育时期的花或花蕾的cDNA为模板进行RT-PCR,结果表明该基因在金银花5个发育时期的花或花蕾中表达稳定(图5),因此可作为基因表达研究中的内参基因。
3 讨论
肌动蛋白是真核生物中普遍存在的一类古老的蛋白质,参与许多重要的生命活动。研究表明肌动蛋白基因在核苷酸水平和氨基酸水平上都具有高度的保守性[2]。本研究从药用植物金银花中克隆得到1个肌动蛋白基因,序列分析表明其全长1536 bp,其中编码框1134 bp,编码377个氨基酸残基,所编码的蛋白质的理论分子量为41.7 kDa,理论等电点为5.31。序列比对表明金银花的Actin和其它植物的Actin在序列上高度保守。
高等真核生物的肌动蛋白是由多基因家族所编码的,高等植物中拟南芥中有10个肌动蛋白基因[18],水稻中有4个[19],豌豆中至少有18个[20]。本研究将金银花的Actin序列与双子叶模式植物拟南芥和单子叶模式植物水稻的Actin序列一起构建进化树,结果表明金银花的Actin与拟南芥的AtACT7和水稻的OsACT2聚为一支。研究表明拟南芥AtACT7基因对植物激素、光、损伤等有强烈反应[21],并且在愈伤组织形成、发芽和根的生长中都起到重要作用[22]。此外,进化分析显示单、双子叶植物的Actin在进化树中相互交叉,表明被子植物的Actin基因家族起源于单、双子叶植物分化之前的共同祖先[23]。

序列在SwissProt中的登录号为:AtACT7(P53492)、OsACT1(Q10DV7)、NtActin(Q05214)、ZmACT1(P02582)、GhActin(O81221)、GmActin1(P02581)、SbActin1(P53504)、DcActin(P23343)、PsActin1(P30164)。
图3 金银花Actin与其它植物Actin的多序列比对结果
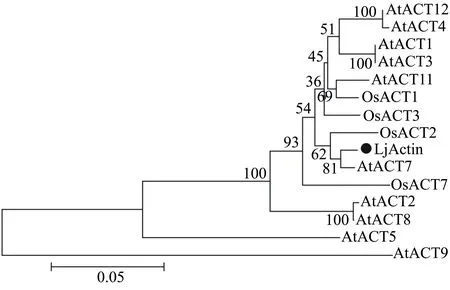
图4 金银花Actin与拟南芥、水稻Actin的进化分析结果

1:幼蕾期;2:绿蕾期;3:白蕾期:4:银花期;5:金花期。
内参基因是从分子生物学上研究基因表达水平的重要参考,主要是选择表达稳定的管家基因。植物中常用的内参基因一般有肌动蛋白基因、甘油醛-3-磷酸脱氢酶基因(Glyceraldehyde-3-phosphatedehydrogenase,GAPDH)、微管蛋白基因(Tubulin)和18S rRNA等[24]。研究表明,不同的内参基因只适用于一定的条件,并不存在所有情况下都稳定表达的管家基因[25]。在本研究中,通过对金银花不同发育时期的花的RNA严格定量,利用RT-PCR检测了LjActin的表达水平,结果表明LjActin在5个发育时期的花中表达稳定,可以作为金银花的花发育过程中基因表达研究的内参基因。
[1] 阎隆飞,石德权.高等植物中的收缩蛋白[J].生物化学与生物物理学报,1963(3):490-495.
[2] Hightower R C, Meagher R B. The molecular evolution of actin[J]. Genetics, 1986, 114(1): 315-332.
[3] Mathur J, Mathur N, Hülskamp M. Simultaneous visualization of peroxisomes and cytoskeletal elements reveals actin and not microtubule-based peroxisome motility in plants[J]. Plant Physiol, 2002, 128(3): 1031-1045.
[4] Barrero R A, Umeda M, Yamamura S, et al.ArabidopsisCAP regulates the actin cytoskeleton necessary for plant cell elongation and division[J]. Plant Cell, 2002, 14(1): 149-163.
[5] Franklintong V E. Signaling and the modulation of pollen tube growth[J]. Plant Cell, 1999, 11(11): 727-738.
[6] Palmieri M, Kiss J Z. Disruption of the F-actin cytoskeleton limits statolith movement inArabidopsishypocotyls[J]. J Exp Bot, 2005, 56(419): 2539-2550.
[7] Thellin O, Zorzi W, Lakaye B, et al. Housekeeping genes as internal standards: use and limits[J]. J Biotechnol, 1999, 75(2-3): 291-295.
[8] Shang X, Pan H, Li M, et al.LonicerajaponicaThunb.: ethnopharmacology, phytochemistry and pharmacology of an important traditional Chinese medicine[J]. J Ethnopharmacol, 2011, 138(1): 1-21.
[9] Lu H T, Jiang Y, Chen F. Application of preparative high-speed counter-current chromatography for separation of chlorogenic acid fromFloslonicerae[J]. J Chromatogr A, 2004, 1026(1): 185-190.
[10] Qiu F, Li Z, He L, et al. HPLC-ESI-MS/MS analysis and pharmacokinetics of luteoloside, a potential anticarcinogenic component isolated fromLonicerajaponica, in beagle dogs[J]. Biomed Chromatogr, 2013, 27(3): 311-317.
[11] Kumar N, Singh B, Bhandari P, et al. Biflavonoids fromLonicerajaponica[J]. Phytochemistry, 2005, 66(23): 2740-2744.
[12] Schlotzhauer W S, Pair S D, Horvat R J. Volatile constituents from the flowers of Japanese honeysuckle (Lonicerajaponica)[J]. J Agr Food Chem, 1996, 44(1): 206-209.
[13] Ku S K, Seo B I, Park J H, et al. Effect ofFlosloniceraeextracts on reflux esophagitis with antioxidant activity[J]. World J Gastroentero: WJG, 2009, 15(38): 4799.
[14] Yuan Y, Song L, Li M, et al. Genetic variation and metabolic pathway intricacy govern the active compound content and quality of the Chinese medicinal plantLonicerajaponicaThunb[J]. BMC Genomics, 2012, 13(1): 195.
[15] He L, Xu X, Li Y, et al. Transcriptome analysis of buds and leaves using 454 pyrosequencing to discover genes associated with the biosynthesis of active ingredients inLonicerajaponicaThunb[J]. PLoS ONE, 2013, 8(4): e62922.
[16] Yuan Y, Wang Z, Jiang C, et al. Exploiting genes and functional diversity of chlorogenic acid and luteolin biosyntheses inLonicerajaponicaand their substitutes[J]. Gene, 2014, 534(2): 408-416.
[17] Wu J, Wang X C, Liu Y, et al. Flavone synthases fromLonicerajaponicaandL.macranthoidesreveal differential flavone accumulation[J]. Sci Rep, 2016(6): 19245.
[18] Kandasamy M K, Mckinney E C, Meagher R B. Functional nonequivalency of actin isovariants inArabidopsis[J]. Mol Biol Cell, 2002, 13(1): 251-261.
[19] Reece K S, Mcelroy D, Wu R. Genomic nucleotide sequence of four rice (Oryzasativa) actin genes[J]. Plant Mol Biol, 1990, 14(4): 621-624.
[20] Cao X, Wang R, Yan L, et al. Construction of a pea tendril cDNA library and sequence analysis of a pea actin cDNA, PEAcl[J]. Chinese Sci Bull, 1994, 39(4): 332-337.
[21] Mcdowell J M, An Y Q, Huang S, et al. The arabidopsis ACT7 actin gene is expressed in rapidly developing tissues and responds to several external stimuli[J]. Plant Physiol, 1996, 111(3): 699-711.
[22] Gilliland L U, Pawloski L C, Kandasamy M K, et al.Arabidopsisactin gene ACT7 plays an essential role in germination and root growth[J]. Plant J, 2003, 33(2): 319-328.
[23] 李园莉,江元清,赵武玲,等.谷子肌动蛋白基因的克隆及序列分析[J].植物学报,2002,19(3):310-316.
[24] Stürzenbaum S R, Kille P. Control genes in quantitative molecular biological techniques: the variability of invariance[J]. Comp Biochem Phys B, 2001, 130(3): 281-289.
[25] Andersen C L, Jensen J L, Ørntoft T F. Normalization of real-time quantitative reverse transcription-PCR data: a model-based variance estimation approach to identify genes suited for normalization, applied to bladder and colon cancer data sets[J]. Cancer Res, 2004, 64(15): 5245-5250.
(责任编辑:黄荣华)
Cloning of Actin GeneLjActininLonicerajaponicaand Its Expression at Different Stages of Flower Development
QI Xi-wu, XU Dao-hua, YU Xu, FANG Hai-ling, LI Wei-lin, LIANG Cheng-yuan*
(Institute of Botany, Jiangsu Provincial and Chinese Academy of Sciences, Nanjing 210014, China)
In this study, we cloned an actin geneLjActin(GenBank accession number: KY114518) from medicinal plantLonicerajaponicaThunb. The results of sequence analysis indicated that: the total length ofLjActinwas 1536 bp, and its ORF was 1134 bp encoding 377 amino acids; this actin gene possessed the theoretical molecular weight of 41.7 kDa and the theoretical isoelectric point of 5.31. Multiple sequence alignment showed that the sequence ofLjActininL.japonicawas highly conserved as that in other plants. Phylogenetic analysis showed that theLjActininL.japonicawas clustered into a clade with the AtACT7 inArabidopsisthalianaand the OsACT2 in rice (Oryzasativa). The result of RT-PCR indicated thatLjActincould steadily express in the flowers ofL.japonicaat 5 different developmental stages.
Lonicerajaponica; Actin; Gene; Cloning; Expression
2016-11-14
国家自然科学基金青年基金项目(31500249);江苏省“六大人才高峰”资助项目(2015-NY-032);江苏省中国科学院植 物研究所青年基金项目(SQ201401)。
亓希武(1986─),男,山东临沂人,助理研究员,博士,从事药用植物资源研究。
梁呈元。
Q943.2
A
1001-8581(2017)03-0090-05
