卡培他滨联合替莫唑胺治疗晚期胰腺神经内分泌肿瘤的临床观察
2017-04-05刘青张盼罗杰窦豆谭煌英
刘青 张盼 罗杰 窦豆 谭煌英
卡培他滨联合替莫唑胺治疗晚期胰腺神经内分泌肿瘤的临床观察
刘青①张盼①罗杰②窦豆①谭煌英①
目的:观察卡培他滨联合替莫唑胺治疗晚期胰腺神经内分泌肿瘤(pancreatic neuroendocrine neoplasm,pNENs)的疗效及不良反应。方法:回顾性分析2014年2月至2016年10月中日友好医院收治的14例经病理学确诊,分化良好的Ⅳ期pNENs患者,接受口服CAPTEM方案,分析治疗后的无进展生存期(progression free survival,PFS)及不良反应。结果:14例患者接受定期随访2年余(2014年1月至2016年10月),1例完全缓解(complete resporse,CR),1例部分缓解(partial response,PR),4例疾病稳定(stable disease,SD),中位无进展生存期(median progression free survival,mPFS)约为8.9(3~24)个月,2年生存率为85.7%(12/14),其中不良反应均为3级以下的骨髓抑制、消化道反应。结论:卡培他滨联合替莫唑胺(capecitabine and temozolomide,CAPTEM)方案是治疗晚期胰腺神经内分泌瘤(pancreatic neuroendocrine tumor,pNET)的有效化疗方案,患者耐受性较好。
胰腺神经内分泌肿瘤 替莫唑胺 无进展生存期 不良反应
胰腺神经内分泌肿瘤(pancreatic neuroendocrine neoplasm,pNENs)是一组起源于胰腺神经内分泌细胞的少见恶性肿瘤,约占原发胰腺肿瘤的1%~2%[1]。根据病理形态学可分为分化好的神经内分泌肿瘤(neuroendocrine tumor,NET),分化差的神经内分泌癌(neuroendocrine carcinoma,NEC)和混合性腺神经内分泌癌。pNET确诊时超过一半患者为晚期。对于分化较好的进展期pNET,一线治疗可选择生长抑素类似物(somatostatin analogue,SSA)、靶向药物或细胞毒化疗。以舒尼替尼[2]和依维莫司[3]为代表的靶向药物在分化好的pNET中显示出较好的抗肿瘤增殖作用,无进展生存期(progression-free survival,PFS)约为11个月,较安慰剂明显延长。以链脲霉素或达卡巴嗪为基础的联合化疗对分化好的NET G1/G2有一定的有效率,但临床中往往因不良反应而导致患者耐受性较差。在中国,靶向药物以及SSA的治疗费用昂贵导致其在临床中应用受限,故高效、低毒的化疗方案具有极高的临床需求。近年来,国外有学者研究证实卡培他滨联合替莫唑胺的化疗方案在神经内分泌肿瘤中[4],尤其是分化好的pNENs的治疗中具有较高的有效率和安全性[5]。本研究通过回顾性分析应用卡培他滨联合替莫唑胺(capecitabine and temozolomide,CAPTEM)方案治疗的14例晚期pNENs患者的临床治疗,旨在总结CAPTEM方案在我国晚期pNET患者中的治疗疗效及不良反应评价。
1 材料与方法
1.1 病例资料
回顾性分析2014年2月至2016年10月中日友好医院收治的经组织病理学确诊,接受CAPTEM方案化疗的14例晚期分化良好的pNENs患者的临床资料。其中男性4例,女性10例;平均年龄(51.7±3.36)岁,中位年龄52(28~74)岁。
1.2 方法
经病理确诊的进展期的晚期分化良好的pNENs病例纳入分析,分化差的pNENs予以排除。CAPTEM给药方案为:卡培他滨600~750 mg/m2bid d1~14,替莫唑胺150~200 mg/m2每晚服d10~14,每28 d为1个周期,同时予以维生素B6片50 mg tid口服预防卡培他滨相关手足综合征,昂丹司琼片8 mg qd在替莫唑胺前口服以预防消化道反应,剂量根据一般状态、计算体表面积并调整。
1.3 疗效及不良反应评价标准
所有患者在接受CAPTEM化疗后每2~3个周期复查CT或MRI,根据实体瘤的RECIST 1.1标准进行疗效评价,分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable dis⁃ease,SD)、疾病进展(progress disease,PD)。治疗相关不良反应评价依据美国国立癌症研究所(NCI)常见不良反应分级标准NCI-CTCAE 4.0进行分级。并定期进行生存随访。PFS定义为接受本方案开始至PD或死亡的时间。总生存(overall survival,OS)定义为接受治疗开始直至死亡或末次随访的时间。
1.4 统计学分析
采用SPSS 17.0软件进行统计学分析,应用Ka⁃plan-Meier法计算生存率并绘制生存曲线。
2 结果
2.1 临床资料
14例晚期pNENs患者,其中1例为胃泌素瘤,13例为无功能肿瘤。均经手术或穿刺组织病理确诊为NET,据世界卫生组织(WHO)2010年第4版消化系统肿瘤病理分类[6]及中国胃肠胰神经内分泌肿瘤病理学诊断共识意见[7],其中1例NET为G1,9例NET为G2,4例为高增殖活性的神经内分泌瘤(NET G3)。3例曾接受根治性切除手术,2例接受减瘤手术。13例存在肝多发转移,1例骨转移及肺转移,7例腹盆腔多发淋巴结转移。其中一线治疗5例,二线及以上治疗9例。既往接受SSA治疗2例,经动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)治疗5例,全身静脉化疗(吉西他滨、奥沙利铂、替吉奥、5-FU)2例,见表1。
2.2 有效率及生存状态
截至2016年10月,所有纳入分析患者中2例因肿瘤进展死亡,其余12例均在定期随访,平均随访时间为18(6~32)个月。1例CR,1例PR,4例SD。中位无进展生存期(median progression free survival,mPFS)约为8.9个月(95%CI:5.8~11.9),治疗后的2年生存率为85.7%。在治疗疗效评价CR/PR+SD的患者中,中位缓解时间为12个月(95%CI:5.0~20.95)。应用Kaplan-Meier法绘制生存曲线(图1)。基线血清CgA升高的9例患者在CAPTEM治疗后有6例(66.7%)血清CgA下降明显。
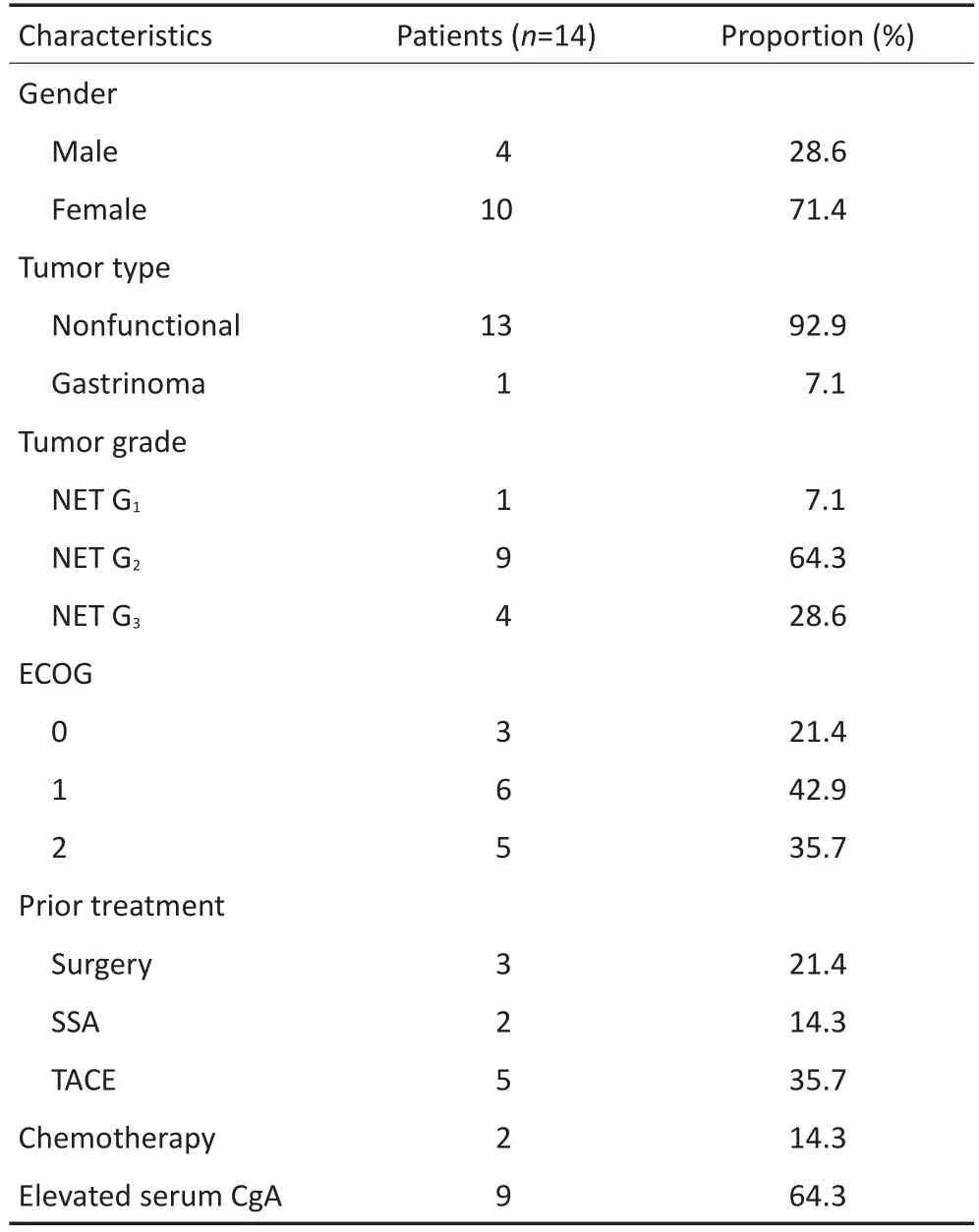
表1 14例pNENs患者基线临床资料Table 1 Baseline characteristics of 14 advanced pNET patients
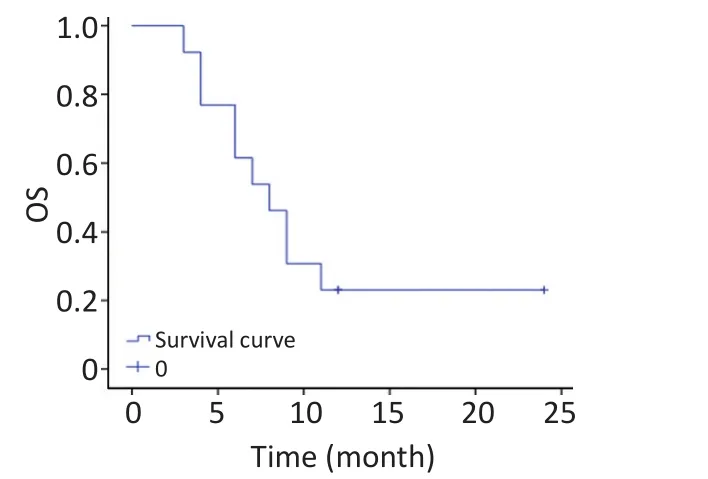
图1 14例患者接受治疗后的生存曲线Figure 1 Survival curve of 14 patients after treatment(median PFS 8.9 months)
2.3 典型病例
2.3.1 典型病例1 女性,59岁,2015年8月发现肝多发占位,经肝穿病理确诊为:高增殖活性的神经内分泌瘤(NET G3),基线腹部增强CT可见胰头部占位,肝内多发结节,腹膜后多发淋巴结转移(图2A,B,C);治疗6个月后复查腹部MRI增强:胰头部肿块消失,肝内多发转移灶较前减小,腹膜后肿大淋巴结明显减小、消失(图2D,E,F)。疗效评价PR。现仍病情缓解,定期随访中。
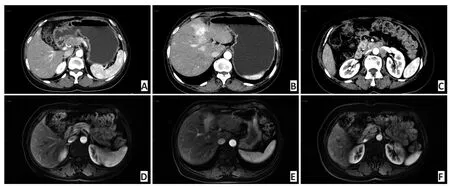
图2 腹部增强CT和腹部增强MRIFigure 2 Abdominal enhanced CT and MRI
2.3.2 典型病例2 女性,74岁,2014年3月外院行胰腺尾部肿瘤切除加脾脏切除术,术后病理经中日友好医院会诊:pNENs G2(Ki-67:20%+;核分裂<20/ 10 HPF),肿瘤侵犯胰腺周围脂肪组织并与脾被膜黏连。术后3个月复查腹部增强CT:腹主动脉旁淋巴结转移(图3A);经CAPTEM治疗1年后复查腹部增强CT示:腹主动脉旁淋巴结消失(图3B),现仍定期随访未见疾病进展,PFS为30个月。
2.4 不良反应
在接受CAPTEM化疗期间最常见的不良反应是乏力、恶心、呕吐和骨髓抑制,其中1、2级不良反应最为常见,仅1例发生3级化疗相关消化道不良反应。无患者因不良反应终止治疗,无患者发生4级不良事件或治疗相关死亡(表2)。
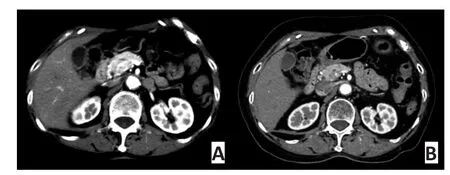
图3 腹部增强CTFigure 3 Abdominal enhanced CT
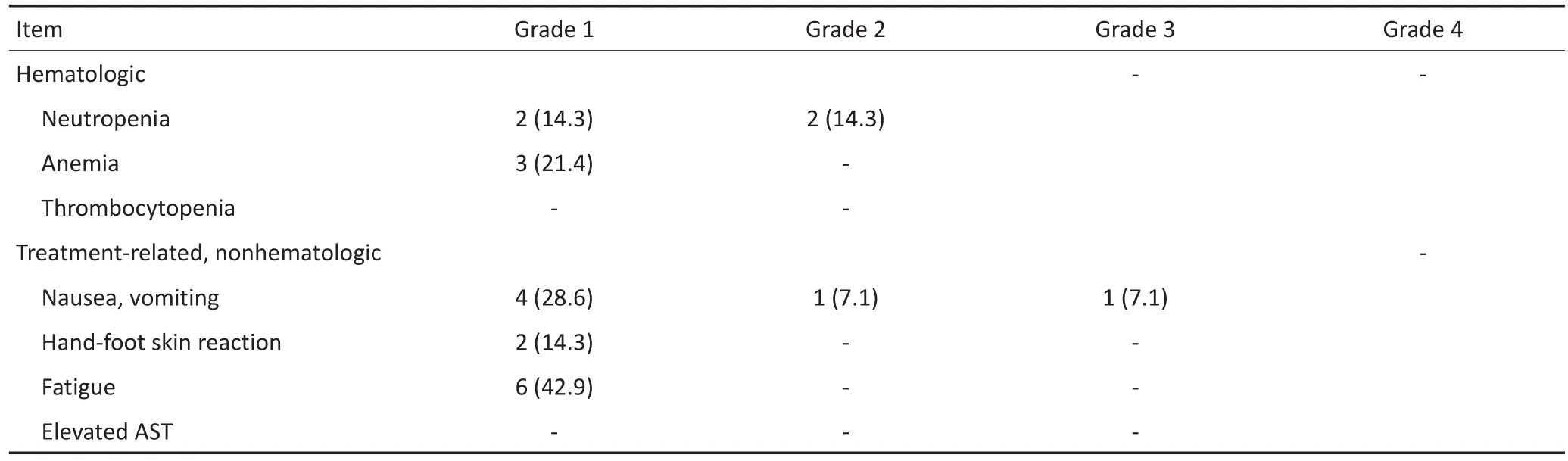
表2 14例晚期pNENs患者接受CAPTEM期间化疗相关不良反应分级 n(%)Table 2 Adverse events related with CAPTEM of 14 advanced pNET patients
3 讨论
最新中国胃肠胰神经内分泌肿瘤专家共识和胰腺神经内分泌肿瘤治疗指南建议[8],晚期pNENs应根据症状及肿瘤分级、分期情况采取多学科协作诊疗的模式[9-10]。对于肿瘤负荷较小、进展缓慢的pNENs首选SSA;肝脏是最常见的转移部位,虽不能延长患者生存期,但部分晚期肝转移患者可以考虑姑息性原发灶切除或肝转移灶切除减瘤术;针对肝转移的治疗可考虑肝动脉栓塞化疗、射频消融等局部治疗减少瘤负荷;对于肿瘤负荷大,增殖速度快、进展迅速且引起相关症状的晚期患者首选全身化疗。
细胞毒化疗用于治疗晚期pNENs已有近40余年的历史,报道的有效药物为:烷化剂如链脲霉素、替莫唑胺、达卡巴嗪;抗代谢药物如氟尿嘧啶;拓扑异构酶抑制剂如阿霉素、依托泊苷等。Moertel等[11]研究在胰岛细胞瘤中应用单药链脲霉素,有效率约为36%,随后多个小样本研究证实链脲霉素联合5-FU和(或)联合表阿霉素治疗分化好的pNENs显示出较好的有效率,但是3/4级的不良反应发生率较高[12]。近年来美国及约旦学者的研究发现CAPTEM方案在包括胰腺神经内分泌肿瘤、肠道类癌、MEN-1等分化好的NEN中治疗的PFS达14.0~16.5个月[4,13],尤其是在分化好的pNET中CAPTEM方案有着更高的有效率,Strosberg等[5]研究证实CAPTEM方案一线治疗pNENs具有较高的有效率,30例患者治疗后21例PR,8例SD,mPFS达18个月,且具有良好的安全性,不过上述均为小样本量的研究。
目前已有转化医学研究证实CAPTEM方案的理论基础[14],增长缓慢的分化好的NETs具有延长的G0期细胞,亲脂性的烷化剂可诱导静止的G0期细胞凋亡,达卡巴嗪或替莫唑胺均为亲脂性烷化剂,如持续暴露于对神经内分泌肿瘤有效的抗代谢药物可能提升疗效,NET类癌细胞系BON体外培养试验证实5-FU与替莫唑胺的协同增效作用与给药时间和先后顺序有关,在5-FU给药9 d后给予TMZ产生的杀伤力最强,可致68%的BON细胞凋亡。相关机制研究显示,替莫唑胺作为口服的烷化剂,通过使DNA烷基化进而杀伤肿瘤细胞,在鸟嘌呤N7、O6处形成DNA交联,细胞内O6-甲基鸟嘌呤-DNA甲基转移酶(O6-methylgnanine DNA methytransferase,MGMT)的活性与烷化剂耐药有关[15],MGMT蛋白的表达在胃肠神经内分泌肿瘤和pNENs中有差异,经免疫组织化学证实MGMT在24%~51%胰腺NET中低表达,而在胃肠胰腺神经内分泌肿瘤中MGMT往往正常表达[16]。其结果与Kulke等[17]学者的临床研究结果一致,具有MGMT表达的16例神经内分泌肿瘤(包括类癌)对化疗无反应,mPFS为9.3个月,而缺乏MGMT表达的4例胰岛细胞瘤对替莫唑胺化疗反应良好,mPFS为19.2个月。卡培他滨与替莫唑胺之间也可能存在一定的协同关系,卡培他滨在肿瘤组织中选择性转化成5-FU后,5-FU进一步通过不同的生化途径产生单磷酸氟脱氧尿苷(FdUMP)、三磷酸氟脱氧尿苷(FdUTP),整合5-FdUTP到DNA干扰DNA复制,5-FdUMP抑制胸苷酸合成酶,进而降低从dUMP合成dTMP,可以降低O6-MGMT活性,进而提升替莫唑胺阻断DNA复制的效果。
本研究中发现,在晚期分化好的pNET中应用CAPTEM方案,mPFS约为8.9个月(95%CI:5.8~11.9),仅2例因肿瘤进展在随访期内死亡,治疗后的2年生存率为85.7%。本组患者的PFS结果低于国外文献报道,考虑因为纳入分析的患者既往接受过静脉化疗、TACE、SSA等治疗方式,仅5例CAPTEM方案是一线治疗,故接受CAPTEM方案后的PFS较CAPTEM一线治疗的结果短。另外,入选患者偏少,随访时间可以更长。虽然CAPTEM为二线或三线以上治疗,但仍显示出较理想的疾病控制率(disease control rate,PCR)和PFS,化疗相关的不良反应低,对于晚期pNET患者即使接受二线及以上治疗的仍具有良好的耐受性,以乏力、消化道反应以及3级以下的骨髓抑制为主。治疗过程中仅1例发生3级化疗相关消化道不良反应,未发生4级不良事件或治疗相关死亡。因为部分患者的病理为外院取材经本中心病理会诊,未对每1例患者应用免疫组织化学检查MGMT,上述为本研究的不足之处。后续研究会对MGMT的表达与治疗效果进行相关性分析。
通过本研究回顾性分析可以看出,在SSA或化疗进展后的分化好的pNET中应用CAPTEM方案有效且不良反应可耐受。但针对化疗是否为一线的标准治疗方案的问题,目前仍缺乏高水平的大样本循证医学证据。未来的研究可以开展临床试验来寻找替莫唑胺为基础的化疗作为pNENs一线治疗的循证医学证据,pNENs是否具有特殊的分子表型进而指导临床治疗,并探索化疗联合血管生成抑制剂或其他靶向药物治疗是否更有效。
[1]Yao JC,Hassan M,Phan A,et al.One hundrend years after carcinoid:epidemiology of and prognostic factors for neuroendocrine tumors in 35,825 cases in the United States[J].J Clin Oncol,2008, 26(18):3063-3072.
[2]Eric R,Laetitia D,Jean-Luc R,et al.Sunitinib malate for the treatment of pancreatic neuroendocrine tumors[J].N Engl J Med,2011, 364(6):501-513.
[3]Yao JC,Hassan M,Ito T,et al.Everolimus for advanced pancreatic neuroendocrine tumors[J].N Engl J Med,2011,364(6):514-523.
[4]Robert LF,Anthony PG,Benjamin AK,et al.Capecitabine and temozolomide(CAPTEM)for metastatic,well-differentiated neuroendocrine cancers:the pancreas center at columbia university experience[J].Cancer Chemother Pharmacol,2013,71(3):663-670.
[5]Strosberg JR,Fine RL,Choi J,et al.First-Line chemotherapy with capecitabine and temozolomide in patients with metastatic pancreatic endocrine carcinomas[J].Cancer,2011,117(2):268-275.
[6]Bosman FT,Carneiro F,Hruban RH,et al.Pathology and genetics of the tumors of the digestive system[M].Lyon IARC press,2010:13-14.
[7]Chinese gastrointestinal neuroendocrine tumor pathology expert group 2013.Consensus of pathological diagnosis of gastrointestinal neuroendocrine tumors in China(2013 Edition)[J].Chin J Pathol, 2013,42(10):691-694.[2013年中国胃肠胰神经内分泌肿瘤病理专家组.中国胃肠胰神经内分泌肿瘤病理诊断共识(2013版)[J].中华病理学杂,2013,42(10):691-694.]
[8]Falconi M,Eriksson B,Kaltsas G,et al.ENETS consensus guidelines update for the management of patients with functional pancreatic neuroendocrine tumors and non-functional pancreatic neuroendocrine tumors[J].Neuroendocrinology,2016,103(2):153-171.
[9]Expert committee on neuroendocrine tumors,Chinese society of clinical oncology.Consensus of Chinese experts on gastrointestinal neuroendocrine tumors(2016 Edition)[J].Chin Clin Oncol,2016,10 (21):927-942.[中国临床肿瘤学会神经内分泌肿瘤专家委员会.中国胃肠胰神经内分泌肿瘤专家共识(2016年版)[J].临床肿瘤学杂志,2016,10(21):927-942.]
[10]Lou WH,Wu WM.Guidelines of pancreatic neuroendocrine tumor (2014)[J].Chine J Prac Surg,2014,12(34):1117-1119.[楼文晖,吴文铭.胰腺神经内分泌肿瘤治疗指南(2014)[J].中国实用外科杂志, 2014,12(34):1117-1119.]
[11]Moertel CG,Hanley JA,Johnson LA.Streptozocin alone compared with streptozocin plus fluorouracil in the treatment of advanced islet-cell carcinoma[J].N Engl J Med,1980,303(21):1189-1194.
[12]Okusaka T,Ueno H,Morizane C,et al.Cytotoxic chemotherapy for pancreatic neuroendocrine tumors[J].J Hepatobiliary Pancreat Sci, 2015,22(8):628-633.
[13]Abbasi S,Kashashna A,Albaba H.Efficacy of capecitabine and temozolomide combination in well-differentiated neuroendocrine tumors jordan experience[J].Pancreas,2014,43(8):1303-1305.
[14]Fine RL,Fogelman DR,Schreibman SM.Effective treatment of neuroendocrine tumors with temozolomide and capecitabine[J].J Clin Oncol,2005,23(16S):S4216.
[15]Baer JC,Freeman AA,Newlands ES,et al.Depletion of O6-alkylguanine-DNA alkyltransferase correlates with potentiation of temozolomide and CCNU toxicity in human tumour cells[J].Br J Cancer, 1993,67(6):1299-1302.
[16]Gilbert JA,Adhikari LJ,Lloyd RV,et al.Molecular markers for novel therapeutic strategies in pancreatic endocrine tumors[J].Pancreas,2013,42(3):411-421.
[17]Kulke MH,Hornick JL,Frauenhoffer C,et al.O6-methylguanine DNA methyltransferase deficiency and response to temozolomidebased therapy in patients with neuroendocrine tumors[J].Clin Cancer Res,2009,15(1):338-345.
(2016-12-12收稿)
(2017-03-03修回)
(编辑:周晓颖 校对:孙喜佳)
Clinical observation of capecitabine and temozolomide in the treatment of advanced pancreatic neuroendocrine tumors
Qing LIU1,Pan ZHANG1,Jie LUO2,Dou DOU1,Huangying TAN1
Huangying TAN;E-mail:tanhuangying@263.net
1Department of Integrative Oncology;2Department of Pathology,China-Japan Friendship Hospital,Beijing 100029,China
Objective:To observe the therapeutic effect and toxicity of capecitabine and temozolomide in the treatment of advanced pancreatic neuroendocrine tumors.Methods:A total of 14 patients with stageⅣwell-differentiated pancreatic neuroendocrine tumor (NET G1/G2/G3)were treated with oral CAPTEM regimen,and the response rate,PFS and adverse effect after treatment were analyzed.All data analyses were performed using software SPSS17.0.Results:These 14 patients were followed-up for more than 2 years.Till Oct 2016, one patient got CR,one patient got PR,four patients got SD.Median progression-free survival was 8.9 months.The two year survival rate was 85.7%.Only one patient experienced grade 3 adverse events.Conclusion:CAPTEM is an effective and well-tolerated salvage regimen for the treatment of advanced well-differentiated pNET.
pancreatic neuroendocrine neoplasm,temozolomide,progress-free survival,adverse effect

10.3969/j.issn.1000-8179.2017.05.404
①中日友好医院中西医结合肿瘤内科(北京市100029);②病理科
谭煌英 tanhuangying@263.net
刘青 专业方向为肿瘤内科及消化道肿瘤的综合治疗。
E-mail:297294788@qq.com
