中晚期胃癌患者外周血T细胞亚群检测的临床意义
2017-04-05周蕾姜妮王小利周心娜司文任军
周蕾 姜妮 王小利 周心娜 司文 任军
中晚期胃癌患者外周血T细胞亚群检测的临床意义
周蕾 姜妮 王小利 周心娜 司文 任军
目的:研究胃癌患者外周血T淋巴细胞亚群变化的临床意义。方法:选取2015年10月至2016年5月北京世纪坛医院肿瘤内科收治的67例胃癌患者,抽取外周血,采用流式细胞术检测T细胞及其亚群,同时抽取外周血检测肿瘤标记物CEA、CA199,对结果进行分析比较,并对患者进行随访。结果:67例胃癌患者中,Ⅲ期患者Tc(CD8+CD28+)均值为12.3±5.1,Ⅳ期患者Tc(CD8+ CD28+)均值为9.9±4.6,两者比较差异具有统计学意义(P=0.043);CEA升高的患者Tc(CD8+CD28+)均值为9.3±3.6,而CA199未升高的患者Tc(CD8+CD28+)均值为12.1±5.6(P=0.025)。CA199升高的患者Tc(CD8+CD28+)均值为9.3±4.2,而CEA未升高的患者Tc(CD8+CD28+)均值为12.1±5.3(P=0.029),Tc(CD8+CD28+)下降的患者较未下降的患者的总生存时间(overall survival,OS)降低(8.1个月vs.15.1个月,P=0.008)。结论:胃癌患者随着TNM分期的提高,其机体的细胞免疫功能呈现逐渐下降的趋势;CEA、CA199升高的患者Tc(CD8+CD28+)降低,二者呈负相关;Tc(CD8+CD28+)降低,患者的OS缩短。
胃癌 淋巴细胞亚群 免疫功能
恶性肿瘤的发生、发展与机体免疫系统功能状态密切相关,肿瘤患者通常伴有免疫抑制或损害,如果免疫功能持续下降,可促进肿瘤的复发和转移,降低患者的生存质量和生存率[1-2]。外周血T淋巴细胞亚群检测是反应肿瘤患者免疫状态的常用方法,但是其在临床中的作用以及与预后的关系尚未完全明确。本研究采用流式细胞术(FCM)分析了67例晚期胃癌患者外周血T淋巴细胞亚群不同淋巴细胞的含量,探讨其与胃癌常用肿瘤标记物CEA、CA199的关系,以及与患者总生存时间(overall survival,OS)的相关性。
1 材料与方法
1.1 材料
1.1.1 临床资料 选取2015年10月至2016年5月北京世纪坛医院肿瘤内科收治的67例胃癌患者,均经病理活检确诊,影像学证实临床分期为晚期,无手术适应证。年龄27~89岁,平均年龄(62.0±13.6)岁;临床分期:Ⅲ~Ⅳ期,Ⅲ期32例、Ⅳ期35例;男性47例、女性20例;肿瘤位置:贲门19例、胃体24例、胃底8例、胃窦14例;分化程度:高分化4例、中分化13例、中低分化8例、低分化35例、未明确7例;转移情况:肝转移18例、肺转移4例、骨转移38例、脑转移1例、淋巴结转移14例。此项临床研究经北京世纪坛医院伦理委员会批准,所有患者签署知情同意书。
1.1.2 试剂及仪器 流式细胞仪FC500及其配套的数据处理系统均购自美国Beckman-Coulter公司;雅培i-4000全自动化学发光分析仪购自美国雅培公司。
1.2 方法
1.2.1 外周血T淋巴细胞亚群的检测 淋巴细胞亚群检测抽取外周静脉血4 mL放入EDTA抗凝管,使用直接免疫荧光标记全血溶血法,流式细胞仪测定被检者外周血淋巴细胞及其亚群。A~F共6管中分别加标有荧光的抗体10 μL、血液样本50 μL,振荡。室温避光放置15 min后加溶血素(BD)400 μL,室温避光放置8 min后加入2 mL磷酸缓冲盐溶液(PBS),室温1 500 r/min离心5 min,弃液、留底部细胞加入PBS液400 μL,震荡后上机检测。
1.2.2 外周血CEA、CA199的检测 CEA、CA199检测同时抽取外周静脉血4 mL入惰性分离胶促凝管(内含分离胶和促凝剂),化学发光免疫分析法(che⁃miluminesent immunoassay,CLIA)进行标本检测。
1.3 统计学分析
应用SPSS 16.0软件进行统计学分析,组间比较采用两个独立样本t检验,应用Kaplan-Meier法和Log rank检验进行OS的分析,并绘制生存曲线。以P<0.05为差异具有统计学意义。
2 结果
2.1 不同临床分期的胃癌患者T细胞亚群检测结果
Ⅲ期患者Tc(CD8+CD28+)均值为12.3±5.1,Ⅳ期患者Tc(CD8+CD28+)均值为9.9±4.6,两者比较有统计学意义(P=0.043),而Tr(CD4+CD25+)、Ts(CD8+CD28-)、NK、NKT等均无统计学意义(P>0.05),见表1。
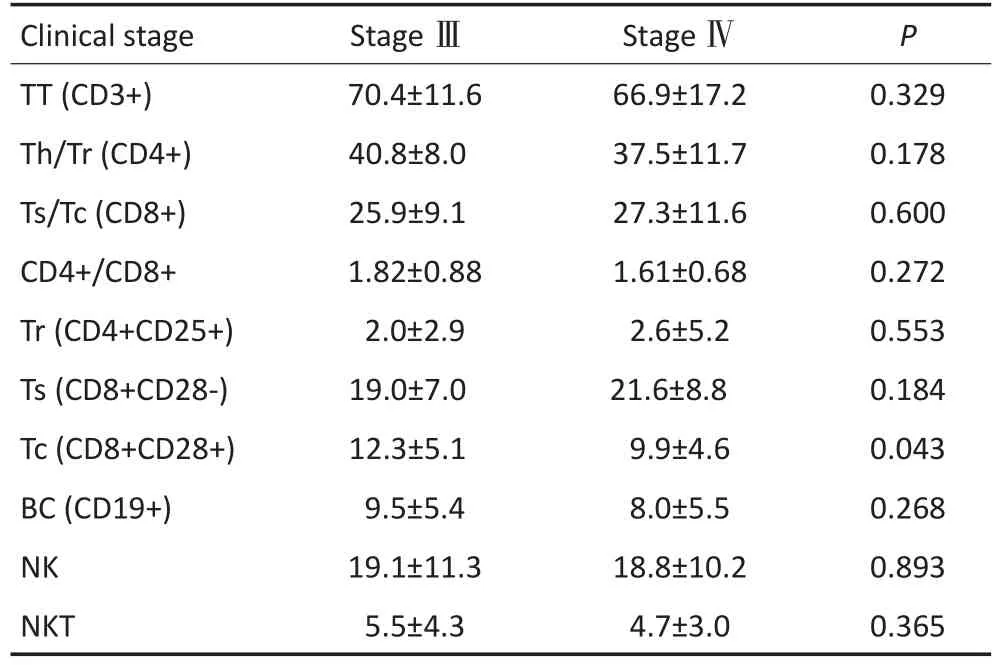
表1 Ⅲ期和Ⅳ期胃癌患者T淋巴细胞亚群分布Table 1 Lymphocyte subset distribution of stages III and IV gastric cancer patients
2.2 T细胞亚群检测结果与肿瘤标记物的相关性。
CEA升高的患者Tc(CD8+CD28+)均值为9.3± 3.6,而CEA未升高的患者Tc(CD8+CD28+)均值为12.1±5.6(P=0.025);CA199升高的患者Tc(CD8+ CD28+)均值为9.3±4.2,而CEA未升高的患者Tc(CD8+CD28+)均值为12.1±5.3(P=0.029),见表2。
2.3 T细胞亚群检测结果与患者OS的关系。
67例胃癌患者随访时间为18个月,无失访患者,随访结果T细胞亚群中,Tc(CD8+CD28+)下降的患者较未下降患者的OS降低(8.1个月vs.15.1个月,P=0.008,图1)。其它亚群的细胞检测结果显示OS差异无统计学意义(表3)。
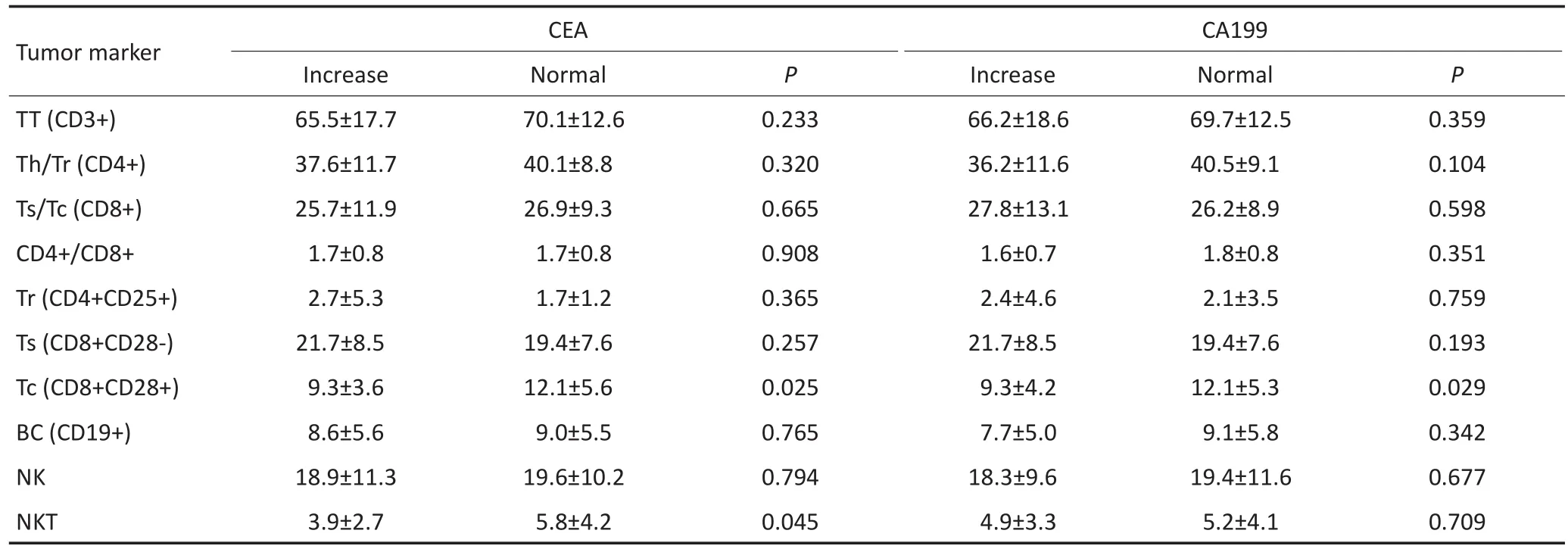
表2 胃癌患者T淋巴细胞亚群与肿瘤标记物的关系Table 2 Correlation between lymphocyte subsets and tumor markers of gastric cancer patients

图1 不同状态的Tc(CD8+CD28+)胃癌患者的生存曲线Figure 1 Progression-free survival curve of gastric cancer patients with different average values of Tc(CD8+CD28+)

表3 胃癌患者不同淋巴细胞亚群与总生存时间的相关性Table 3 Overall survival in gastric cancer patients with different lymphocyte subsets
3 讨论
T淋巴细胞是机体免疫系统内功能最重要的细胞群,在正常机体内各个T淋巴细胞亚群相互作用,维持着机体正常的免疫功能。T淋巴细胞根据细胞表面标志分为不同功能亚群。抗CD3单抗与CD3抗原分子的ε链结合,是总T细胞的标志,而CD4、CD8不能同时表达于成熟的T淋巴细胞表面,故可将成熟的T淋巴细胞分为CD4+T细胞和CD8+T细胞二个亚群。
恶性肿瘤患者通常出现免疫失衡,多表现为细胞免疫功能紊乱,主要表现为T淋巴细胞亚群发生改变,具体表现为CD3+T淋巴细胞、CD3+/CD4+T淋巴细胞以及NK细胞含量改变[3]。有研究结果显示,胃癌患者外周血CD3+T淋巴细胞、CD4+T淋巴细胞的含量以及CD4+/ CD8+淋巴细胞比值明显低于正常人,CD8+细胞则明显高于正常人[4],CD8+T淋巴细胞与患者的预后相关[4-5];CD4+CD25+T淋巴细胞升高的乳腺癌患者更容易发生转移[6],而化疗、放疗等临床治疗有可能改变患者T淋巴细胞亚群的状态[7-8]。
随着基础研究的不断进展,本研究发现CD8+的T细胞依据CD28抗原的不同,又进一步分为CD8+ CD28+和CD8+CD28-两组不同的T淋巴细胞亚群,而这两组不同的细胞亚群在细胞免疫过程中分别有着完全不同的功能。CD8+CD28+T淋巴细胞被称为细胞毒性T细胞(cytotoxic T lymphocyte,Tc),是抗肿瘤免疫的主要杀伤细胞;CD8+CD28-T淋巴细胞被称为调节性的T细胞(suppressor T lymphocyte,Ts),参与调节细胞免疫的过程,这种调节的作用可能是正调节或是负调节。
目前的临床研究大多只是检测CD4+和CD8+的淋巴细胞的含量,对于患者免疫状态的判断有一定的局限性。本研究用流式分析法将CD4+和CD8+T淋巴细胞根据其不同的细胞表面抗原进一步分为不同的亚群Tc(CD8+CD28+)和Ts(CD8+CD28-),并与肿瘤的临床分期、肿瘤标志物、预后的相关性进行了分析。本研究将Ⅲ期与Ⅳ期胃癌患者的T淋巴细胞亚群进行分析,CD4+与CD8+的T淋巴细胞两组比较差异均无统计学意义;将CD8+的T淋巴细胞进一步进行亚群分析,CD8+CD28-T淋巴细胞亚群两组比较差异均无统计学意义,仅CD8+CD28+两组比较差异有统计学意义,表明CD8+CD28+与其它的检测指标相比更能反映患者的免疫状态;TNM分期不同的患者,Tc(CD8+CD28+)值不同,分期越晚Tc(CD8+ CD28+)越低。Tc(CD8+CD28+)具有识别抗原的特异性,能杀伤具有特定的外来抗原与自身主要组织相容性抗原I(major histocompatibility antigen I,MHcI)结合的复合物的靶细胞,是杀伤肿瘤细胞的特异性淋巴细胞。随着肿瘤分期的升高,Tc(CD8+CD28+)呈下降趋势,说明晚期患者抗肿瘤能力即杀伤肿瘤的能力下降。调节细胞毒性T淋巴细胞(cytotoxic T lymphocyte,CTL)的肿瘤治疗目前已应用于临床,获得较好的疗效[9-12]。CEA、CA199是胃癌常用的肿瘤标记物,与病情进展有一定的关系,对临床疗效的评价也有一定的参考意义。CEA、CA199持续升高表明患者的肿瘤负荷增加,病情进展,但是CEA、CA199与患者免疫功能变化的关系,特别是重要的抗肿瘤Tc的关系,尚缺乏报道。本研究结果表明CEA、CA199的数值与Tc(CD8+CD28+)的变化,两者呈负相关,说明随着患者病情的加重,机体抗肿瘤免疫的功能也是下降的,Tc(CD8+CD28+)的变化也是病情变化的参考指标之一。
本研究还发现Tc(CD8+CD28+)对患者的总生存有重要的作用,Tc(CD8+CD28+)降低的患者OS缩短。CD4+/CD8+细胞比值是反映免疫状态的主要指标,CD4+/CD8+细胞比值下降预示机体免疫功能降低。本研究的结果表明CD4+/CD8+细胞比值下降组和未下降组在OS上无统计学意义,但是两组间比较有4.9个月的差值(6.0个月vs.10.9个月),其无统计学意义的原因可能是因为CD4+和CD8+包含了其它功能的亚群细胞,因而Tc(CD8+CD28+)更直接地反映了机体免疫状态,与预后的关系更明显。Tr(CD4+ CD25+)又称为调节性T淋巴细胞(regulatory T lym⁃phocyte,Treg),目前研究发现Treg可以通过多种机制来抑制免疫效应细胞的功能,是肿瘤免疫逃逸的关键因素,并且其增高水平与病程进展和临床病理存在显著相关性[12-13],Treg升高的患者中OS为9.6个月,Treg降低的患者中OS为10.3个月,Treg升高则OS缩短。以Treg及相关免疫抑制性分子作为治疗靶点,抑制Treg的功能来开展肿瘤免疫治疗可能成为今后肿瘤治疗的发展方向。
综上所述,本研究发现Tc(CD8+CD28+)与胃癌患者的临床分期与肿瘤标记物升高相关,Tc(CD8+ CD28+)降低则OS缩短,预示患者不良的预后。随着新的淋巴细胞亚群研究的不断深入及其临床意义不断被发现,淋巴细胞亚群的检测将成为肿瘤诊疗的重要参考依据。
[1]Wang Y.Research progress in immune function of patients with malignant tumors and immunotherapy for cancers[J].Chin J Clin Oncol,2014,41(13):876-879.[王 俞.恶性肿瘤患者的免疫功能状态及免疫治疗研究进展[J].中国肿瘤临床,2014,41(13):876-879.]
[2]Falci C,Gianesin K,Sergi G,et al.Immunesenescence and cancer in elderly patients:results from an exploratory study[J].Exp Gerontol, 2013,48(12):1436-1442.
[3]Liu G,Ren H,Sun XJ,et al.Distribution of natural killer cells and T-lymphocyte subsets in peripheralblood,gallbladder cancer and surrounding tissue[J].Hepatobiliary Pancreat Dis Int,2007,6(1):81-86.
[4]McCoy MJ,Nowak AK,van der Most RG,et al.Peripheral CD8(+)T cell proliferation is prognostic for patients with advanced thoracic malignancies[J].Cancer Immunol Immunother,2013,62(3):529-533.
[5]Ordoñez R,Henríquez-Hernández LA,Federico M,et al.Radio-induced apoptosis of peripheral blood CD8 T lymphocytes is a novel prognostic factor for survival in cervical carcinoma patients.Strahlenther[J]. Strahlenther Onkol,2014,190(2):210-216.
[6]SongQK,RenJ,ZhouXN,et al.Theprognosticvalueof peripheral CD4+ CD25+T lymphocytes among early stage and triple negative breast cancer patients receiving dendritic cells-cytokine induced killer cells infusion[J].Oncotarget,6(38):41350-41358.
[7]Foro P,Algara M,Lozano J,et al.Relationship between radiation-induced apoptosis of T lymphocytes and chronic toxicity in patients with prostate cancer treated by radiation therapy:a prospective study[J].Int J Radiat Oncol Biol Phys,2014,88(5):1057-1063.
[8]Jadidiniaragh F,Yousefi M,Memarian A,et al.Increased frequency of CD8+and CD4+regulatory T cells in chronic lymphocytic leukemia: association with disease progression[J].Cancer Invest,2013,31(2): 121-131.
[9]Fan Q,Zhao ZL,Wu YJ,et al.The evaluation on the changed to immune function and clinical symptoms for CIK/DC-CIK treatment gastrointestinal tumor[J].Proceeding of Clinical Medicine,2016,25(1):3-7. [樊 强,赵振林,吴永杰等.CIK/DC-CIK治疗胃肠道肿瘤患者对免疫功能和近期疗效的评价[J]临床医药实践,2016,25(1):3-7.]
[10]Shan HX,Huang GQ.Clinical efficacy of DC-CIK combined with chemotherapy in the treatment of 45 cases patients with advanced gastric cancer[J].Chin J Gastroenterol Hepatol,2014,23(12):1416-1419.[单海霞,黄广清.DC-CIK联合化疗治疗进展期胃癌45例的临床疗效评价[J].胃肠病学与肝病学杂志,2014,23(12):1416-1419.]
[11]Dai L,Zhao G.Clinical analysis of 65 lung cancer patients treated with DC/CIK cell therapy[J].Med Theor Prac,2015,28(2):196-197.[戴 璐,赵 光.DC/CIK细胞治疗65例肺癌患者临床分析[J].医学理论与实践,2015,28(2):196-197.]
[12]Lee WC,Wu TJ,Chou HS,et al.The impact of CD4+CD25+T cells in the tumor microenvironment of hepatocellular carcinoma[J].Surgery, 2012,151(2):213-222.
[13]Bacic D,Uravic M,Bacic R,et al.Augmentation of regulatory T cells (CD4+CD25+Foxp3+)correlates with tumor stage in patients with colorectal cancer[J].Coll Antropol,2011,35(2):65-68.
(2016-11-07收稿)
(2017-03-06修回)
(编辑:武斌 校对:杨红欣)
Detection of lymphocyte immune function in peripheral blood of patients with advanced gastric cancer
Lei ZHOU,Ni JIANG,Xiaoli WANG,Xinna ZHOU,Wen SI,Jun REN
Jun REN;E-mail:jun.ren@duke.edu
Department of Medical Oncology,Capital Medical University Cancer Center,Beijing Shijitan Hospital,Beijing 100038,China
Objective:To investigate the clinical significance of the changes of T lymphocyte subsets in the peripheral blood of patients with gastric cancer.Methods:The lymphocyte subsets in 67 patients with gastric cancer were analyzed with flow cytometry.CEA and CA199 from all patients were also detected.Results were statistically analyzed,and the patients were followed up.Results:The average values of Tc(CD8+CD28+)in patients with stagesⅢandⅣgastric cancer were 12.3±5.1 and 9.9±4.6,respectively,with significant difference(P=0.043).The average values of Tc(CD8+CD28+)in patients with elevated CEA and with normal CEA were 9.3±3.6 and 12.1± 5.6,respectively(P=0.025).Similarly,the average values of Tc(CD8+CD28+)in patients with elevated CA199 and with normal CEA were 9.3±4.2 and 12.1±5.3,respectively(P=0.029).The overall survival of patients with decreased Tc(CD8+CD28+)was lower than that of patients with normal Tc(CD8+CD28+)(8.1vs.15.1 months,P=0.008).Conclusion:The cellular immune function of patients with gastric cancer gradually decreased with the progression of TNM.Higher CA199 and CEA values indicated lower average values of Tc(CD8+ CD28+).The overall survival of patients with decreased Tc(CD8+CD28+)was lower.
gastric cancer,lymphocyte subsets,immune function

10.3969/j.issn.1000-8179.2017.05.281
首都医科大学附属北京世纪坛医院肿瘤内科(北京市100038)
任军 jun.ren@duke.edu
周蕾 专业方向为肿瘤分子生物学及靶向治疗。
E-mail:zhoulei-057@163.com
