不同日龄略阳乌鸡肌肉中肌苷酸含量的变化规律
2017-04-05路宏朝张涛王令
路宏朝++张涛++王令

摘要:以18日胚龄及6、180日龄黄羽鸡和略阳乌鸡为研究对象,探讨不同发育时期肌肉中风味物质的形成规律。[JP2]采用高效液相色谱仪测定腿肌和胸肌中的肌苷酸含量,利用荧光定量PCR方法检测肌苷酸合成关键酶腺苷琥珀酸裂解酶(ADSL)基因的mRNA表达情况。结果显示:黄羽鸡和略阳乌鸡腿肌中ADSL基因的表达、肌苷酸的含量均在6日龄时最高,胸肌中肌苷酸在180日龄时含量最高,表达趋势基本一致;略阳乌鸡腿肌和胸肌的肌苷酸含量在180日龄时明显高于黄羽鸡。同时,ADSL基因的表达量在不同时期均明显高于黄羽鸡,表明成年略阳乌鸡的肉品质优于黄羽鸡。
关键词:略阳乌鸡;肉品质;肌苷酸;腺苷琥珀酸裂解酶(ADSL)
中图分类号: S831.1文献标志码: A
文章编号:1002-1302(2016)12-0277-03
收稿日期:2015-10-12
基金项目:陕西省科技厅农业攻关项目(编号:2013K02-26-02);陕西省教育厅项目(编号:12JS028)。
作者简介:路宏朝(1980—),女,陕西勉县人,硕士,副教授,主要从事动物生理学研究。E-mail:zl780823@sina.com。
多年来,肉用家禽的选育主要侧重于生长速度和肌肉产量2个方面,随着家禽育种技术的发展和应用,饲养1羽体质量为1.8 kg的肉鸡仅需5周的生产时间。然而,家禽快速生长的同时也引发了骨骼形态异常、胴体品质下降等一系列问题,且深加工后的肉品质正随着生产性能的提高而逐步下降[1]。大量研究表明,鲜味是评价肉品质的重要指标之一,而肌苷酸(inosinic acid,IMP)是决定畜禽肉质鲜味的主要物质[2-3]。IMP和糖蛋白在水和脂肪中加热会产生明显的肉鲜味,与谷氨酸钠具有协同鲜味作用。肌苷酸已成为肉质评定的重要指标,被广泛应用于各种动物肉类产品的品质评定,其含量高低间接反映出肉类食品风味的优劣[4-5]。腺苷琥珀酸裂解酶(adenylosuccinate yase,ADSL)是肌苷酸合成过程中的关键酶之一。张学余等研究发现,ADSL基因对鸡的肌肉肌苷酸含量可产生一定影响[6]。
略阳乌鸡是陕西省的优良地方鸡种之一,产于略阳县黑河流域。略阳乌鸡的体型大小位居全国四大乌鸡之首,具有“六端乌”(乌皮、乌喙、乌腿、乌趾、乌舌、乌冠)、屠宰率高、蛋大微绿、肉用性能较好、兼具药用价值等优点,被誉为“禽中明珠”[7]。本研究采用高效液相色谱法,测定不同发育时期略阳乌鸡和黄羽鸡肌肉样中的肌苷酸含量,并运用实时荧光定量PCR技术分析肌苷酸的关键合成酶——腺苷琥珀酸裂解酶(ADSL)的基因相对表达情况,初步探讨略阳乌鸡在不同发育时期ADSL和肌苷酸的分布规律,为鸡肌肉肌苷酸含量与肌苷酸合成关键酶之间关系的进一步研究奠定基础,并为从分子水平阐明略阳乌鸡的特异鲜味机理提供基础数据。
1材料与方法
1.1试验动物
将数枚黄羽鸡和略阳乌鸡种蛋置于全自动孵化机中孵化,分别取8、18日胚龄及6、180日龄黄羽鸡和略阳乌鸡的腿肌、胸肌,于-80 ℃下冻存备用。
1.2试剂
肌苷酸标准品(上海倍卓生物科技有限公司,纯度为98%),甲醇(色谱纯),甲酸铵(分析纯),高氯酸(分析纯,含量为70%~72%)。其他试剂均为国产分析纯。
1.3主要仪器
微电脑全自动孵化机,超纯水机,电热鼓风干燥箱,高速离心机,数显分散均质机,Waters 2695 Alliance型高效液相色谱仪,Waters 2487型紫外检测仪,核酸定量仪(Thermo Fisher公司),荧光定量PCR仪(ABI公司)。
1.4试验方法
1.4.150 mmol/L、pH值6.5甲酸铵缓冲溶液(流动相)的配制
称取3.15 g甲酸铵于1 000 mL大烧杯中,加入500 mL超纯水,采用0.5 mol/L氢氧化钠溶液将其pH值调至6.5,定容至1 000 mL。使用前采用0.45 μm滤膜过滤。
1.4.20.1 mg/mL肌苷酸标准储备液
准确称取1 mg肌苷酸标准品,采用5%甲醇水溶液定容至10 mL,摇匀。分别取上述储备液10、20、30、40 μL配制浓度为10、20、30、40 ng/mL的肌苷酸标准工作液,采用5%甲醇水溶液定容至1 mL,摇匀。于使用前配制。
1.4.3样品处理
分别称取5 g胸肌、腿肌肌肉样品,置于干净器皿中并捣碎,加入20 mL 6%高氯酸,采用分散均质机匀浆。以 4 000 r/min 离心15 min,收集上清;沉淀物再次加入15 mL 6%高氯酸,匀浆并离心,合并2次上清液即为提取液。提取液再经离心,弃去沉淀物,采用配置好的NaOH溶液將提取液的pH值调整至6.5,采用水定容至100 mL,摇匀。测定前采用0.45 μm滤膜过滤,色谱经流动相平衡30 min后,取标准液及样品提取液利用色谱仪进行分析。
1.4.4色谱条件
色谱柱:Waters AtlantisTM dC18柱(4.6 mm×150 mm,5 μm)。流动相:50 mmol/L、pH值6.5甲酸铵缓冲溶液(含5%甲醇)。流速1 mL/min、进样量 2 mL、紫外检测波长 254 nm,柱温为室温。标准工作液、样品提取液的运行时间均为5 min。
1.4.5RNA提取与Real-time荧光定量PCR检测
取不同日龄略阳乌鸡的腿肌组织样50~100 mg,在液氮预冷的研钵中研磨至粉末状,期间须不断补充液氮;加入 500 μL Trizol Reagent,摇匀后静置5 min,于4 ℃、12 000 r/min 下离心 10 min,取上清;加入0.1 mL氯仿,剧烈振荡15 s,静置5 min,于4 ℃、12 000 r/min下离心15 min,取上清;加入等体积异丙醇,轻轻摇匀后静置10 min,于4 ℃、12 000 r/min 下离心10 min,弃上清;采用1 mL 75%乙醇洗涤RNA沉淀,于4 ℃、12 000 r/min下离心10 min,弃上清;室温干燥,加入50 μL无RNase水,使RNA充分溶解,并检测其浓度。按照RT-PCR System反应体系试剂盒(TaKaRa公司)的要求,将所提取的RNA样品反转录为cDNA。
采用普通PCR检测cDNA纯度,反应程序为:95 ℃预变性5 min;95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,共30个循环;72 ℃延伸10 min。取5 μL产物进行1%琼脂凝胶电泳,并于凝胶成像系统下观察结果。
采用Real-time荧光定量PCR检测ADSL基因的表达情况。以鸡的β-actin为内参基因,20 μL扩增体系为:SYBRⅡ(TaKaRa公司)10 μL、Primer F/R 3.2 μL、cDNA 2 μL、H2O 4.8 μL,引物序列见表1。反应程序为:95 ℃预变性5 min;95 ℃ 变性10 s,58 ℃退火20 s,72 ℃延伸15 s,共40个循环。
2结果与分析
2.1标准曲线及线性范围
将0.1 mg/mL肌苷酸标准储备液分别配制为1、2、3、4 μg/mL 肌苷酸标准工作液,按“1.4.4”节设定色谱条件进行色谱分析,以肌苷酸浓度为自变量(x),以相应的色谱峰面积响应值为因变量(y)建立标准曲线方程。结果表明,在2~4 μg/mL 浓度范围内,肌苷酸浓度与峰面积响应值之间具有良好的线性关系。回归方程为y=43.816 9x-304.292,相关系数r=0.999 671,r2=0.999 342。标准曲线分布见图1。
[FK(W10][TPLHC1.tif]
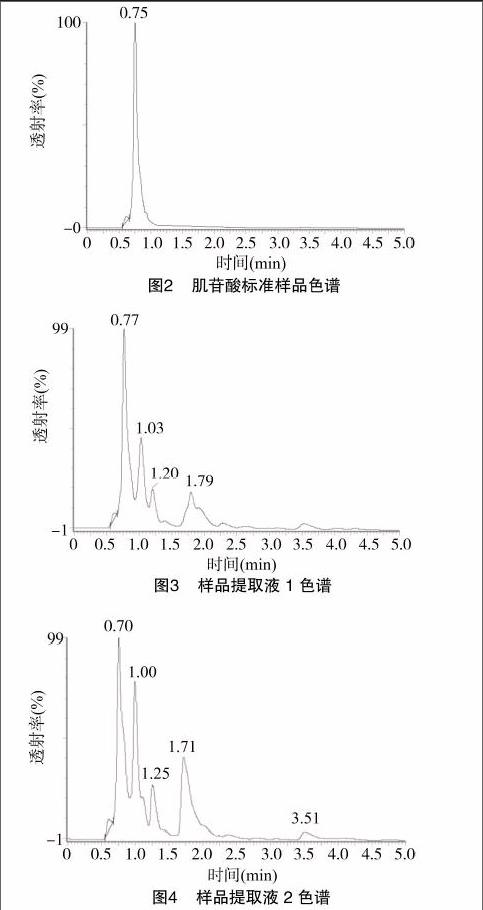
2.2肌苷酸标准品与样品的色谱对比分析
与以往研究不同,本试验采用甲酸铵缓冲液作为流动相测定了样品中肌苷酸的含量。由标准样品的高效液相色谱(图2)可知,肌苷酸标准品的出峰时间为0.75 min,各肌肉组织样品与其他组分的色谱峰之间达到了较好的分离,其中与标准品出峰时间较为接近的是0.75 min的峰形。检测所有样品发现,色谱峰保留时间均为0.75~0.77 min,因此可确定为肌苷酸的峰形(图3、图4)。
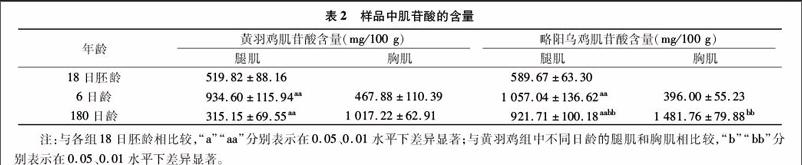
2.3不同样品肌苷酸的含量
分别取黄羽鸡和略阳乌鸡18日胚龄、6日龄、180日龄的胸肌和腿肌样品,制备样品溶液,采用“1.4.4”节的色谱条件进行分析,以峰面积套用图1的回归方程计算样品中肌苷酸的含量(表2)。结果表明:与180日胚龄相比,黄羽鸡6日龄的腿肌中肌苷酸含量最高(P<0.01),180日龄时下降至最低(P<0.01);略阳乌鸡6日龄的腿肌中肌苷酸含量最高,180日龄时有所降低,但仍明显高于18日胚龄。2个鸡种胸肌中的肌苷酸含量均在180日龄达到最高。略阳乌鸡18日胚龄、6日龄时腿肌和胸肌中的肌苷酸含量与黄羽鸡均没有显著差
[FK(W8][HT6H][JZ(]表2样品中肌苷酸的含量[JZ)][HTSS]
[HJ*5][BG(!][BHDFG3,WK12,WK48W]年龄[ZB(][BHDWG1*2,WK24。2W]黄羽鸡肌苷酸含量(mg/100 g)略阳乌鸡肌苷酸含量(mg/100 g)
[BHDWG1*2,WK12。4W][XXZSX*2-ZSX23*2]腿肌胸肌[XXZSX*2-ZSX23*2]腿肌胸肌[ZB)W]
[BHDG1*2,WK12。5DWW]18日胚龄519.82±88.16589.67±63.30
[BHDW]6日龄934.60±115.94aa467.88±110.391 057.04±136.62aa396.00±55.23
[BH]180日龄315.15±69.55aa1 017.22±62.91921.71±100.18aabb1 481.76±79.88bb[BG)F]
注:与各组18日胚龄相比较,“a”“aa”分别表示在0.05、0.01水平下差异显著;与黄羽鸡组中不同日龄的腿肌和胸肌相比较,“b”“bb”分别表示在0.05、0.01水平下差异显著。
异;略阳乌鸡180日龄时腿肌和胸肌中的肌苷酸含量明显高于黄羽鸡,差异极显著(P<0.01)。
2.4不同日龄黄羽鸡和略阳乌鸡腿肌组织中ADSL基因的mRNA表达水平
分别取8日胚龄、18日胚龄、6日龄、180日龄黄羽鸡和略阳乌鸡的腿肌组织提取RNA,采用Real-time荧光定量PCR检测ADSL基因的mRNA表达情况。结果表明:ADSL基因的表达随着日龄的增加呈上升趋势,2个鸡种腿肌中ADSL基因的表达水平均在6日龄达到最高,然后逐渐下降;在18日胚龄、6日龄、180日齡阶段,略阳乌鸡腿肌中ADSL基因的表达均明显高于黄羽鸡(图5)。
[TPLHC5.tif]
3结论与讨论
肌苷酸(IMP)与畜禽肉类食品鲜味的产生密切相关[3,8],国内外学者对鸡、猪、鱼等动物肌肉中的IMP开展了大量研究,目前世界上大多数国家均以肌苷酸含量作为评价肉类新鲜程度的指标之一。乌骨鸡具有乌皮、乌肉、乌骨等特征,是我国传统的药食兼用鸡种。陈国宏等对相同地方鸡种肌肉中的肌苷酸含量进行比较研究,发现泰和乌骨鸡的肌苷酸含量很高,此结论从客观上提示了乌骨鸡鲜味优于其他鸡种[9]。王翠丽等研究发现,川南乌骨鸡中肌苷酸等风味物质含量丰富[10]。目前,对于陕西略阳乌鸡不同发育期肌肉中的肌苷酸含量尚无系统报道。
大量研究表明,肌苷酸的测定方法较多,但均存在一定缺陷。紫外分光光度法仅用于粗略定量;毛细管电泳法的分离度偏低,导致肌苷和腺苷单磷酸等相似物质引起干扰;薄层层析法的操作步骤复杂,整个过程耗时多且回收率低。高效液相色谱法是一种高效、快速、高选择性、高灵敏度的新型分离分析技术,样品分析程序简单快速,测定结果精确[11]。本研究采用高效液相法进行检测,结果发现样品的色谱峰保留时间大多为0.75~0.77 min,与标准品出峰时间基本一致,同时样品中其他组分的色谱峰之间也达到了较好的分离效果。本试验采用甲酸铵为流动相,作为水溶性弱酸盐,其有利于延长色谱柱的使用寿命,从而可用于大量样品的测定。
本研究检测了黄羽鸡和略阳乌鸡发育期3个时间点的肌苷酸含量。结果表明,黄羽鸡和略阳乌鸡的腿肌均在6日龄时肌苷酸含量最高,胸肌则在180日龄时肌苷酸含量最高。随着日龄的增加,腿肌中的风味物质在幼年时达到最高,然后逐渐降低;而胸肌中的风味物质却逐渐增多,表明胸肌中肌苷酸的合成主要发生在成年后。比较2个鸡种发现,略阳乌鸡180日龄时腿肌和胸肌的肌苷酸含量均明显高于黄羽鸡,但其余时间段差异不显著。对于不同鸡种,肌肉发育早期肌苷酸的合成没有显著差异,但成年后略阳乌鸡肌肉中肌苷酸的合成量明显多于黄羽鸡,因此成年略阳乌鸡的肉品质优于黄羽鸡。
肌苷酸在体内的合成代谢过程十分复杂,从头合成涉及10步反应,腺苷琥珀酸裂解酶(ADSL)是催化第8步反应的酶,也是IMP合成酶系中催化合成嘌呤核苷酸起始合成与循环的唯一双功能酶[6,12]。该酶催化2个重要的反应,由氨基咪唑琥珀基氨甲酰核苷酸生成氨基咪唑氨甲酰核苷酸的反应(由SACIAR生成AICAR的反应),以及由腺苷酸琥珀酸生成腺苷酸单磷酸的反应,这2个反应对于肌肉中肌苷酸的最终含量具有重要影响,因此ADSL基因也成为畜禽肉品鲜味研究的候选基因[12]。本研究对不同发育时期黄羽鸡和略阳乌鸡腿肌中ADSL基因的表达进行了检测,结果表明:对于不同鸡种ADSL基因的表达趋势基本一致,表达量均在6日龄时最高;进一步比较不同日龄黄羽鸡和略阳乌鸡发现,略阳乌鸡腿肌中ADSL基因的表达量在不同时期均明显高于黄羽鸡。这与高效液相色谱检测肌苷酸含量的结果基本一致,表明ADSL基因的表达促进了肌苷酸的合成。但也存在一定区别,略阳乌鸡腿肌中ADSL基因的表达量在不同发育时期均明显高于黄羽鸡,经高效液相检测,仅180日龄时腿肌中的肌苷酸含量明显高于黄羽鸡。这是由于肌苷酸的合成涉及10种关键酶,ADSL是关键酶之一但不是唯一酶。对于不同鸡种,不同发育时期参与肌苷酸合成的关键酶表达的时空性也不同,从而导致肌苷酸的合成量表现出明显差异。成年略阳乌鸡肌肉中的肌苷酸含量显著高于黄羽鸡,但不同鸡种间参与肌苷酸合成的其他酶的关键作用尚有待进一步研究。
[HS2*2][HT8.5H]参考文献:[HT8.SS]
[1]朱晓萍. 家禽生长与肉质[J]. 中国家禽,2000(8):34-35.
[2]李慧芳,陈国宏,吴信生,等. 动物肌肉肌苷酸研究进展[J]. 动物科学与动物医学,1999(4):9-10.
[3]罗桂芬,孙世铎,陈继兰,等. 肉类风味物质:肌苷酸[J]. 中国家禽,2004,26(3):41-43.
[4]苏一军,李慧芳,沈晓鹏,等. 不同类型鸡肌肉肌苷酸含量分析和比较[J]. 中国家禽,2002,24(23):9-10.
[5]李燕,周培根,戚晓玉. 肌苷酸和肌苷作为评价虾鲜度质量指标的研究[J]. 上海水产大学学报,2002,11(3):264-267.
[6]张学余,季从亮,陈国宏,等. 鸡腺苷琥珀酸裂解酶(Adsl)基因多态性及其与肌苷酸含量相关研究[J]. 云南农业大学学报,2006(2):231-234.
[7]刘自华,胡慶荣,刘金笔,等. 略阳鸡养殖概况与产业化经营思考[J]. 家禽科学,2005(9):36-38.
[8]张学余,李慧芳,耿拓宇,等. 乌骨鸡肌肉肌苷酸含量[J]. 中国兽医学报,2003,23(3):261-262.
[9]陈国宏,李慧芳,吴信生,等. 泰和乌骨鸡肌肉肌苷酸含量变化规律及其遗传力估测[J]. 扬州大学学报,2002,23(2):29-32.
[10]王翠丽,柏雪,邱翔,等. 乌骨鸡肉中氨基酸组成和肌苷酸含量的分析[J]. 西南民族大学学报:自然科学版,2011,37(1):90-92.
[11]王欢欢,张乐,李庆海,等. 高效液相色谱法同时测定乌骨鸡肌肉中的黑色素与肌苷酸[J]. 中国家禽,2014,36(21):12-16.
[12]徐善金,虞德兵,汪峰,等. 鸭腺苷琥珀酸裂解酶基因序列特征及表达与肌肉肌苷酸含量的相关性分析[J]. 中国农业科学,2012,45(4):774-785.
