离子色谱—抑制电导法测定肉类产品中的肌苷酸含量
2015-11-16朱作艺张玉王君虹李雪王伟
朱作艺+张玉+王君虹+李雪+王伟
摘 要 建立了一种离子色谱分离,抑制电导直接检测肌苷酸的新方法。采用高交换容量阴离子交换柱Ionpac AS11-HC,以30 mmol/L KOH在线等度淋洗,可在短时间内完成肌苷酸的检测,且7种常规阴离子对其测定不存在干扰。采用本方法测定肌苷酸的线性范围为1.0~200 mg/L,线性相关系数(R2)为0.999,线性关系良好。肌苷酸保留时间、峰高和峰面积的相对标准偏差分别为0.16%, 0.94%和0.86%,方法具有较好的重现性。本方法可应用于肉类产品中肌苷酸含量的测定,样品实际加标回收率范围在86.0%~110.0%之间。该方法简单、方便、准确、可靠,为肉类鲜味成分研究提供了一种快速及有效的分析方法。
关键词 离子色谱; 抑制电导; 肌苷酸; 肉类产品
1 引 言
肌苷酸(Inosine monophosphate, IMP)又称为次黄嘌呤核苷酸,最早于1847年由德国化学家Liebig在牛肉组织中发现。1913年,Kodama和Kuninuka发现肌苷酸的鲜味特征,其增加鲜味的能力较谷氨酸钠强40倍。肌苷酸广泛存在于动物肌肉组织中,其含量是衡量肉质鲜味的重要指标[1~3]。随着养殖业的迅速发展及生活水平的提高,人们对肉类食品的需求日益增加,对肉品质的要求也越来越高,肌苷酸含量已成为于各种肉类产品品质评定的指标。因此测定肉类食品中肌苷酸的含量,对研究肉类食品风味及呈味物质之间的相互关系具有非常重要的意义。
肌苷酸主要测定方法有分光光度法[4]、高效液相色谱法[5~9]、反相离子对色谱法[10]、毛细管电泳法[11,12],目前采用最多的是高效液相色谱法,然而由于肌苷酸疏水性相对较弱,高效液相色谱法对肌苷酸保留较弱,保留时间接近死时间,对于复杂基质样品容易存在干扰,因此有研究者采用反相离子对色谱法[10]。离子色谱法(Ion chromatography, IC)是一种分析无机阴阳离子、有机阴阳离子的高效分离检测技术,具有简单、快速、灵敏度高等特点[13]。肌苷酸易溶于水,在中性和碱性溶液中稳定,在pH<4的条件下稳定性较差,容易降解为次黄嘌呤和D-核糖[14],由于肌苷酸带有磷酸基团,在碱性水溶液中可离解为离子态,因此可以直接采用IC进行测定。本实验建立了一种阴离子色谱交换分离-抑制电导直接检测肌苷酸含量的方法,并应用于鸡肉、鱼肉、猪肉、牛肉等实际样品的测定。本方法简单、方便、高效、选择性好。
2 实验部分
2.1 仪器与试剂
Dionex ICS-3000离子色谱仪(美国戴安公司),配自动EG淋洗液发生器和DS6电导检测器、Chromeleon 6.80色谱工作站、Dionex IonPac AG11-HC (50 mm×4 mm) 保护柱+Dionex IonPac AS11-HC (250 mm×4 mm) 分离柱、Dionex ASRS 300-4 mm电化学自再生抑制器;数显恒温水浴锅(国华电器有限公司);超声波仪(上海生析超声仪器有限公司);0.22 μm尼龙滤膜过滤头。
标准品5-肌苷酸二钠(Sigma公司),实验室用水均为18.2 MΩ·cm去离子水。
2.2 标准溶液配制
配制1000 mg/L 5′-肌苷酸二钠标准储备溶液,于4℃保存;将标准储备溶液稀释成1.0, 2.0, 5.0, 10, 20, 50, 100和 200 mg/L系列浓度的标准工作溶液。
2.3 样品制备
目前肉类产品中的肌苷酸含量普遍采用H3ClO4作提取液,由于H3ClO4提取液的pH值较低,容易造成肌苷酸降解,因此采用纯水提取肌苷酸[5]。根据文献[5]报道,肌苷酸纯水提取法比普通H3ClO4提取法的提取率高37%。分别称取鸡肉、鱼肉、猪肉、牛肉样品各5.0 g,放入200 mL烧杯中,加入90 mL 95℃的去离子水,将烧杯放入恒温水浴中,保持水温95℃ 5 min,超声波提取30 min,冷却至室温后定容至100 mL,滤纸过滤后,取滤液1.0 mL,分别加入2.0 mL去离子水和2.0 mL乙腈,涡旋振荡1.0 min, 以4000 r/min离心10 min后,取上清液,经0.22 μm尼龙滤膜过滤,供离子色谱测定。
2.4 色谱条件
色谱柱为Dionex IonPac AG11-HC保护柱+Dionex IonPac AS11-HC分离柱;柱温为30℃;采用30 mmol/L KOH在线等度淋洗;流速为1.0 mL/min;自再生电化学抑制模式,抑制电流为75 mA;电导检测;进样体积为25 μL;外标法峰面积定量分析。
3 结果与讨论
3.1 色谱条件的选择
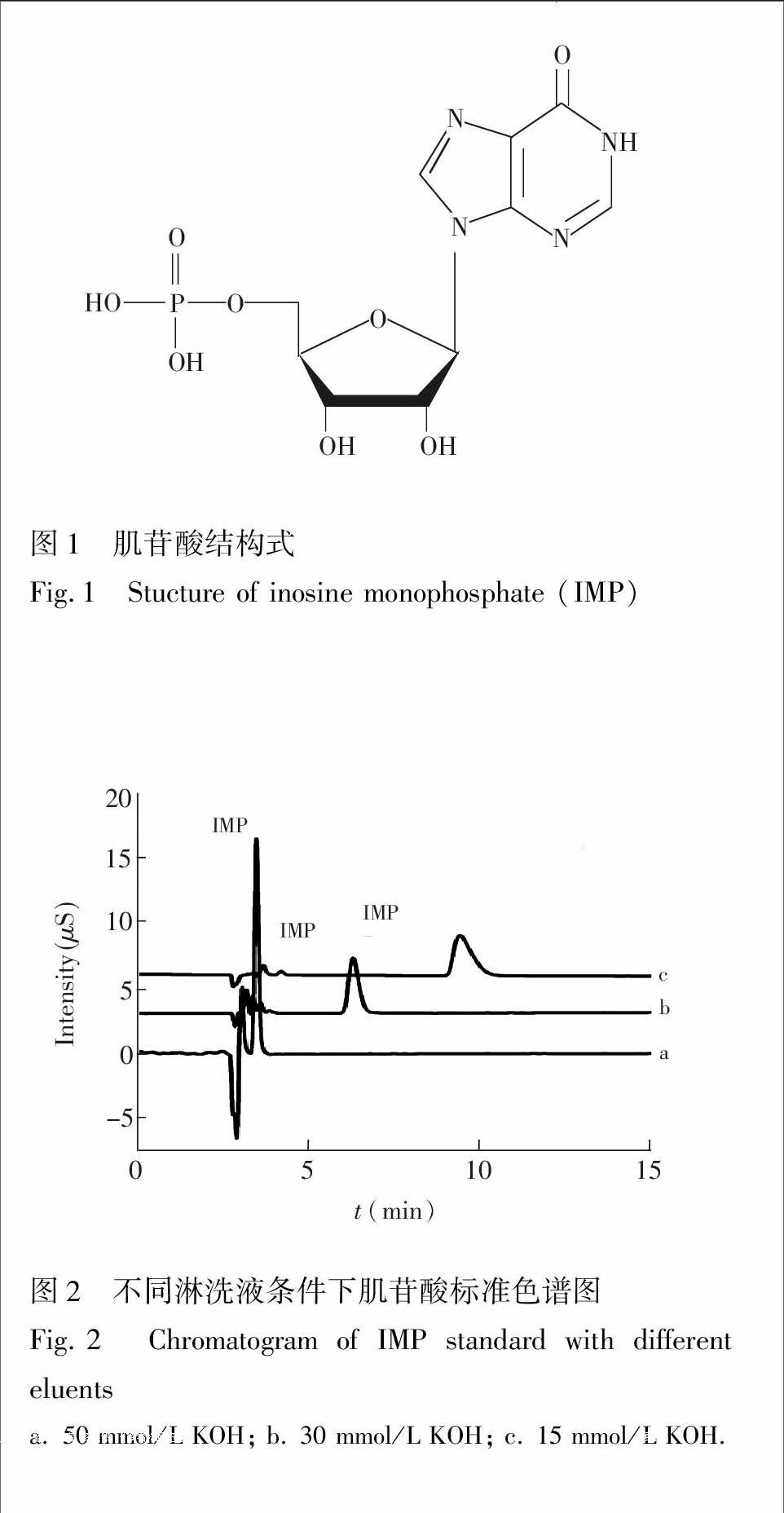
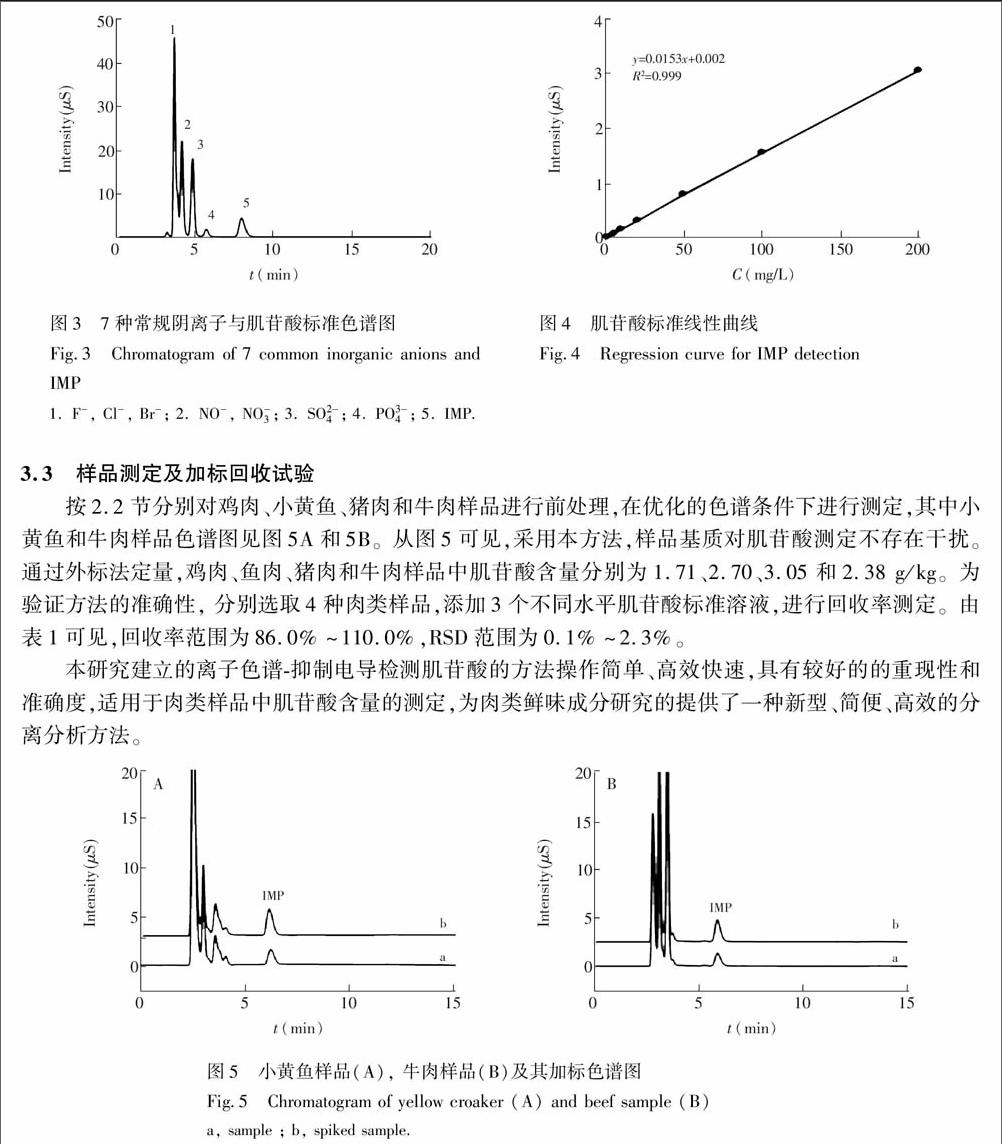
从肌苷酸结构(图1)可知,肌苷酸带有磷酸基团,因此在碱性条件下可解离成阴离子,可以采用阴离子交换色谱对其进行分离。同时,由于肌苷酸仍具有一定的疏水性,为了保证其在色谱柱上的快速洗脱,不宜采用疏水性较强的阴离子交换柱。本实验选用疏水性较弱的Ionpac AS11-HC高交换容量色谱柱分离肌苷酸,采用KOH溶液作为淋洗液。由于KOH溶液容易吸收空气中的CO2而改变淋洗液组成,因此采用自动淋洗液发生器在线产生KOH溶液,等度洗脱方式。为了得到较好的分离效果及合理的分析时间,对KOH淋洗液条件进行了优化(图2),
当采用50 mmol/L KOH在线淋洗时,肌苷酸保留时间短,接近系统时间,在此条件下,样品基质易对肌苷酸测定造成干扰;采用30 mmol/L KOH在线淋洗时,肌苷酸保留时间为6.0 min,保留时间适中,峰型对称;采用15 mmol/L KOH在线淋洗时,肌苷酸保留时间为9.0 min,峰型效果较差,存在拖尾。为保证较好的分离效果和效率,最后采用30 mmol/L KOH作为最佳淋洗液。 图2 不同淋洗液条件下肌苷酸标准色谱图Fig.2 Chromatogram of IMP standard with different eluentsendprint
a. 50 mmol/L KOH; b. 30 mmol/L KOH; c. 15 mmol/L KOH.
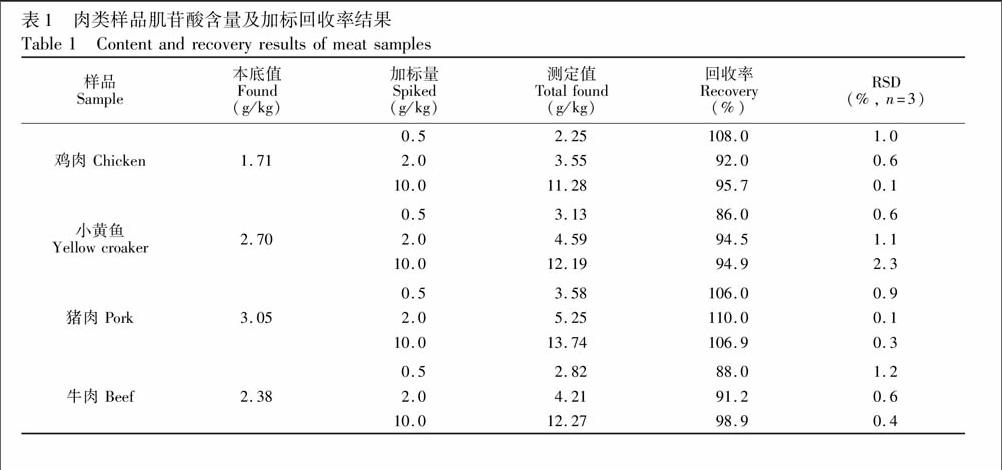
由于实际肉类样品成分复杂,通常含有Cl、NO3、SO24等常规阴离子,为验证在选择的色谱条件下常规阴离子对目标分析离子的干扰性,配制了含F(2.0 mg/L)、Cl(15 mg/L)、NO2(2.0 mg/L)、Br2.0 mg/L)、NO3(10 mg/L)、SO24(10 mg/L)、PO34(5.0 mg/L)的混合标准溶液,于上述最佳淋洗液条件下直接进样测定。由于淋洗液浓度相对较高,7种常规阴离子均在5 min内出峰(图3),同时未实现完全分离,但从出峰顺序可知,7种常规阴离子对肌苷酸的测定不存在干扰。
3.2 线性关系、重现性及方法的检出限
采用上述优化后的色谱条件,分别对肌苷酸系列标准工作溶液进行测定,以相应的色谱峰面积(y)对其质量浓度(x,mg/L)进行线性回归(图4)。肌苷酸浓度1.0~200 mg/L范围内与峰面积呈良好的线性关系,线性方程为y=0.0153x+0.002,线性相关系数R2=0.999。在优化后的色谱条件下,分析50 mg/L肌苷酸标准溶液,连续进样6次,其保留时间相对标准偏差(RSD)为0.16%,色谱峰高RSD为0.94%,色谱峰面积RSD为0.86%,表明本方法具有较好的重现性。将肌苷酸标准品配制成相应浓度,当信噪比(S/N)为3时,得到肌苷酸仪器检出限为0.2 mg/L。采用2.3节中样品前处理方法,并将样品稀释了100倍,因此肌苷酸的样品检出限为20 mg/kg。
3.3 样品测定及加标回收试验
按2.2节分别对鸡肉、小黄鱼、猪肉和牛肉样品进行前处理,在优化的色谱条件下进行测定,其中小黄鱼和牛肉样品色谱图见图5A和5B。从图5可见,采用本方法,样品基质对肌苷酸测定不存在干扰。通过外标法定量,鸡肉、鱼肉、猪肉和牛肉样品中肌苷酸含量分别为1.71、2.70、3.05和2.38 g/kg。为验证方法的准确性, 分别选取4种肉类样品,添加3个不同水平肌苷酸标准溶液,进行回收率测定。由表1可见,回收率范围为86.0%~110.0%,RSD范围为0.1%~2.3%。
本研究建立的离子色谱-抑制电导检测肌苷酸的方法操作简单、高效快速,具有较好的的重现性和准确度,适用于肉类样品中肌苷酸含量的测定,为肉类鲜味成分研究的提供了一种新型、简便、高效的分离分析方法。
References
1 Kawai M, Okiyama A, Ueda Y. Chemical Senses, 2002, 27(8): 739-745
2 Suzuki A, Homma N, Fukuda A, Hirao K, Uryu T, Ikeuchi Y. Meat Science, 1994, 37(3): 369-379
3 CAO Zhen-Hui, YANG Lin-Nan, GE Chang-Rong, NIU Le-Bao. Animal Science & Veterinary Medicine, 2003, 20(12): 34-35
曹振辉, 杨林楠, 葛长荣, 牛乐宝. 动物科学与动物医学, 2003, 20(12): 34-35
4 XU Wei, TAN Hong, SONG Guang-Lin, HE Jin-Lin. Science and Technology of Food Industry, 2010, (12): 344-345
徐玮, 谭红, 宋光林, 何锦林. 食品工业科技, 2010, (12): 344-345
5 WANG Ting-Ting, CHEN Yi-Hui, HU Min-Jie, LI Xue-Zhen. Chinese Journal of Chromatography, 2012, 30(2): 215-218
王婷婷, 陈易晖, 胡敏杰, 李雪珍. 色谱, 2012, 30(2): 215-218
6 YANG Juan-Ning, YANG Yuan-Hao, LI Lei, WANG Lü-Zhou, ZHOU Ji-Shu, WU Jie, LI Hai-Bin. Freshwater Fisheries, 2013, 43(2): 80-83
杨娟宁, 杨元昊, 李蕾, 王绿洲, 周继术, 兀洁, 李海滨. 淡水渔业, 2013, 43(2): 80-83
7 ZHOU Jun-Hua, LIANG Qi-Mei, LIANG Fang-Fang, LUO Xian-Qing, HUANG Li-Xia, LU Gui-You, HE Ren-Chun. Modern Agricultural Science and Technology, 2014, 19: 294-295
周俊华, 梁琪妹, 梁方方, 罗鲜青, 黄丽霞, 卢桂猷, 何仁春. 现代农业科技, 2014, 19: 294-295
8 LIU Xu, WANG Jun, ZHANG Wen, DU Jia-Ying, SU Yong-Quan. Marine Sciences, 2008, 32(2): 22-24
刘 旭, 王 军, 张 纹, 杜佳莹, 苏永全. 海洋科学, 2008, 32(2): 22-24
9 WANG Hai, XU Ya-Ou, WANG Kang-Huan, JIANG Xiao-Song, ZHAO Yan-Ying. Journal of Southwest University for Nationalities, 2013, 39(5): 667-670
王 海, 徐亚欧, 王康环, 蒋小松, 赵燕英. 西南民族大学学报, 2013, 39(5): 667-670
10 LI Yang-Jie, GONG Zhi-Qiang, HUANG Min. China Journal of Experimental Traditional Medical Formulae, 2012, 18(7): 116-118
李阳杰, 龚志强, 黄 敏. 中国实验方剂杂志, 2012, 18(7): 116-118
11 ZHOU Mei-xian, ZHOU Ye-Fei. Food Science, 2009, 24: 412-415
周梅仙, 周业飞. 食品科学, 2009, 24: 412-415
12 DU Jian-Zhong, ZENG Xiu-Wen, HUANG Shao-Chun, DING Ding. Science and Technology of Food Industry, 2010, (12): 335-337
杜建中, 曾秀文, 黄少春, 丁 玎. 食品工业科技, 2010, (12): 335-337
13 MOU Shi-Fen, LIU Ke-Na, DING Xiao-Jing. Ion Chromatographic Method and Its Application, Beijing: Chemical Industry Press, 2005: 6
牟世芬, 刘克纳, 丁晓静. 离子色谱方法及应用, 北京: 化学工业出版社, 2005: 6
14 Vani N D, Modi V K, Kavitha S, Sachindra N M, Mahendrakar, N S. LWT-Food Sci. Technol., 2006, 39(6): 627-632endprint
