与番茄黄化曲叶病毒病抗病基因Ty—3紧密连锁标记的比较与分析
2017-04-05王辉董盼盼李文丽王富
王辉++董盼盼+李文丽++王富

摘要:以番茄黄化曲叶病毒病(tomato yellow leaf curf virus,简称TYLCD)抗病纯合基因型(Ty-3/Ty-3)材料A45、感病纯合基因型(ty-3/ty-3)材料A39及其构建的F2代分离群体(145个单株)为试验材料,采用接种鉴定的方法,同时进行TYLCV抗性遗传分析,比较P6-25、UF_TY3-P23、UF_TY3-P19等3个标记与Ty-3基因的连锁程度。结果显示,番茄黄化曲叶病毒病抗性遗传符合1对显性基因控制;P6-25、UF_TY3-P23、UF_TY3-P19等3个标记与抗病基因Ty-3间的遗传距离分别为15.2、14.5、10.3 cM;利用分子标记UF_TY3-P19可提高黄化曲叶病毒病抗性材料的效率。
关键词:番茄;黄化曲叶病毒病;Ty-3基因;分子标记
中图分类号: S436.412.1+9文献标志码: A
文章编号:1002-1302(2016)12-0071-03
收稿日期:2015-10-12
基金项目:山东省良种工程农业生物资源创新利用研究项目(编号:PTBR2013);青岛市民生计划(编号:13-1-3-3-nsh);山东省现代农业产业技术体系(编号:SDAIT-02-022-02);山东省自然科学基金(编号:ZR2010CM047、ZR2014CQ034);青岛农业大学高层次人才科研基金(编号:663-1115041)。
作者简介:王辉(1981—),男,山东郓城人,博士,主要从事蔬菜遗传育种及生物技術研究。E-mail:fromstick@163.com。
通信作者:王富,博士,教授,研究方向为番茄遗传育种及生物技术。E-mail:wangfuabcd@163.com。
番茄黄化曲叶病毒(tomato yellow leaf curl virus,简称TYLCV)是侵染番茄的重要病毒之一,近年来因其在番茄上的广泛流行而受到人们的关注。传统的番茄抗TYLCV育种受到时间、环境等的限制,缺乏快速的检测鉴定方法。近年来,分子标记技术辅助育种被广泛应用,相对于传统育种,分子标记辅助育种可以缩短育种周期,并且可以从分子水平找到相关抗性基因和相关位点。因此,研究挖掘利用有效的分子标记,对相关育种工作具有重要意义。
番茄抗TYLCV植株材料先后在细叶番茄(Solanum pimpinellifolium)、秘鲁番茄(Solanum peruvianum)、智利番茄(Solanum chilense)、多毛番茄(Solanum habrochaite)、契斯曼尼番茄(Solanum cheesmaniae)等野生材料中发现。抗源材料不同,其抗性遗传规律也不同。目前已发现的抗性基因主要有 Ty-1、Ty-2、Ty-3、Ty-3a、Ty-4、Ty-5[1-7]。Ty-3抗性基因最早的报道是在2007年,Ji等通过易感番茄品种7781x抗病自交系021108(Lycopersicon chilense LA2779)、易感番茄品种8248X抗病自交系034611(Lycopersicon chilense LA1932)杂交获得的F2代分离群体进行连锁分析及QTL定位分析[4],确定Ty-3抗性基因位点位于番茄6号染色体长臂的Cleg-31-P16 (20cM)、T1079 (27cM)之间。随着研究工作的开展,Ty-3基因位点被进一步精确定位,Ty-3基因被定为在标记UF_TY3-P1、UF_TY3-P23之间,约71 kb间隔内[8-9]。在最新研究中,Ty-1、Ty-3是等位基因并且同时编码1个未知功能的依赖RNA的RNA聚合酶。
本研究中,利用抗病品种A45(Ty-3/Ty-3)、感病品种A39(ty-3/ty-3)分别作为父、母本,获得F1、F2代,通过接种鉴定的方法研究抗性基因Ty-3的遗传规律,并通过2种较为成熟的分子标记方法,即稳定性较高的序列特异性扩增区(sequence characterized amplified regions,简称SCAR)标记技术和多态性较好的酶切扩增多态性序列(cleaved amplified polymorphism sequences,简称CAPS)标记技术,对该抗性基因进行分子标记检测,确定稳定性好、多态性高、不易受环境影响的分子标记,以期为抗番茄黄化曲叶病毒病育种工作奠定基础。
1材料与方法
1.1试验材料
番茄抗病纯合基因型(Ty-3/Ty-3)材料A45(P1)、感病纯合基因型(ty-3/ty-3)材料A39(P2)来源于青岛农业大学园艺学院,杂交后获得F1代,F1代自交获得F2代群体。PCR酶切试验所用试剂(限制性内切酶AluⅠ、内切酶Buffer等)购自宝生物工程(大连)有限公司(TaKaRa)。
1.2试验方法
1.2.1番茄TYLCV接种鉴定番茄材料播种育苗后,采用农杆菌接种法对番茄叶片进行TYLCV接种,接种所需的番茄黄化曲叶病毒农杆菌菌株(GV3101 pCAMBIA0390_TY-19mer)由韩国釜山大学Young-su Seo教授惠赠。根据Lapidot等的病情分级标准[10-11]发展而来的番茄黄化曲叶病毒病症鉴定标准对番茄黄化曲叶病毒病症状进行鉴定,病情2级以上为感病。
1.2.2分子标记对番茄TYLCV的抗性检测使用CTAB法提取采集的番茄叶片基因组DNA,检测质量后将浓度稀释到20 ng/μL,用于PCR检测。根据国内外相关报道[7,9],选取与抗病基因Ty-3紧密相连且表达稳定的分子标记(SCAR标记P6-25、UF_TY3-P19,CAPS标记UF_TY3-P23),用于检测番茄群体材料抗性,详见表1。
PCR反应体系:100 ng DNA,2.5 μL 10×PCR buffer,2 μL 2.5 mmol/L的dNTPs,各1.0 μL 10 μmol/L上下游引物,0.3 μL Taq聚合酶 (TaKaRa),用ddH2O补足至25 μL。PCR程序:95 ℃ 5 min;95 ℃ 1 min,55 ℃ 45 s,72 ℃ 1 min,35个循环;72 ℃延伸10 min。酶切反应体系:5 μL PCR扩增产物,1.5 μL CutSmart buffer,0.2 μL内切酶 (TaKaRa),用ddH2O补足至15 μL。酶切在PCR仪或者水浴锅中进行,于37 ℃酶切1 h。取约10 μL PCR扩增产物,在1%琼脂糖凝胶电泳上检测PCR扩增结果,用Bio-RAD自动凝胶成像系统观察照相,记录电泳结果。
2结果与分析
2.1番茄群体抗TYLCV表现型分析
在接种18 d后对P1(5株)、P2(5株)、F1(10株)、F2(145株)进行病情发病情况调查,初步观察后发现,TY抗病植株不表现病状,感病植株表现出上部新叶黄化、叶片边缘开始卷曲、叶片变小等症状。对群体植株调查后结果显示,P2植株全部表现为感病,P1、F1植株表现为抗病,F2抗病植株、感病植株比为102 ∶[KG-*3]43(2.37 ∶[KG-*3]1);通过卡方检验可知,F2群体的χ2=1.811,P值=0.178 4,表明该性状符合3 ∶[KG-*3]1的分离比例(表2)。根据孟德尔遗传规律推测,该遗传群体对于TYLCV的抗性是由显性单基因控制的。
2.2番茄群体抗TYLCV基因型分析
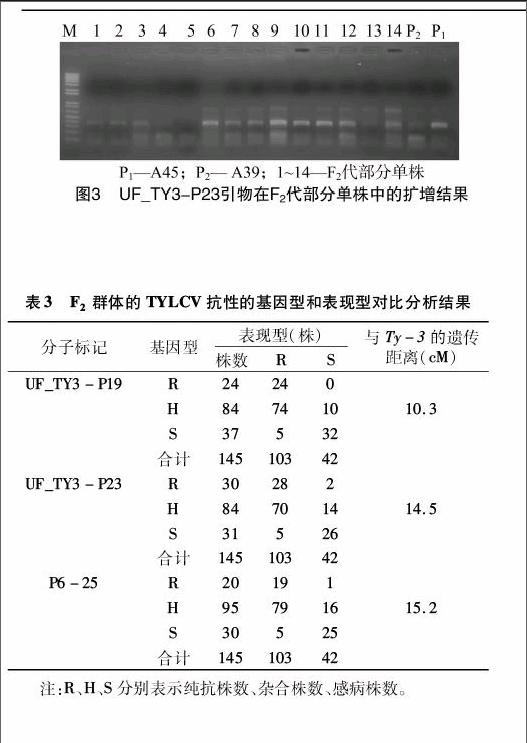
利用与Ty-3基因紧密连锁的分子标记P6-25、UF_TY3-P23、UF_TY3-P19对F2代群体的单株DNA进行PCR扩增,检测其Ty-3抗性。对PCR扩增产物电泳检测后发现,SCAR标记P6-25、UF_TY3-P19在PCR后可以清晰地区分Ty-3纯合抗病、杂合抗病、抗病,且P6-25在F2代群体的基因型比为20 ∶[KG-*3]95 ∶[KG-*3]30,UF_TY3-P19在F2代群体的基因型比为24 ∶[KG-*3]84 ∶[KG-*3]37(图1、图2);對CAPS标记 UF_TY3-P23 的PCR产物经AluⅠ酶切后发现,PCR产物在纯合抗性材料中,无法酶切,只有1个特异性片段,感病材料被酶切成2个特异性片段,UF_TY3-P23在F2代群体的基因型比为 30 ∶[KG-*3]84 ∶[KG-*3]31(图3)。
2.3番茄群体抗TYLCV基因型与表型对比分析
[CM(24]145株F2代植株通过与Ty-3紧密连锁的分子标记进[CM)]
[FK(W8][TPWH3.tif]
行抗性检测,如果将分子标记检测的杂合抗性材料视为抗病植株,综合接种鉴定后结果对比分析表明,3个分子标记与Ty-3存在一定的遗传距离(表3)。通过对F2代群体的遗传分析发现,标记P6-25、UF_TY3-P23、UF_TY3-P19与番茄抗黄化曲叶病基因的Ty-3间的连锁距离分别是15.2、145、10.1 cM;标记UF_TY3-P23、UF_TY3-P19比P6-25更靠近Ty-3,因此可以推测,在检测番茄Ty-3抗性结果[JP3]时,标记UF_TY3-P19比UF_TY3-P23、P6-25更具有准确性。
3小结与讨论
番茄TYLCV抗性育种,离不开抗病性鉴定。本试验的TYLCV抗病性鉴定采用农杆菌注射法,在番茄苗期进行简单快速的鉴定。与嫁接法、烟粉虱传毒等方法相比,本方法简单易行,不受季节、烟粉虱密度、植株材料等因素的影响[12],但是保证该方法顺利进行的前提是准备TYLCV克隆的农杆菌菌种,而对TYLCV进行克隆转化需要大量的时间。另外,对含有TYLCV的农杆菌接种时,除了本试验中采取压力法通过不带针头的注射器将接种液压入番茄叶片背面,还可以利用带针头的注射器在番茄植株近根处的韧皮部部位进行注射接种[13],但是直接注射的接种液量少,不如压力法接种充分。
在对接种TYLCV植株进行病情鉴定时,通过植株的症状
表现来确定是否染毒,不表现TYLCV症状的植株是抗性植株。由于目测症状具有一定的不确定性。因此,在本试验中检测的分子标记与抗性基因的遗传距离,与前人研究有一定差异。其主要原因为本试验将Ty-3基因进一步定位,进一步完善了Ji等的研究[7-9];另外,本研究只对145株F2代群体进行研究,样品数量不够大,接种后番茄植株是采取生物学鉴定的方法进行病情调查的,此方法简单快捷,但是容易受到个人主观感觉的干扰,也有可能影响接种鉴定结果。
本研究使用的标记(P6-25、UF_TY3-P23、UF_TY3-P19)与Ty-3基因均存在一定的遗传距离,但与P6-25相比,UF_TY3-P23、UF_TY3-P19这2个标记与Ty-3间存在更紧密的连锁关系,因此这2个标记,尤其是UF_TY3-P19用于筛选抗TYLCV的番茄种质资源效率更高。
[HS2][HT8.5H]参考文献:[HT8.SS]
[1][ZK(#]Zamir D,Ekstein-Michelson I,Zakay Y,et al. Mapping and introgression of a tomato yellow leaf curl virus tolerance gene,TY-1[J]. Theoretical and Applied Genetics,1994,88(2):141-146.
[2]Yang X H,Caro M,Hutton S F,et al. Fine mapping of the tomato yellow leaf curl virus resistance gene Ty-2,on chromosome 11 of tomato[J]. Molecular Breeding,2014,34(2):749-760.
[3]Ji Y F,Scott J W,Schuster D J. Toward fine mapping of the tomato yellow leaf curl virus resistance gene Ty-2 on chromosome 11 of tomato[J]. HortScience,2009,44(3):614-618.
[4]Ji Y F,Schuster D J,Scott J W. Ty-3,a begomovirus resistance locus near the Tomato yellow leaf curl virus resistance locus Ty-1 on chromosome 6 of tomato[J]. Molecular Breeding,2007,20(3):271-284.
[5]Ji Y F,Scott J W,Schuster D J,et al. Molecular mapping of Ty-4,a new tomato yellow leaf curl virus resistance locus on chromosome 3 of tomato[J]. Journal of the American Society for Horticultural Science,2009,134(2):281-288.
[6]Liana A,Reuveni M,Azari R. Molecular dissection of tomato lear curl virus resistance in tomato line TYl72 derived from Solasum peruvianum[J]. Theoretical and Applied Genetics,2009,119:519-530.
[7]Ji Y,Betteray B V,Smeets J,et al. Co-dominant SCAR Marker,P6-25,for detection of Ty-3,Ty-3a,and Ty-3b introgressions from three solanum chilense accessions at 25 cM of chromosome6 of begomovirus-resistant tomatoes[J/OL].[2015-10-10].http://www.plantpath.wisc.edu/geminivirus resistant tomatoes/markers/MAS-protocols/P6-25-locus.Pdf.
[8]Verlaan M G,Szinay D,Hutton S F,et al. Chromosomal rearrangements between tomato and Solaum chilense hamper mapping and breeding of the TYLCV resistance gene Ty-1[J].The Plant Journl,2011,68:1093-1103.
[9]Verlaan M G,Hutton S F,Ibrahem R M,et al. The tomato yellow leaf curl virus resistance genes Ty-1 and Ty-3 are allelic and code for DFDGD-class RNA-dependent RNA polymerases[J]. PLoS Genetics,2013,9(3):178-179.
[10][ZK(#]Lapidot M,Weil G,Cohen L,et al. Biolistic inoculation of plants with tomato yellow leaf curl virus DNA[J]. Journal of Virological Methods,2007,144(1/2):143-148.
[11]Lapidot M,Ben-Joseph R,Cohen L,et al. Development of a scale for evaluation of tomato yellow leaf curl virus resistance level in tomato plants[J]. Phytopathology,2006,96(12):1404-1408.
[12]Picó B,Ferriol M,Díez M J,et al. Agroinoculation methods to screen wild Lycopersicon for resistance to tomato yellow leaf curl virus[J]. Journal of Plant Pathology,2001,83(3):215-220.
[13]楊玛丽,彭宏,陈天子,等. RNAi介导的转基因番茄抗TYLCV研究[J]. 西南农业学报,2014,27(6):2511-2516.
