超声造影在肿瘤化疗模型中诊断价值的初步探索
2017-04-03周世崇范亦武
周世崇,常 才,乐 坚,范亦武,陈 敏
复旦大学附属肿瘤医院超声诊断科,复旦大学上海医学院肿瘤学系,上海 200032
目前,国内女性恶性肿瘤中乳腺癌发病率居第1位[1]。新辅助化疗在其治疗中应用日益广泛[2],但疗效评估仍依赖最终病理分级。现有影像学技术可监测肿瘤在化疗前后的大小变化,但无法在化疗早期预测最终疗效[3-4]。现有研究显示,肿瘤可促进大量新生血管产生,这是其生长、侵袭和转移的基础[5]。超声造影剂具有纯血池灌注特性,本研究拟通过超声造影观察化疗前后肿瘤血供改变,以达到早期预测化疗疗效的目的。
1 资料和方法
1.1 研究对象
实验动物为无特定病原体(specific pathogen free,SPF)级BALB/c裸鼠,雌性,4周龄。人乳腺癌细胞株MCF-7来自复旦大学附属肿瘤医院中心实验室。取对数生长期细胞,制成密度约为2×107/mL的细胞悬液。于每只裸鼠右侧胸壁乳垫下注射接种0.3 mL细胞悬液,诱导裸鼠产生乳腺癌。接种后连续观察1周,以接种部位皮下出现肿瘤结节、质地较硬等指标认为成瘤。4周后,瘤体长至直径约2.0 cm时进一步实验。
将荷瘤裸鼠按完全随机法分成实验组和对照组,每组30只。每组再按给药时间点分成3个亚组,每个亚组10只。化疗前组:不给药,第1天给药前处死。化疗1次组:第1天给药,第7天第2次给药前处死。化疗2次组:第1、7天贯序给药,第14天处死。各亚组小鼠于处死前称量体质量,测量肿瘤长径及短径,肿瘤体积换算公式=长径×短径2/2。
1.2 化疗方案
实验组给药方案C M F:环磷酰胺(cyclophosphamide,C)+甲氨蝶呤(methotrexate,M)+氟尿嘧啶(fluorouracil,F)。给药剂量严格依据Lloyd等的实验设计[6],单药剂量为2/3 LD10。各药LD10剂量具体如下[7-9]:环磷酰胺100 mg/kg,甲氨蝶呤27 mg/kg,氟尿嘧啶140 mg/kg。模拟临床给药方案CMF。在实验组亚组给药的同时,相应对照组亚组给予生理盐水,均为腹腔注射。
1.3 仪器与方法
全部实验动物于处死前进行超声造影检查。使用意大利Esaote公司MyLab90多普勒彩色超声诊断仪,探头频率8~12 MHz。超声造影剂为意大利Bracco公司SonoVue,每只裸鼠通过尾静脉注射0.005 mL。注射后立即进行造影观察,记录数据。造影结束后于探头下置入定位针,确定观察区域。采用德国TomTec公司分析软件SonoLiver脱机分析造影数据,获取以下造影参数:肿瘤灌注峰值强度(maximum intensity,IMAX),即造影剂灌注达峰时对比对照区域的强度值;上升时间(rising time,RT),即灌注从峰值10%至90%强度所需时间;灌注达峰时间(time to peak,TTP),即从开始灌注至达峰所需时间;平均渡越时间(mean transit time,mTT),即病灶峰值强度下降一半所需时间。
全部裸鼠于置入定位针后脱颈处死,沿探头方向剖开瘤体,取定位针所在厚度约5 mm、长度包含全部造影瘤体的组织,固定后石蜡包埋切片。检测微血管密度(microvascular density,MVD),血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)-1/2/3。将实验组中化疗前亚组和2次化疗亚组的肿瘤标本切片,于光学高倍镜下进行肿瘤细胞计数。
1.4 统计学处理
2 结 果
2.1 肿瘤物理指标
肿瘤生物指标包括荷瘤裸鼠体质量、肿瘤体积(表1)。第1次给药后:体质量组间对照(P=0.000)和组内对照(P=0.000)差异均有统计学意义;肿瘤体积组间对照(P=0.000)差异有统计学意义,组内对照(P=0.539)差异无统计学意义。第2次给药后:体质量组间对照(P=0.000)和组内对照(P=0.000)差异均有统计学意义;肿瘤体积组间对照(P=0.000)差异有统计学意义,组内对照(P=0.46)差异无统计学意义。
2.2 肿瘤微循环指标
微循环指标包括MVD、VEGFR-1/2/3(表2)。第1次给药后:MVD组间对照(P=0.138)和VEGFR-3组间对照(P=0.069)差异无统计学意义,组内对照(P=0.205)差异无统计学意义;VEGFR-1组间对照(P=0.008)显著下降,VEGFR-1组内对照(P=0.007)显著下降。第2次给药后:MVD组间对照(P=0.000)和VEGFR-3组间对照(P=0.003)显著下降,MVD组内对照(P=0.004)显著下降;VEGFR-1组间对照(P=0.000)显著下降,VEGFR-1组内对照(P=0.000)显著下降。镜下切片见图1~2。
2.3 超声造影指标
超声造影指标包括IMAX、RT、TTP和mTT(表3)。第1次给药后:IMAX组间对照(P=0.001)和组内对照(P=0.000)显著下降;TTP组间对照(P=0.427)和组内对照(P=0.376)差异无统计学意义。第2次给药后:IMAX组间对照(P=0.000)和组内对照(P=0.000)显著下降;TTP组间对照(P=0.001)和组内对照(P=0.001)显著上升。超声造影见图3~5。

表 1 肿瘤生物指标
2.4 病理结果
在光学显微镜40倍物镜下计数,化疗前实验组肿瘤细胞密度为464.92±60.85/HF,2次化疗后实验组肿瘤细胞密度为136.99±17.3/HF,化疗后肿瘤细胞显著减少(P=0.000)。

表 2 肿瘤微循环指标
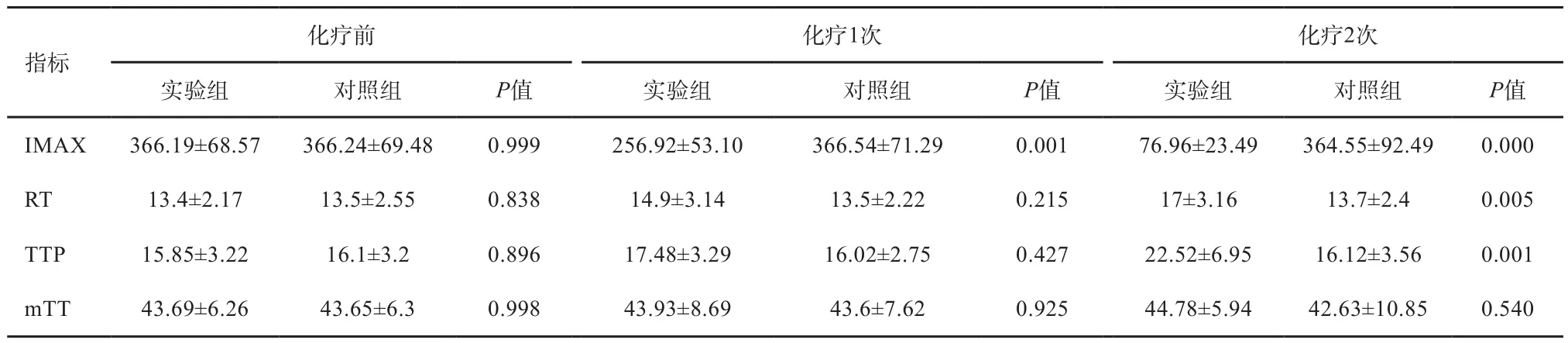
表 3 超声造影参数
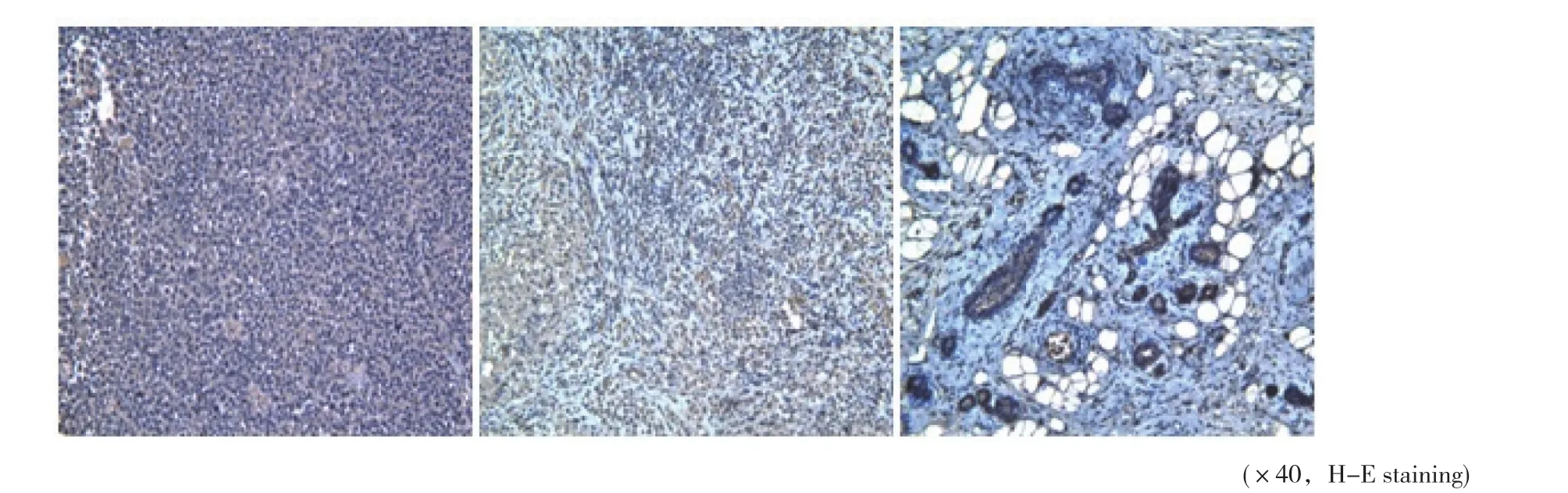
图 1 实验组化疗前、化疗1次、化疗2次的MVD镜下切片
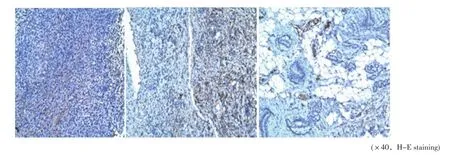
图 2 实验组化疗前、化疗1次、化疗2次的VEGFR-1镜下切片

图 3 化疗前肿瘤超声造影图
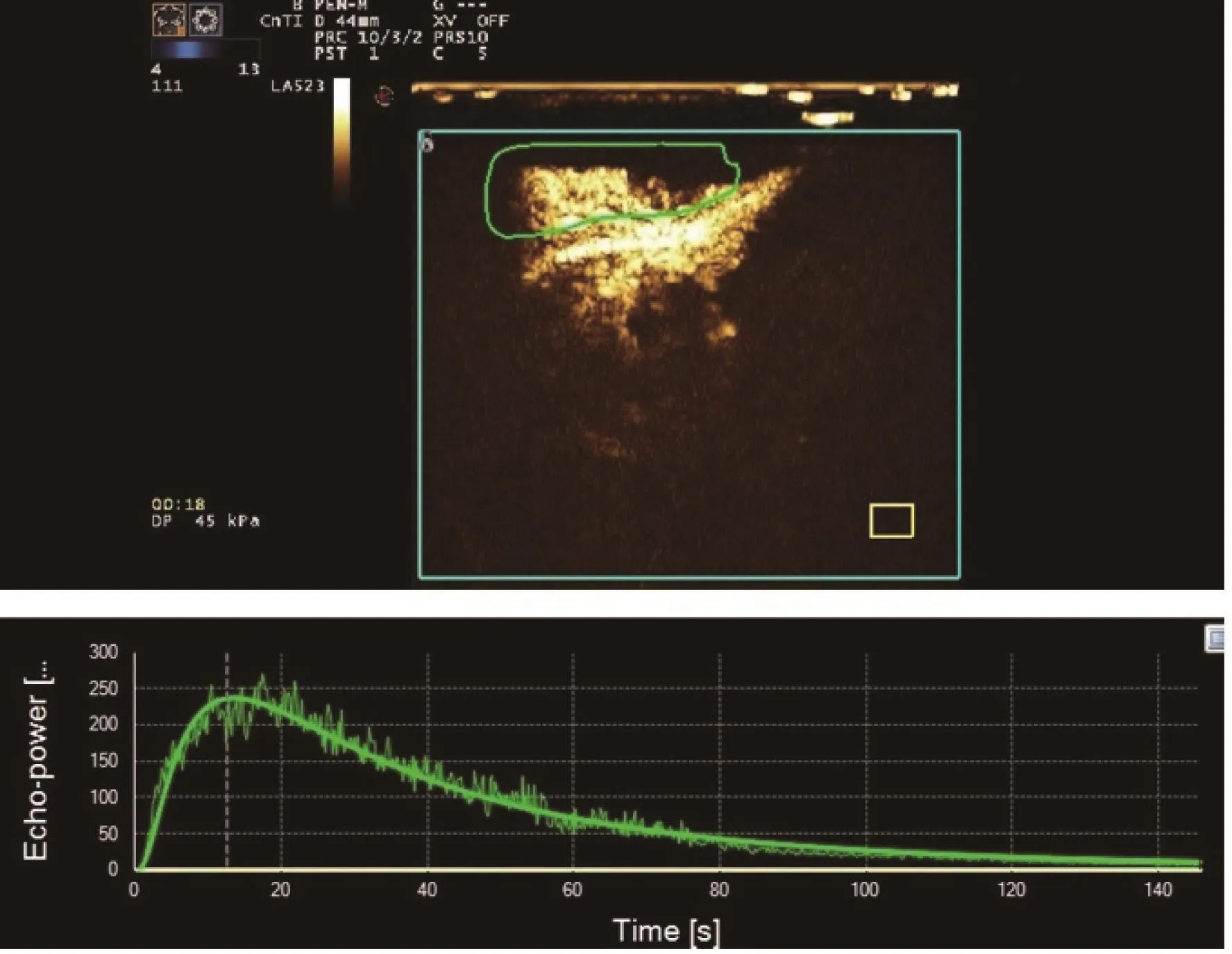
图 4 化疗1次后的肿瘤超声造影图
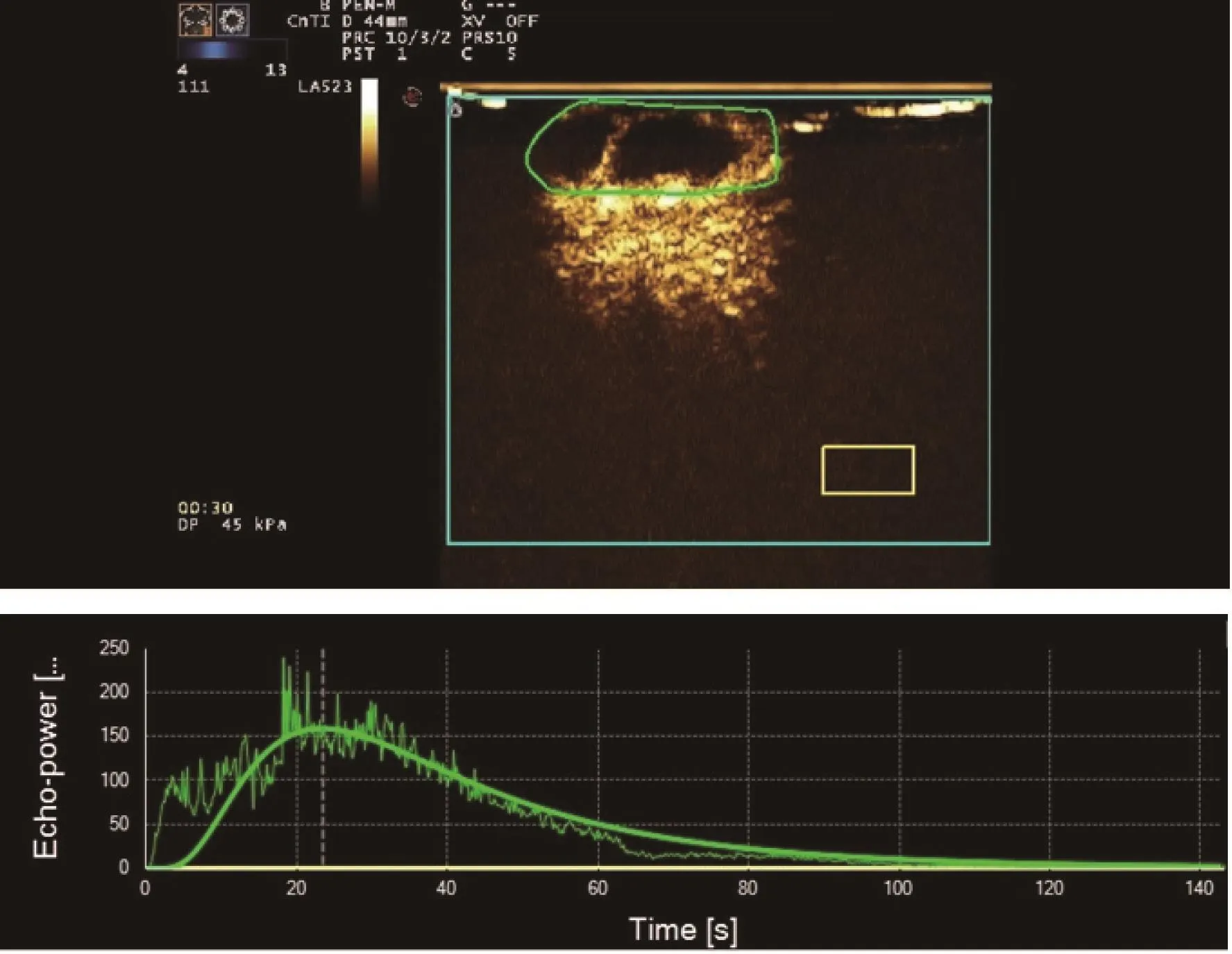
图 5 化疗2次后的肿瘤超声造影图像
3 讨 论
目前,超声造影预测抗血管生成药物疗效的研究比较多。有研究报道[10-14],在动物肿瘤模型中使用抗血管生成药物,伴随着肿瘤微循环指标降低,超声造影参数出现不同程度的改变,部分研究认为超声造影参数与抗血管疗效相关。然而,临床使用的大部分化疗药物主要通过抑制肿瘤细胞DNA和RNA合成来抑制肿瘤生长,作用机制不同于抗血管药物。有研究报道[15-16],超声造影在新辅助化疗前后曲线有显著变化,但缺乏足够的量化参数。有研究报道[17-19],单独使用化疗药物如顺铂或阿霉素,可观察到肿瘤的微循环指标改变,且伴有超声造影参数变化,但他们没有研究早期变化与肿瘤化疗疗效的关系。本研究模拟临床联合化疗方案,探讨用药后肿瘤微循环指标的改变及超声造影指标的改变,并分析两者的关系。
本研究中,MVD在第2次化疗后的组内和组间出现显著下降,与既往报道[17-19]吻合。进一步研究发现,VEGFR-1在首次化疗后组内和组间即出现显著下降,提示作为微循环指标,其可能比MVD对化疗药物更敏感。2次化疗后,肿瘤细胞下降70%以上,按病理MP分级,属不完全缓解中的3级。浸润癌细胞的降低达30%~90%,属中度减少。由此可见,肿瘤细胞被化疗灭活的同时,出现了显著微循环改变。
第2次化疗后TTP在组间和组内均显著上升,提示肿瘤灭活后灌注时间延长,很可能是微循环受到破坏所致。对比病理结果,肿瘤体积在2次化疗后较化疗前未出现显著变化,而部分微循环指标和部分造影指标出现显著变化,两者具有一致性,均早于肿瘤物理体积的变化。
在乳腺癌新辅助化疗模型中,超声造影部分指标变化与肿瘤微循环指标变化具有一致性,均早于肿瘤物理体积变化。虽然尚未证实两者相关,但值得进一步深入研究。
本研究存在以下不足:样本量相对较小,无法进行相关性分析;仅模拟了一种新辅助化疗方案;MCF-7细胞也不能体现乳腺癌免疫组化和基因分型的多样性。
综上所述,超声造影参数IMAX和TTP在化疗过程中,与肿瘤微循环指标MVD和VEGFR-1的变化具有一致性,提示超声造影具备了预测新辅助化疗疗效的潜力。
[1] CHEN W Q, ZHENG R S, ZENG H M, et al. Annual report on status of cancer in China, 2011 [J]. Chin J Cancer Res, 2015, 27: 2-12.
[2] 宗瑜, 吴佳毅, 深坤炜. 乳腺癌新辅助治疗的国际共识与解读 [J]. 中华外科杂志, 2013, 51: 10-13.
[3] KEUNE J D, JEFFE D B, SCHOOTMAN M, et al. Accuracy of ultrasonography and mammography in predicting pathologic response after neoadjuvant chemotherapy for breast cancer [J]. Am J Surg, 2010, 199:477-484.
[4] MARINOVICH M L, SARDANELLI F, CIATTO S, et al. Early prediction of pathologic response to neoadjuvant therapy in breast cancer: systematic review of the accuracy of MRI [J]. Breast, 2012, 21: 669-677.
[5] WEIDNER N. The importance of tumor angiogenesis:the evidence continues to grow [J]. Am J Clin Pathol,2004, 122: 675-677.
[6] LLOYD H H. Combination chemotherapy: considerations for design and analysis [J]. Cancer Chemother Rep, 1974,4: 157-165.
[7] LINDÉN C J. Toxicity of intraperitoneally administered antitumour drugs in athymic rats [J]. In Vivo, 1989, 3:259-262.
[8] INABA M, KOBAYASHI T, TASHIRO T, et al.Evaluation of antitumor activity in a human breast tumor/nude mouse model with a special emphasis on treatment dose [J]. Cancer, 1989, 64: 1577-82.
[9] SEIGERS R, LOOS M, VAN TELLINGEN O, et al. Cognitive impact of cytotoxic agents in mice [J].Psychopharmacology (Berl), 2015, 232: c17-c37.
[10] FORSBERG F, RO R J, FOX T B, et al. Contrast enhanced maximum intensity projection ultrasound imaging for assessing angiogenesis in murine glioma and breast tumor models: A comparative study [J]. Ultrasonics,2011, 51: c382-c389.
[11] ZHU X D, ZHANG J B, FAN P L, et al. Antiangiogenic effects of pazopanib in xenograft hepatocellular carcinoma models: evaluation by quantitative contrast-enhanced ultrasonography [J]. BMC Cancer, 2011, 11: 28.
[12] SESHADRI M, SACADURA N T, COULTHARD T.Monitoring antivascular therapy in head and neck cancer xenografts using contrast-enhanced MR and US imaging[J]. Angiogenesis, 2011, 14: 491-501.
[13] 王志会, 胡向东, 钱学林. 人肝癌裸鼠模型的超声造影峰值强度与血管生成关系的研究 [J]. 中国超声医学杂志, 2012, 28: 1060-1062.
[14] RIX A, LEDERLE W, SIEPMANN M, et al. Evaluation of high frequency ultrasound methods and contrast agents for characterising tumor response to anti-angiogenic treatment [J]. Eur J Radiol, 2012, 81: 2710-2716.
[15] PYSZ M A, GURACAR I, FOYGEL K, et al.Quantitative assessment of tumor angiogenesis using realtime motion-compensated contrast-enhanced ultrasound imaging [J]. Angiogenesis, 2012, 15: 433-442.
[16] 赵丽, 周晓东, 于铭, 等. 超声及超声造影技术对乳腺癌新辅助化疗的疗效评价 [J]. 中国超声医学杂志, 2010,26: 702-704.
[17] CAO X, XUE J, ZHAO B. Potential application value of contrast-enhanced ultrasound in neoadjuvant chemotherapy of breast cancer [J]. Ultrasound Med Biol,2012, 38: 2065-2071.
[18] WANG J W, CAO L H, HAN F, et al. Contrastenhanced US quantitatively detects changes of tumor perfusion in a murine breast cancer model during adriamycin chemotherapy [J]. Acta Radiol, 2013, 54:882-888.
[19] WANG J W, ZHENG W, CHEN Y, et al. Quantitative assessment of tumor blood flow changes in a murine breast cancer model after adriamycin chemotherapy using contrast-enhanced destruction-replenishment sonography[J]. J Ultrasound Med, 2013, 32: 683-690.
