18F-FDG PET/CT在恶性胸膜间皮瘤与胸膜转移性腺癌鉴别诊断中的价值
2017-04-03张晓莹毛旻航
张晓莹,黄 平,孙 震,毛旻航,陈 涛
1.上海中医药大学附属曙光医院核医学科,上海 201203;
2.上海交通大学附属胸科医院胸外科,上海 200052
恶性胸膜间皮瘤(malignant pleural mesothelioma,MPM)是一种罕见的高侵袭性肿瘤,近年发病率逐渐升高,通常以原因不明胸痛、胸膜增厚和胸腔积液为主要临床表现,目前通过常规影像学检查方法(X线平片、CT及MRI等)对其诊断有一定局限性[1-2]。18F-FDG PET/CT由于在肿瘤影像学诊断中的高灵敏度,可能在MPM与胸膜转移性腺癌鉴别诊断中具有特殊价值,但目前报道较少。本研究收集经病理证实的MPM和胸膜转移性腺癌患者各20例,寻找两者鉴别的关键点。
1 资料和方法
1.1 临床资料
回顾性分析2009年7月—2016年6月因原因不明胸痛、胸膜增厚、胸腔积液入院,后经上海交通大学附属胸科医院病理学确诊的20例MPM患者及同期住院的20例胸膜转移性腺癌患者的18F-FDG PET/CT图像。MPM患者中,男性18例,女性2例,年龄39~76岁,平均年龄(55.5±5.5)岁。病灶位于右侧胸膜6例(30%),左侧14例(70%)。经开胸手术后病理证实者8例,经胸腔镜取材活检证实者4例,胸腔积液引流包埋证实者3例,CT引导下经皮胸膜穿刺活检证实者5例。H-E染色和免疫组织化学染色镜下将MPM分为3型:上皮样型、肉瘤样型和双相型,其中2例有石棉接触史。胸膜转移性腺癌患者20例,其中,男性9例,女性11例,年龄37~75岁,平均年龄(63.4±9.0)岁。病灶位于右侧胸膜12例(60%),左侧8例(40%)。经支气管镜淋巴结穿刺活检证实者3例,经胸腔镜取材活检证实者4例,胸腔积液引流包埋证实者9例,CT引导下经皮胸膜穿刺活检证实者4例。临床表现:胸闷、胸痛、呼吸困难、咳嗽、消瘦、乏力及发热等,病程1周至2个月。
1.2 18F-FDG PET/CT扫描
采用美国GE Discovery DST 16 PET/CT仪。检查前至少禁食6 h,血糖小于6.1 mmol/L,按体质量3.70~5.55 MBq/kg静脉注射显像剂18F-FDG(购自上海原子科兴药业有限公司),放化纯大于95%。静息60 min后采集图像,先采集CT图像,扫描范围自颅底至股骨上段。扫描参数:电压120 kV,电流140 mA,准直5.0 mm,层厚0.75 mm,0.5 ms/转,螺距1.25。在同一范围内用3D模式采集PET图像,采集时间2.5 min/床位,共采集5个床位。计算机系统采用CT数据进行衰减校正,OSEM重建图像,自动完成PET/CT融合投影图像。
1.3 图像分析
由两名副主任医师以上高年资影像诊断科医师独立阅片,分别记录病灶位置、胸膜FDG积聚形态类型、病变累及范围、胸腔积液量、肺门和(或)纵隔淋巴结转移、胸壁和肋骨受累及远处转移等。胸膜FDG积聚形态类型依据放射性浓聚程度及分布形态分为结节型、肿块型及不规则环形。结节型表现为不同程度的不规则胸膜增厚,厚度小于3 cm;肿块型表现为以胸膜为基底的软组织肿块,厚度大于等于3 cm;不规则环形表现为胸膜增厚累及整个一侧胸腔,包括纵隔胸膜反折部。胸膜腔积液占据一侧胸腔的1/3以下者为少量积液,占据一侧胸腔1/3及以上者为中大量积液。依据国际间皮瘤学会(International Mesothelioma Interest Group,IMIG)制定的TNM分期[1]判定间皮瘤TNM临床分期,达成一致后记录。
1.4 统计学处理
2 结 果
2.1 18F-FDG PET/CT影像学表现、胸膜FDG积聚形态类型及其他伴随征象比较
比较两组胸腔积液,MPM组胸腔积液多为无或少量(70%),且多分布在左侧胸腔中(70%),而胸膜转移性腺癌组中,胸腔积液的量和分布部位没有明显区别。胸膜FDG积聚形态类型中,仅病变累及纵隔胸膜征象两组间差异有统计学意义(P<0.05),不规则环形积聚、结节型积聚、肿块型积聚、病变累及叶间裂胸膜、病变累及横膈胸膜两组间差异均无统计学意义(P>0.05)。MPM组SUVmax为6.8±1.2,胸膜转移性腺癌组为7.5±2.6,两组差异无统计学意义(F=1.084,P=0.112),其他伴随征象比较,两组差异无统计学意义(表1~3,图1~6)。

表 1 两组胸腔积液比较[n(%)]

表 2 两组胸膜FDG积聚形态类型比较[n(%)]

表 3 两组其他伴随征象比较[n(%)]

图 1 患者,女性,59岁,右侧胸膜FDG积聚呈不规则环形,胸腔镜胸膜活检证实为右侧MPM
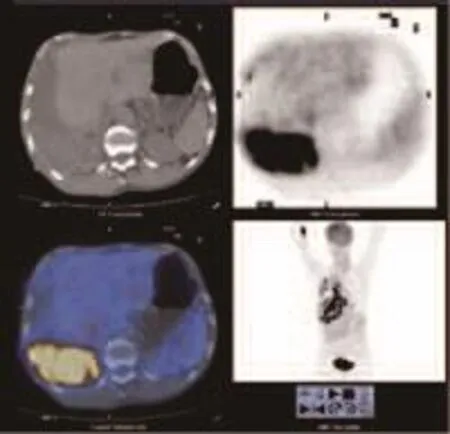
图 2 患者,男性,63岁,右侧胸膜FDG积聚呈肿块型,右侧少量胸腔积液,经皮右侧胸膜穿刺活检证实为右侧MPM
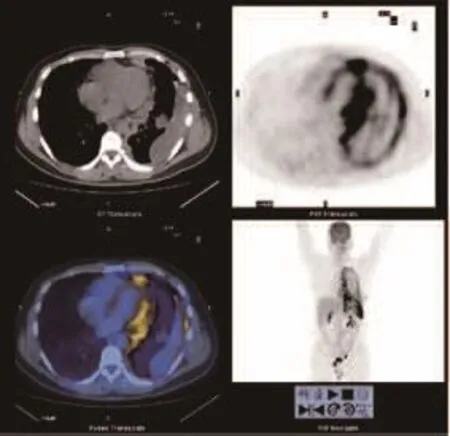
图 3 患者,男性,42岁,左侧胸膜FDG积聚伴纵隔胸膜累及,心包侵犯,经皮左侧胸膜穿刺活检证实为MPM

图 4 患者,男性,47岁,右侧胸膜FDG积聚呈结节型,累及叶间胸膜,胸腔积液引流包埋证实右侧胸膜转移性腺癌,原发灶不明

图 5 患者,女性,75岁,左侧少量胸腔积液,双侧肺门和纵隔隆突下淋巴结肿大伴FDG积聚,经纤维支气管镜淋巴结穿刺活检,4R淋巴结组织块:低分化非小细胞癌,结合酶标,符合腺癌,原发病灶为左肺下叶周围型肺癌

图 6 患者,男性,46岁,左侧胸膜FDG积聚呈肿块型,邻近胸壁和肋骨侵犯,胸腔镜胸膜活检证实为左侧MPM
2.2 临床TNM分期
MPM组中,Ⅰ~Ⅱ期12例(60%),Ⅲ~Ⅳ期8例(40%)。
3 讨 论
MPM是一种高侵袭性肿瘤,曾被认为非常罕见,占全部肿瘤的0.02%~0.40%。近年来,其发病率有上升趋势[3]。石棉暴露是导致MPM发病的主要因素,其他潜在致病因素或协同因素包括:暴露于其他天然纤维(毛沸石和氟浅闪石)或人造纤维、电离辐射和猿猴空泡病毒40等。遗传因素可增加MPM的易感性,可能有助于MPM的发生,与家族性间皮瘤有关。MPM患者多为男性,本组20例中18例为男性(90%),且男性比女性发病年龄轻。该病起病隐匿,早期缺乏特异症状,特别是以大量胸腔积液初诊时,不易与胸膜转移性腺癌、结核性胸膜炎及特异性炎性反应导致的脓胸相鉴别。胸腔积液细胞学检查和胸膜活检标本的H-E染色鉴别MPM和胸膜转移性腺癌较为困难,常需结合免疫组织化学染色以确定诊断。在临床工作中,最为常见的是MPM与肺、卵巢、乳腺、前列腺和肾脏胸膜转移性腺癌的鉴别诊断,因此准确鉴别两者对指导治疗和预后有重要意义。
MPM的常规影像学(X线平片、CT及MRI)表现虽有一定特点,如弥漫性胸膜增厚伴局限性胸膜结节(92%)、下胸壁多见伴胸膜增厚(82%)等[4],但缺乏诊断特异性。虽然Leung等[5]认为MPM和胸膜转移性腺癌在影像、甚至在病理上的鉴别都是困难的,但Yilmaz等[6]在一项对155例良恶性胸膜疾病的CT鉴别诊断的研究中发现,MPM环状胸膜增厚、胸膜增厚大于1 cm、纵隔胸膜受累、有胸膜斑、病侧肺容积小及胸壁受累等方面的检出率较胸膜转移性腺癌明显增多,而规则的胸膜增厚、纵隔和(或)肺门淋巴结肿大、两侧胸膜受累等的检出率则以胸膜转移性腺癌居多,上述不同的表现有助于两者的鉴别。Metintas等[7]在对99例MPM和39例胸膜转移性腺癌CT表现的多元分析中也发现,环状胸膜增厚、纵隔胸膜增厚和胸膜增厚大于1 cm,在两者的鉴别中都是独立的表现,认为如果出现一个或多个上述表现时,MPM的可能性很大。
PET/CT能较为敏感地探测到肿瘤细胞代谢的改变,获得肿瘤组织的SUV,并提供病变解剖成像的精确定位,能有效提供对MPM的“定位”、“定性”、“定量”及“定期”诊断,显著提高疾病诊断的准确率。18F-FDG PET/CT是一种分子显像技术,能清楚、直观地判断是肺实质病变还是胸膜病变,是否存在胸膜结节或肿块,邻近结构是否侵犯,是否有淋巴结及远处转移等。即使有大量胸腔积液,仍能很好地显示胸膜结节或肿块的形态。本研究观察到MPM组胸腔积液多为无或少量(70%),且多分布在左侧胸腔中(70%),而胸膜转移性腺癌组中,胸腔积液的量和分布部位没有明显区别:无或少量胸腔积占55%,中量至大量占45%;分布于右侧胸腔占60%,左侧胸腔占40%。胸膜FDG积聚形态类型中,仅病变累及纵隔胸膜这项征象两组间差异有统计学意义(P<0.05),说明其是鉴别MPM和胸膜转移性腺癌较为特异性的表现,当病变累及纵隔胸膜时要高度怀疑MPM的可能,而弥漫不规则胸膜环形增厚伴局限结节或肿块,病变累及叶间胸膜及横膈胸膜等征象在两组中均可出现,特别是显示肿瘤代谢活性的FDG摄取浓聚程度的胸膜SUVmax在MPM组中浓聚较高,同时在胸膜转移性腺癌组中通常也较高,且胸膜转移性腺癌的浓聚程度随原发病变的不同,SUVmax数值差异较大。本研究中两组间SUVmax差异无统计学意义(P>0.05),不能作为鉴别诊断MPM和胸膜转移性腺癌的指标。
18F-FDG PET/CT 能准确判断胸腔内病变范围和肿瘤可切除性,在探测胸腔内淋巴结转移,准确预测或确定是否存在代谢活性的胸外侵犯、全身转移及复发等方面具有明显优势[8]。本研究发现,心包、胸壁和肋骨侵犯,同侧胸廓体积缩小在MPM组中的发生率高,两组间差异有统计学意义(P<0.05),而肺门和纵隔淋巴结转移在胸膜转移性腺癌组中的发生率高,同侧胸廓体积不缩小有时因合并大量胸腔积液反而扩大。18F-FDG PET/CT诊断从这几方面表现加以分析,能够对MPM和胸膜转移性腺癌鉴别诊断提供更多帮助。因本研究的患者数较少,仍需在今后工作中不断完善。
18F-FDG PET/CT是鉴别恶性胸膜病变高度准确和可靠的无创检查,诊断MPM的灵敏度和特异度分别为88.2%和92.9%,也可用于发现胸外病灶及远处转移,因此在肿瘤分期中具有重要意义[9]。PET/CT多平面重建可更清楚直观地显示纵隔胸膜、叶间裂胸膜和横膈胸膜受累情况。其扫描范围大,为功能性影像,显示生物体肿瘤活性代谢情况,术前结合PET/CT病变的高代谢部位/范围及其他影像学检查,有助于准确判断手术的范围和程度,对肿瘤TNM分期判断更准确[10-11]。MPM的临床分期目前多采用IMIG制定的TNM分期[1]。该分期是在国际抗癌联盟TNM分期基础上的经验性改良,对于肿瘤T分期和淋巴结侵犯的描述更为详尽科学。基于总结以前所有的大宗临床回顾性资料,在一定程度上联系了患者的远期预后和生存率,标准更为客观[12]。本研究MPM组中,Ⅰ~Ⅱ期占60%,Ⅲ~Ⅳ期占40%,提示发现病变时通常以胸膜不同形态改变为主,双肺转移、心包、胸壁和肋骨侵犯,远处转移发生较晚。而在18F-FDG PET/CT全身检查中也能发现双肺、卵巢、乳腺、前列腺或肾脏等胸膜转移性腺癌的原发病灶,从而对两者加以鉴别。
总之,MPM是一种发病率逐年上升的恶性肿瘤,预后较差,与胸膜转移性腺癌在临床表现和影像征象上有交叉,常规影像学检查鉴别诊断困难。18F-FDG PET/CT从胸膜FDG积聚形态类型、全身伴随征象等方面可较独特地进一步明确诊断,并对MPM进行精准全面临床TNM分期,从而在治疗和预后中发挥越来越重要的指导作用。
[1] EIBEL R, TUENGERTHAL S, SCHOENBERG S O. The role of new imaging techniques in diagnosis and staging of malignant pleural mesothelioma [J]. Curr Opin Oncol, 2003, 15(2): 131-138.
[2] WANG Z J, REDDY G P, GOTWAY M B, et al.Malignant pleural mesothelioma: evalution with CT, MR imaging, and PET [J]. Radiographics, 2004; 24(1): 105-119.
[3] ROBINSON B W, MUSK A W, LAKE R A. Malignant mesothelioma [J]. Lancet, 2005, 366: 397-408.
[4] FLORES R M, AKHURST T, GONEN M, et al.Positron emission tomography defines metastatic disease but not locoregional disease in patients with malignant pleural mesothelioma [J]. J Thorac Cardioasc Surg, 2003,126(1): 11-16.
[5] LEUNG A N, MULLEU N L, MILLER R R. CT in differential diagnosis of diffuse pleural disease [J]. AJR Am J Roentgenol, 1990, 154(3): 487-489.
[6] YILMAZ U, POLAT G, SAHIN N, et al. CT in differential diagnosis of benign and malignant pleural disease [J]. Monakli Arch Chest Dis, 2005, 63(1): 17-20.
[7] METINTAS M, UEGUN I, ELBEK O, et al. Computed tomography features in malignant pleural mesothelioma and other commonly seen pleural diseases [J]. Eur J Radiol, 2002, 41(1): 1-5.
[8] 李前伟.18F-FDG PET在恶性胸膜间皮瘤中的应用 [J].实用肿瘤杂志, 2005, 20(5): 461-464.
[9] ROHREN E M, TURKINGTON T G, COLEMAN R E. Clinical applications of PET in oncology [J].Radiology, 2004, 231(2): 305-332.
[10] TRUONG M T, MAROM E M, ERASMUS J J.Preoperative evaluation of patients with malignant pleural mesothelioma: role of integrated PET-CT imaging [J]. J Thorac Imaging, 2006, 21(2): 146-153.
[11] MEIGNAN M, PAONE G. 18-Fluoro-deoxy-glucose(18FDG) positron emission tomography (PET) for the evalution of malignant pleural disease [J]. Rev Pneumol Clin, 2006, 62(2): 128-134.
[12] AELONY Y. Staging in malignant mesothelioma [J]. Ann Thorac Surg, 2006, 82(6): 2337-2338.
