合并肌少症肝细胞癌患者的临床病理特征及预后分析
2017-04-02曹勤丁佑铭汪斌陈晓燕陈辰赵凯亮戈建辉
曹勤,丁佑铭,汪斌,陈晓燕,陈辰,赵凯亮,戈建辉
(武汉大学人民医院 肝胆腔镜外科,湖北 武汉 430060)
原发性肝癌是消化系统常见的恶性肿瘤,预后较差,手术切除仍是患者有可能获得治愈最有效的方法之一。尽管现代医学在手术技术及围术期处理上已经取得了很大的进步,但术后患者发生并发症的概率仍然较高。术前充分的风险评估及临床干预对患者治疗方式的选择及预后具有重要的意义。
肌少症(sarcopenia)最初于1989年由Rosenberg[1]提出,定义为老年人骨骼肌面积的减少;欧洲老年肌少症学会[2]2010年将其重新定义为骨骼肌面积、力量及功能渐进性的减退,进而增加躯体依赖、生活质量降低及死亡的风险。随着研究进展,人们在罹患慢性阻塞性肺疾病、慢性心肾衰竭、恶性肿瘤的患者中也发现了类似的现象[3]。ESPEN在新近的营养学术语规范指南[4]中进一步将肌少症分为原发性及继发性,前者指在生理状态下,由衰老导致的骨骼肌退行性变化,后者则由疾病、饮食蛋白质摄入不足、失用性萎缩等病理因素导致。有研究[5-7]表明,肌少症是胰腺癌、乳腺癌、泌尿系统恶性肿瘤等预后不佳的危险因素。本文旨在通过对139例因肝细胞癌行肝癌切除术患者的临床病理及随访资料的回顾性分析,初步探讨肌少症在肝细胞癌患者中的预后作用。
1 资料与方法
1.1 研究对象
选取自2010年3月—2016年6月期间因原发性肝癌就诊于武汉大学人民医院行肝切除术的139例患者为研究对象。纳入标准:⑴ 术后病理检查结果证实为原发性肝细胞癌;⑵ 手术方式为肝部分切除术;⑶ 术前1个月内行上腹部CT检查。排除标准:⑴ 排除同时行胆道、胃肠道病损切除与重建等手术的患者;⑵ 排除同期行肝动脉化疗栓塞术(TACE)或消融方式的患者。
1.2 肌少症定义及分组
选取患者上腹部CT腰3水平(L3)横断面为测量平面,在图像处理软件MITK 3M3上将肌肉组织的CT值设置为-29~150 HU,对横断面上包括腹直肌、腹外斜肌、腹内斜肌、腹横肌、腰大肌及脊旁肌在内的所有肌肉面积(cm2)进行定量测量(图1),再除以患者身高的平方(m2),得到的结果定义为骨骼肌指数(skeletal muscle index,SMI)。肌少症定义为SMI男性低于42 cm2/m2、女性低于38 cm2/m2[8]。根据是否合并肌少症将患者分为肌少症组及非肌少症组。
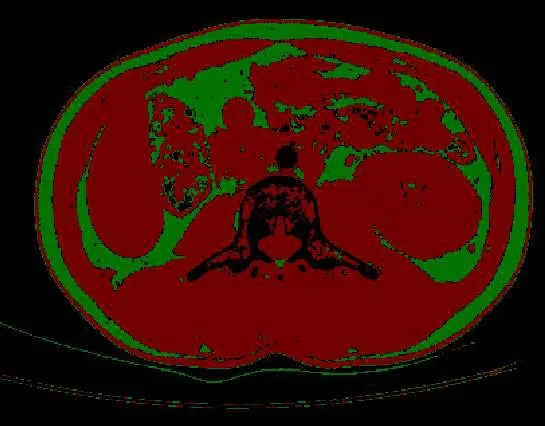
图1 腰3 CT横断面图在MITK 3M3上的处理(肌肉组织的CT值设定为-29~150 HU;脂肪组织为-200~-50 HU)Figure 1 CT scan cross section at L3 level after MITK 3M3 treatment(–29 to150 HU for muscular tissue, and–200 to –50 HU for adipose tissue)
1.3 临床指标
记录患者性别、年龄、体质量指数(BMI)、是否合并糖尿病、术前肝功能(Alb、TBIL、IGCR15等)、手术情况、病理结果、术后并发症发生及生存时间等指标。患者术后并发症的诊断以国际肝脏外科学小组(ISGLS)制定的共识[9-11]为标准。总生存时间定义为手术日期至死亡或随访结束。
1.4 随访
所有患者术后均未采取化疗。患者术后1个月门诊复查上腹部CT,以后每个月复查肿瘤标记物甲胎蛋白AFP及上腹部B超,每6个月复查上腹部平扫+增强CT。
1.5 统计学处理
采用SPSS 20.0软件进行统计分析,计量资料以均数±标准差(±s)表示,并采用独立样本t检验进行分析,计数资料采用χ2检验。生存分析采用Kaplan-Meier及Log-rank检验,并采用Cox比例风险模型进一步分析影响预后的危险因素,P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料
纳入的139例患者中,56例(40.3%)患者合并肌少症。肌少症组患者BMI明显低于非肌少症组(P=0.023),两组在肿瘤的TNM分期及微血管浸润方面有显著差异(P<0.05),在年龄、性别、合并糖尿病、肝功能及其他指标方面未见明显差异(均P>0.05)。两组SMI分别为(38.68±3.24)cm2/m2、(46.82±4.95)cm2/m2,差异有统计学意义(P<0.001),其中,男性分别为(40.41±1.89)cm2/m2、(49.91±1.78)cm2/m2;女性分别为(34.71±1.86)cm2/m2、(40.04±1.91)cm2/m2,差异均有统计学意义(均P<0.001)(表1)。
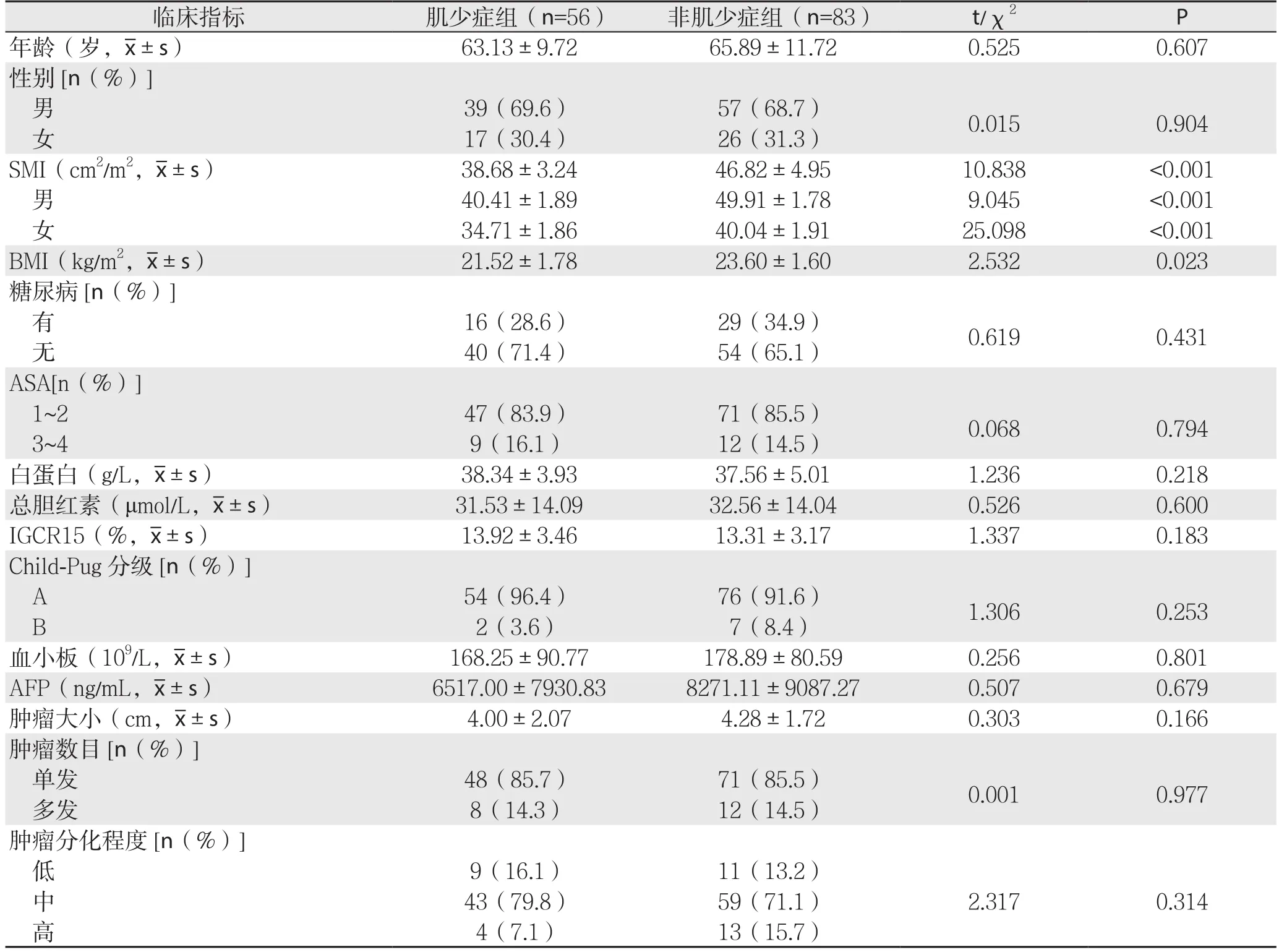
表1 肌少症组与非肌少症组患者的一般资料比较Table 1 Comparison of the general data between sarcopenia group and non- sarcopenia group
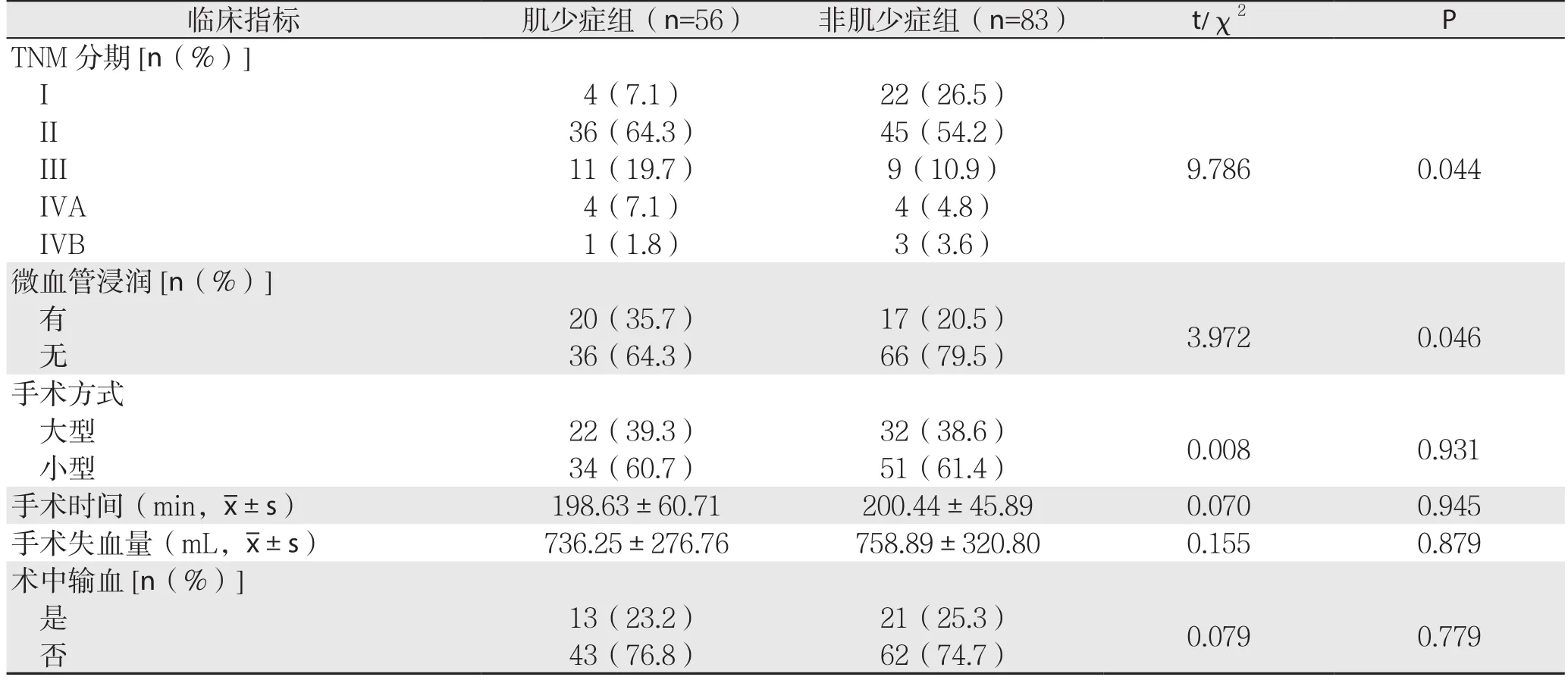
表1 肌少症组与非肌少症组患者的一般资料比较(续)Table 1 Comparison of the general data between sarcopenia group and non- sarcopenia group (Continued)
2.2 术后并发症发生情况
尽管两组患者在术后出血、胆汁漏、肝脏衰竭及腹水形成等方面无统计学差异(均P>0.05),但肌少症组患者术后发生感染的概率显著增加(P=0.022),且发生所有并发症及严重并发症(Clavien-Dindo III级及以上)的发生率明显高于非肌少症组(P=0.002、P=0.040)(表2)。术后恢复时间肌少症组较非肌少症组患者明显延长[(17.35±4.14)d vs.(11.33±3.08)d,P=0.004],需要入ICU治疗的例数也明显增高[7(12.5%)vs. 2(2.4%)P=0.018]。

表2 两组患者术后并发症发生情况比较[n(%)]Table 2 Comparison of the postoperative complications between the two groups [n (%)]
2.3 术后总生存率
Kaplan-Meier生存分析表明,肌少症组患者的总体生存时间明显低于非肌少症组(P=0.040)(图2)。Cox比例风险模型显示,同肿瘤的分化程度、TNM分期及微血管浸润等因素一样,肌少症也是影响患者总生存率的危险因素(P=0.001,HR=2.090,95% CI=1.340~3.259)(表3)。
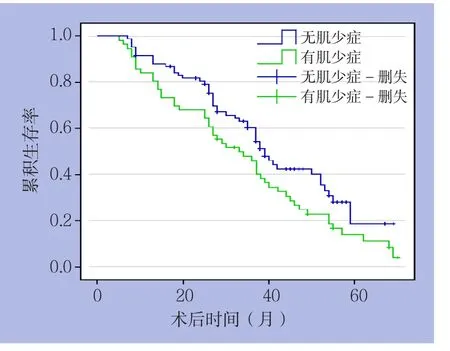
图2 肌少症组与非肌少症组患者生存曲线Figure 2 Survival curves of patients in sarcopenia group and non- sarcopenia group
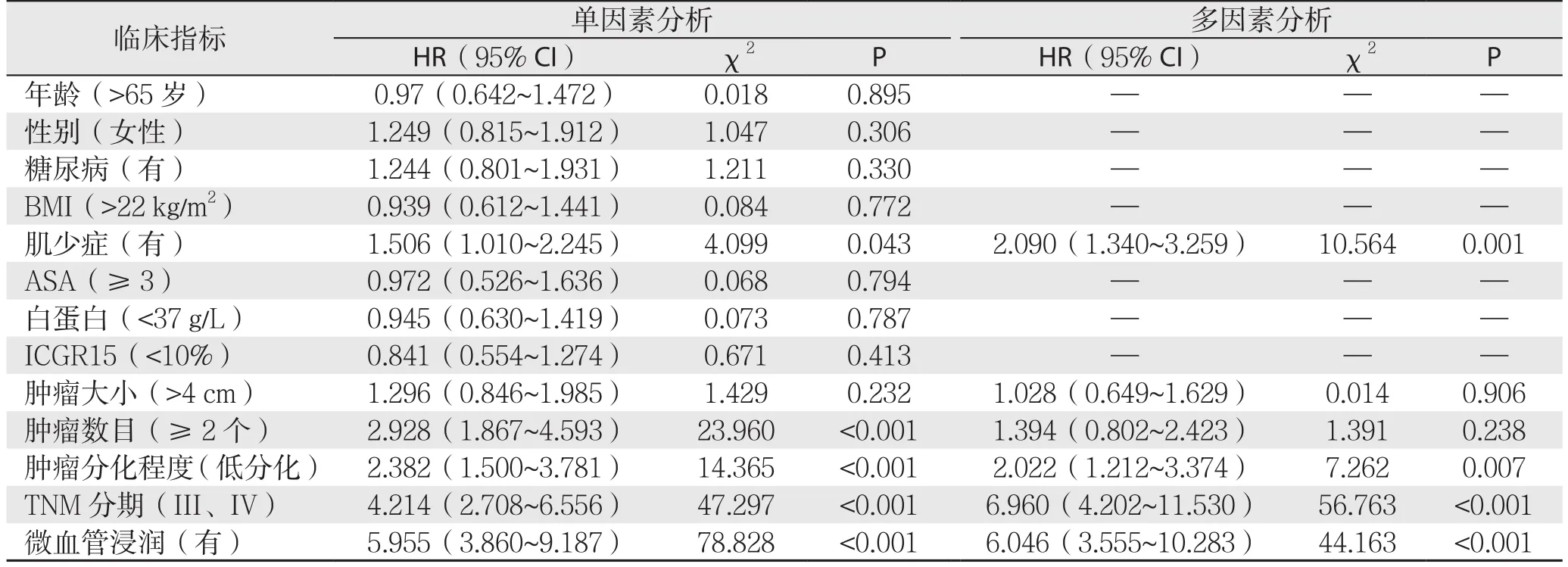
表3 影响HCC患者总生存率因素的Cox回归分析Table 3 Cox proportional hazard analysis of factors aあecting overall survival in HCC patients
3 讨 论
肌少症作为肝恶性肿瘤预后不佳的危险因素已在多项研究中得到了证明,Lodewick等[12]对171例结直肠癌肝转移肝切除术后患者进行生存分析,结果显示肌少症是1、3、5年总生存率降低的独立危险因素;Zhou[13]对67例肝胆管细胞癌患者的研究同样证明了肌少症是总生存率降低的危险因素;与肝癌其他治疗方式相关的预后研究也得出了相似的结论[14-15]。本研究结果表明,合并肌少症的肝细胞癌患者不仅术后总生存率显著下降,术后并发症发生的风险也显著增加,恢复时间显著延长。
恶性肿瘤患者往往伴随着代谢水平的增加及蛋白质组织的大量消耗,除了脂肪组织的减少外,肌肉组织的衰减也是其中的一个重要组成部分。研究[16]表明,肌少症间接地反映了机体的营养及代谢状态,合并肌少症的肝细胞癌患者较差的营养状况可能是其术后并发症发生概率增加的原因之一。此外,肌少症患者免疫功能的改变可能也是影响其预后的重要原因。人体的肌肉组织不仅在能量代谢及运动机能方面具有十分重要的作用,还是重要的内分泌器官[17],能分泌包括IL-6、IL-8、IL-15等在内的多种细胞因子,这些细胞因子通过内分泌或旁分泌作用参与人体的免疫防御等生物学过程。研究[18]表明,肌少症患者体内的IL-15水平降低,进而影响了自然杀伤T细胞的存活及转化。而其他促炎抗炎因子水平的失衡也可能通过改变患者体内的炎性水平而影响肿瘤的预后。不仅如此,骨骼肌产生的谷氨酰胺[19]可激活淋巴细胞与单核细胞,帮助其发挥免疫作用,而肌肉组织的衰减往往意味着谷氨酰胺水平的降低。肌少症患者免疫功能的降低可能是其术后发生感染等并发症概率显著增加的重要原因之一。而患者并发症的增加,则可能会直接导致术后恢复时间的延长。
肌肉组织的衰减不仅会影响患者的营养代谢及免疫功能,在Harimoto[20]的研究中还与肝癌的侵袭性行为有关。此外,在胰腺癌的研究中,作为预后因素,肌少症不仅与诸如糖尿病及贫血等合并症[21]的存在有关,还与肿瘤的生物学行为[22],如肿瘤分期、分化有关,这与Harimoto[20]的结论一致。而本研究也证实了肌少症与患者的BMI及TNM分期、微血管浸润有关,这可能在一定程度上解释了肌少症与肝细胞癌患者术后总生存率降低的关系。
鉴于肌少症对肿瘤患者预后的影响,不少临床研究进一步探讨了肌少症的治疗措施,以期改善预后。目前,肌少症的治疗主要致力于3个方面,即饮食、运动及药物治疗。Beaudart等[23]的一项Meta分析表明运动,包括有氧运动、抵抗运动等在改善肌少症患者预后中具有十分重要的作用。Kappus等[24]的系统综述表明,营养补充配合一定的体力运动可能会改善肌少症的消极作用。Koya等[25]的研究也表明,支链氨基酸的补充可有效地减少合并慢性肝病肝癌患者肌肉组织的萎缩,与一定的体力运动相结合后,效果更加显著。除饮食及运动外,尽管有研究[26]表明老年患者补充雄激素可以减轻肌少症及虚弱,提高患者生存质量,减少住院率,但目前尚无有效的药物可显著的改善肌少症患者的预后。
尽管本研究初步证实了肌少症作为肝癌患者预后不佳的危险因素,但仍存在一定的局限性,一方面,该研究为回顾性研究且样本数量较小;另一方面,在定义肌少症时仅仅考虑了骨骼肌的面积,缺乏骨骼肌力量等其他指标,这可能在一定程度上影响了结论的说服力。此外,关于肌少症影响恶性肿瘤患者预后的机制及规范有效的治疗方法仍需进一步探讨。
[1] Rosenberg I. Summary comments: epidemiological and methodological problems in determining nutritional status of older persons[J]. Am J Clin Nutr, 1989, 50:1231–1233.
[2] Cruz-Jentoft AJ, Baeyens JP, Bauer JM, et al. Sarcopenia: European consensus on definition and diagnosis: Report of the European Working Group on Sarcopenia in Older People[J]. Age Ageing,2010, 39(4):412–423. doi: 10.1093/ageing/afq034.
[3] Baracos V, Kazemi-Bajestani SM. Clinical outcomes related to muscle mass in humans with cancer and catabolic illnesses[J].Int J Biochem Cell Biol, 2013, 45(10):2302–2308. doi: 10.1016/j.biocel.2013.06.016.
[4] Cederholm T, Barazzoni R, Austin P, et al. ESPEN guidelines on definitions and terminology of clinical nutrition[J]. Clin Nutr, 2017,36(1):49–64. doi: 10.1016/j.clnu.2016.09.004.
[5] Amini N, Spolverato G, Gupta R, et al. Impact total psoas volume on short-and long-term outcomes in patients undergoing curative resection for pancreatic adenocarcinoma: a new tool to assess sarcopenia[J]. J Gastrointest Surg, 2015, 19(9):1593–1602. doi:10.1007/s11605–015–2835–y.
[6] Rier HN, Jager A, Sleijfer S, et al. Low muscle attenuation is a prognostic factor for survival in metastatic breast cancer patients treated with first line palliative chemotherapy[J]. Breast, 2017,31:9–15. doi: 10.1016/j.breast.2016.10.014.
[7] Hirasawa Y, Nakashima J, Yunaiyama D, et al. Sarcopenia as a Novel Preoperative Prognostic Predictor for Survival in Patients with Bladder Cancer Undergoing Radical Cystectomy[J]. Ann Surg Oncol, 2016, 23(Suppl 5):1048–1054.
[8] Nishikawa H, Shiraki M, Hiramatsu A, et al. Japan Society of Hepatology guidelines for sarcopenia in liver disease:Recommendation from the working group for creation of sarcopenia assessment criteria[J]. Hepatol Res, 2016,46(10):951–963. doi:10.1111/hepr.12774.
[9] Rahbari NN, Garden OJ, Padbury R, et al. Post‐hepatectomy haemorrhage: a definition and grading by the International Study Group of Liver Surgery (ISGLS)[J]. HPB (Oxford), 2011,13(8):528–535. doi: 10.1111/j.1477–2574.2011.00319.x.
[10] Rahbari NN, Garden OJ, Padbury R, et al. Posthepatectomy liver failure: a definition and grading by the International Study Group of Liver Surgery (ISGLS)[J]. Surgery, 2011, 149(5):713–724.doi:10.1016/j.surg.2010.10.001.
[11] Koch M, Garden OJ, Padbury R, et al. Bile leakage after hepatobiliary and pancreatic surgery: a definition and grading of severity by the International Study Group of Liver Surgery[J].Surgery, 2011, 149(5): 680–688. doi:10.1016/j.surg.2010.12.002.
[12] Lodewick TM, van Nijnatten TJ, van Dam RM, et al. Are sarcopenia, obesity and sarcopenic obesity predictive of outcome in patients with colorectal liver metastases?[J]. HPB (Oxford), 2015,17(5):438–446. doi: 10.1111/hpb.12373.
[13] Zhou G, Bao H, Zeng Q, et al. Sarcopenia as a prognostic factor in hepatolithiasis-associated intrahepatic cholangiocarcinoma patients following hepatectomy: a retrospective study[J]. Int J Clin Exp Med, 2015, 8(10):18245–18254.
[14] Imai K, Takai K, Hanai T, et al. Skeletal muscle depletion predicts the prognosis of patients with hepatocellular carcinoma treated with sorafenib[J]. Int J Mol Sci, 2015, 16(5):9612–9624. doi: 10.3390/ijms16059612.
[15] Iritani S, Imai K, Takai K, et al. Skeletal muscle depletion is an independent prognostic factor for hepatocellular carcinoma[J]. J Gastroenterol, 2015, 50(3):323–332. doi: 10.1007/s00535–014–0964–9.
[16] Voron T, Tselikas L, Pietrasz D, et al. Sarcopenia impacts on short-and long-term results of hepatectomy for hepatocellular carcinoma[J]. Ann Surg, 2015, 261(6):1173–1183. doi: 10.1097/SLA.0000000000000743.
[17] Pedersen BK, Febbraio MA. Muscles, exercise and obesity:skeletal muscle as a secretory organ[J]. Nat Rev Endocrinol, 2012,8(8):457–465. doi: 10.1038/nrendo.2012.49.
[18] Lutz CT, Quinn LS. Sarcopenia, obesity, and natural killer cell immune senescence in aging: altered cytokine levels as a common mechanism[J]. Aging (Albany NY), 2012, 4(8):535–546.
[19] Andrews FJ, Griffiths RD. Glutamine: essential for immune nutrition in the critically ill[J]. Br J Nutr, 2002, 87(Suppl 1):S3–8.
[20] Harimoto N, Shirabe K, Yamashita YI, et al. Sarcopenia as a predictor of prognosis in patients following hepatectomy for hepatocellular carcinoma[J]. Br J Surg, 2013, 100(11):1523–1530.doi: 10.1002/bjs.9258.
[21] Di Sebastiano KM, Yang L, Zbuk K, et al. Accelerated muscle and adipose tissue loss may predict survival in pancreatic cancer patients: the relationship with diabetes and anaemia[J]. Br J Nutr,2013, 109(2):302–312. doi: 10.1017/S0007114512001067.
[22] Carrara G, Pecorelli N, De Cobelli F, et al. Preoperative sarcopenia determinants in pancreatic cancer patients[J]. Clin Nutr, 2016, pii:S0261–5614(16)31289–4. doi: 10.1016/j.clnu.2016.10.014.
[23] Beaudart C, Dawson A, Shaw SC, et al. Nutrition and physical activity in the prevention and treatment of sarcopenia: systematic review[J]. Osteoporos Int, 2017, 28(6):1817–1833. doi: 10.1007/s00198–017–3980–9.
[24] Kappus MR, Mendoza MS, Nguyen D, et al. Sarcopenia in Patients with Chronic Liver Disease: Can It Be Altered by Diet and Exercise?[J]. Curr Gastroenterol Rep, 2016, 18(8):43. doi: 10.1007/s11894–016–0516–y.
[25] Koya S, Kawaguchi T, Hashida R, et al. Effects of in‐hospital exercise on liver function, physical ability, and muscle mass during treatment of hepatoma in patients with chronic liver disease[J].Hepatol Res, 2017, 47(3):E22-E34. doi: 10.1111/hepr.12718.
[26] Saad F, Röhrig G, von Haehling S, et al. Testosterone Deficiency and Testosterone Treatment in Older Men[J]. Gerontology, 2016,63(2):144–156. doi:10.1159/000452499.
