精准肝切除与常规肝切除对肝癌患者T细胞亚群变化影响的比较
2017-04-02魏晓平胡明道于恒海朱伟朱荣松田大广
魏晓平,胡明道,于恒海,朱伟,朱荣松,田大广
(昆明医科大学第二附属医院 肝胆胰外科一病区,云南 昆明 650101)
肝细胞肝癌(以下简称肝癌)的发病率在恶性肿瘤中占第5位[1],世界范围内每年诊断肝癌超过70万例[2]。同时,肝癌是病死率最高的肿瘤之一,中位生存期仅11.9个月[3-4]。目前,治疗肝癌最有效的方法仍为手术[5-6]。其中,精准肝切除术已证实在减少术后并发症,提高生存率等方面优于传统肝切除术[7]。但这一优势是否与患者机体免疫功能的改变有关?笔者回顾分析2015年1月—2016年10月间分别采用精准肝切除及常规肝切除治疗肝癌患者47例临床资料,探讨不同手术方式对患者T淋巴细胞亚群的影响,报道如下。
1 资料与方法
1.1 临床资料
本组患者47例,男28例,女19例;年龄38~72岁,平均(49.5±1.3)岁。病例纳入标准为:⑴ 原发性肝癌患者,男女不限,年龄30~75岁;⑵ 评估心肺功能可耐受手术;⑶ 肝功能 Child A或Child B期;⑷ 肿瘤分期:按TNM分期标准,T3期及以内病例;⑸ 肝切除范围:肝段切除数量≤4个。签订知情同意书后,将患者随机分为精准肝切除组及常规肝切除组,其中精准肝切除组26例,平均年龄(48.7±3.5)岁;常规肝切除组21例,平均年龄(49.6±6.7)岁,两组患者平均年龄、性别、Child-Pugh分级及肝段/叶切除情况差异均无统计学意义(均P>0.05)(表1)。
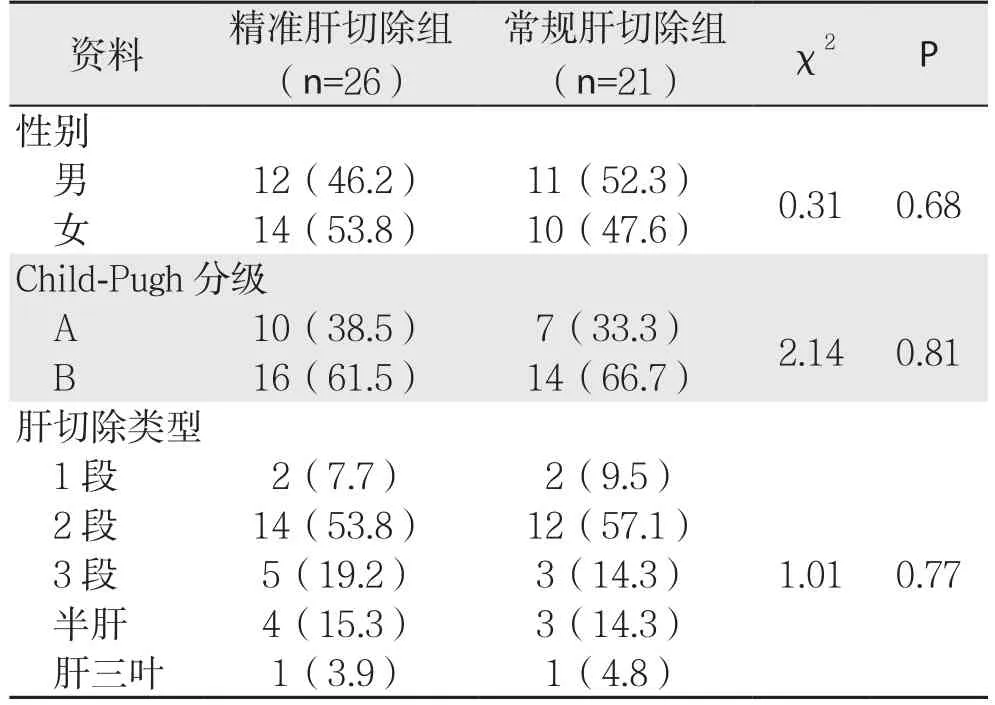
表1 两组患者一般资料比较[n(%)]Table 1 Comparison of the general data between the two groups of patients [n (%)]
1.2 手术方法
1.2.1术前评估常规肝切除组行B超、CT和/或MRI检查,评估手术风险及切除范围。精准肝切除组为精确评估肝脏耐受性及精密规划手术切除范围,具体检查包括:⑴ 超声造影;⑵ 智能256CT,CT血管三维呈像;⑶ 模拟肝切除残肝体积测定;⑷ 吲哚菁绿15 min潴留率(indocyanine green retention test at 15 minutes,ICG R15)。
1.2.2手术情况常规肝切除组术中阻断第一肝门后,大块钳夹,结扎肝组织,缝扎肝创面组织。精准肝切除组在充分游离肝周韧带后,行精密手术规划及精细手术操作:⑴ 术中B超检查,以进一步了解肿瘤深度、范围;有无肝内微卫星转移;是否压迫或侵犯重要脉管;有无癌栓及癌栓长度范围;肝门淋巴结是否侵犯转移。从而在术前评估基础上再次确认手术范围。⑵ 据病变所在肝段/叶,决定第一、二、三肝门游离程度,充分游离相应部分肝脏。⑶ 结扎或横断相应肝段/叶Glisson鞘,待出现血运分界线后,用超声乳化吸引刀(cavitron ultrasonic surgical aspirator,CUSA)或超声刀逐步切除病变所在肝组织。⑷ 肝创面用4-0或5-0血管缝合线缝扎止血,尽量敞开创面,通畅引流。
1.2.3术后处理术后两组均给予抗炎、保肝、对症支持治疗。精准肝切除组据术后肝功能检测结果给予20%人血白蛋白10~40 g/d输注,通常引流前提下,尽早拔除腹腔引流管。
1.3 观察指标
⑴ 手术时间、术中失血量、住院时间及并发症发生率;⑵ 术后3、7、14 d肝功能变化;⑶ 术前及术后7、14 d外周血CD3+、CD4+、CD8+及CD4+/CD8+水平。
1.4 统计学处理
采用SPSS 13.0统计软件包进行统计分析,同时间点两组间比较,计量资料以均数±标准差(±s)表示,采用t检验,方差不齐时采用t’检验;计数资料用[n(%)]表示,采用χ2检验。多个时间点各指标间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 手术相关指标的比较
与常规肝切除组比较,精准肝切除组手术失血量少,住院时间短,术后胆汁漏及腹腔出血率低(均P<0.05),但手术时间较长(P<0.05)(表2)。
2.2 手术前后两组肝功能结果比较
两组术前各项肝功能指标均无统计学差异(均P>0.05);两组术后3、7 d ALT、AST水平明显上升,但精准肝切除组上升程度低于常规肝切除组(均P<0.05);ALB水平常规肝切除组术后3 d较术前及精准肝切除组明显下降(P<0.05),术后14 d两组各指标均接近术前水平,差异均无统计学意义(均P>0.05)(表3)。
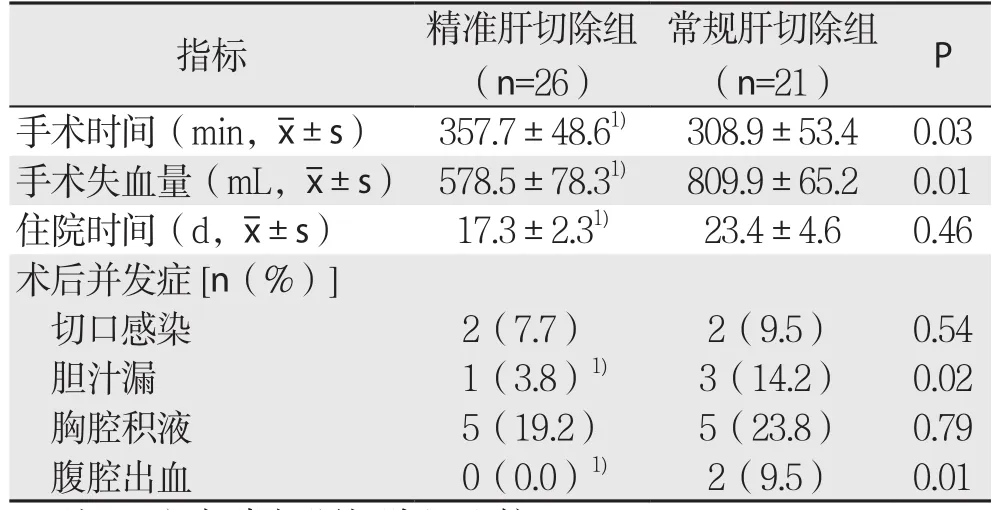
表2 两组手术相关指标的比较Table 2 Comparison of surgical variables between the two groups
表3 两组手术前后肝功能指标的比较(±s)Table 3 Comparison of pre- and postoperative liver function parameters between the two groups (±s)

表3 两组手术前后肝功能指标的比较(±s)Table 3 Comparison of pre- and postoperative liver function parameters between the two groups (±s)
注:1)与术前比较,P<0.05;2)与常规肝切除组比较,P<0.05Note: 1) P<0.05 vs. prerogative level; 2) P<0.05 vs. conventional hepatectomy group
指标 精准肝切除组(n=26)常规肝切除组(n=21) P ALT(U/L)术前 45.6±5.9 43.8±6.5 0.89术后3 d 207.7±11.31),2) 421.1±15.41) 0.01术后7 d 97.6±8.71),2) 207.1±13.71) 0.02术后14 d 48.7±1.8 74.5±8.2 0.38 AST(U/L)术前 50.9±9.2 52.3±7.2 0.76术后3 d 330.5±13.71),2) 380.5±9.81) 0.01术后7 d 108.6±14.21),2) 193.5±16.31) 0.02术后14 d 45.1±3.6 58.4±4.3 0.43 ALB(g/L)术前 38.3±3.2 42.9±2.9 0.65术后3 d 37.6±2.42) 20.1±1.81) 0.04术后7 d 34.5±1.9 29.6±4.1 0.21术后14 d 45.1±3.6 39.1±4.3 0.54
2.3 两组T细胞亚群水平比较
两组患者术前CD3+、CD4+、CD8+及CD4+/CD8+水平均无统计学差异(均P>0.05);术后7 d CD3+、CD4+及CD4+/CD8+水平两组均明显下降(均P<0.05),但精准肝切除组水平高于常规肝切除组(P<0.05)。术后14 d两组各指标均接近术前水平,差异无统计学意义(均P>0.05)(表4)。
表4 两组手术前后T细胞亚群水平比较(±s)Table 4 Comparison of pre- and postoperative T cell subsets between the two groups (±s)
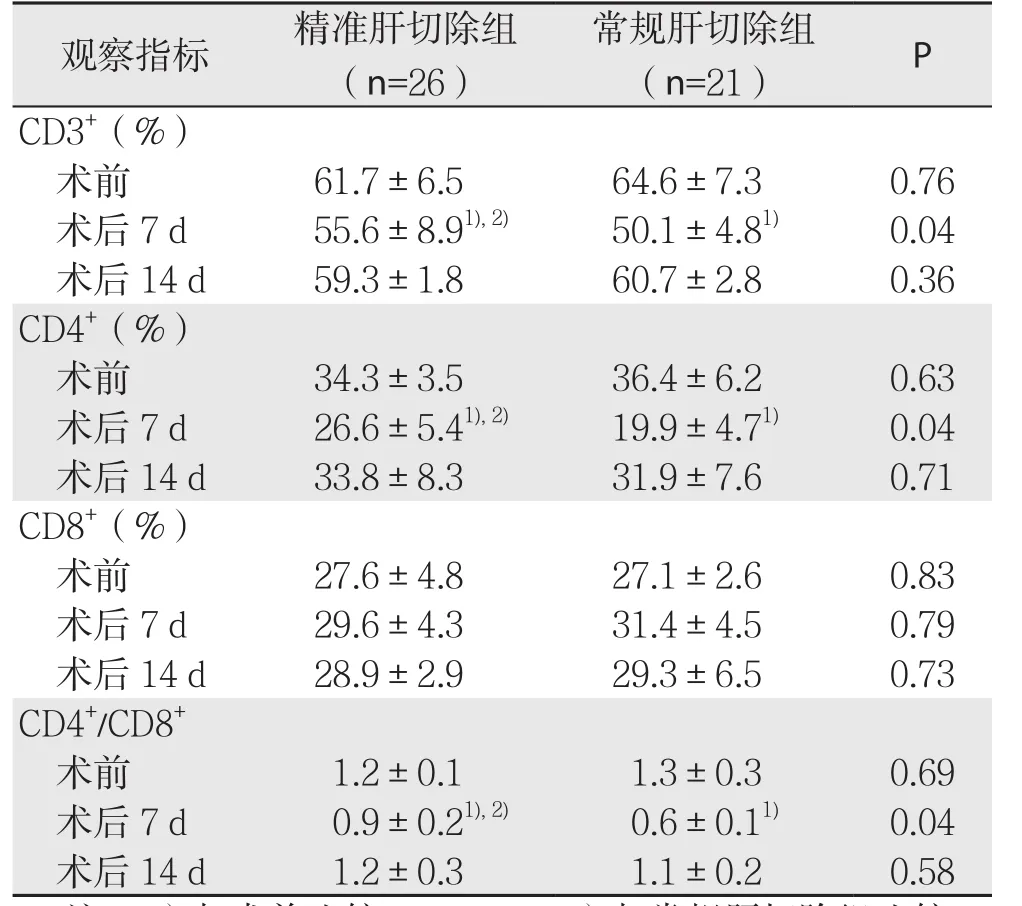
表4 两组手术前后T细胞亚群水平比较(±s)Table 4 Comparison of pre- and postoperative T cell subsets between the two groups (±s)
注:1)与术前比较,P<0.05;2)与常规肝切除组比较,P<0.05Note: 1) P<0.05 vs. prerogative level; 2) P<0.05 vs. conventional hepatectomy group
观察指标 精准肝切除组(n=26)常规肝切除组(n=21) P C D 3+(%)术前 61.7±6.5 64.6±7.3 0.76术后7 d 55.6±8.9 1),2) 50.1±4.8 1) 0.04术后14 d 59.3±1.8 60.7±2.8 0.36 C D 4+(%)术前 34.3±3.5 36.4±6.2 0.63术后7 d 26.6±5.4 1),2) 19.9±4.7 1) 0.04术后14 d 33.8±8.3 31.9±7.6 0.71 C D 8+(%)术前 27.6±4.8 27.1±2.6 0.83术后7 d 29.6±4.3 31.4±4.5 0.79术后14 d 28.9±2.9 29.3±6.5 0.73 C D 4+/C D 8+术前 1.2±0.1 1.3±0.3 0.69术后7 d 0.9±0.2 1),2) 0.6±0.1 1) 0.04术后14 d 1.2±0.3 1.1±0.2 0.58
3 讨 论
近年来,精准肝切除在肝癌治疗中的应用日益广泛,与传统肝切除比较,具有以下优点[7-8]:⑴ 减少创伤;⑵ 确保剩余肝脏的结构完整性;⑶ 减少术中及术后并发症;⑷ 降低肿瘤复发率。本研究中,精准肝切除组在手术相关指标、术后肝功能变化等各方面均优于常规肝切除组,与既往研究一致。为更好的实施精准肝切除,应注意以下几点:⑴ 术前精确规划。笔者结合三维CT模拟肝切除后的残肝体积测定[9-10]及ICG-R15残留率[11],评估肝脏储备功能,判断肝脏耐受性。三维CT成像可提供肿瘤与重要脉管结构的关系信息[12],预估手术是否可剥离后保留脉管。超声造影有助于了解是否存在肝内微卫星转移(直径<1 cm)及转移灶的数量[13]。⑵ 精细手术操作。术中B超进一步确定肿瘤的深度及大小,了解肿瘤与重要脉管的关系[14],再次确定手术范围。相应肝段Glisson的寻找及横断是精准肝切除手术操作的核心步骤。笔者的经验是:⑴ 第一肝门处切开肝门板,将肝内Glisson鞘下降1~2 cm,可快速有效阻断左、右肝蒂。若发生出血,可填入纱布角压迫,待数分钟后出血可停止。⑵ 右肝的二级Glisson蒂游离可从胆囊床层面进入。沿胆囊床中线近肝门处切开肝实质1~2 cm,可寻及右前、右后肝蒂。但若肿瘤侵犯肝蒂,不可强行用直角钳分离后钩扎相应肝蒂,以免撕裂血管引起大出血。若肿瘤压迫,可通过精细手术器械将两者仔细分离;若肿瘤侵犯,可放弃该Glisson蒂的游离。⑶ 待相应Glisson蒂横断后,沿血运分界线逐步切开肝实质,直径<2 mm管道可直接凝断;2~3 mm管道可用Ligsure血管闭合系统切断;>3 mm管道在判断其性质前,尽量不要随意结扎或切断。结合术中B超判断管道性质,明确不会影响残余肝脏功能后在予以处理。⑷ 术中若遇出血,可用精细无损伤镊尽量夹住破口,吸尽出血后,用4-0或5-0血管缝合线缝扎止血。⑸ 切除完毕,用注射器采用脉冲方式冲洗肝断面,冲去细小血凝块后,准确判断有无活动性出血及胆汁漏。⑹ 术中CVP尽量保持在1~3 cmH2O(1 cmH2O=0.098 kPa),可有效减少术中出血。
精准肝切除的诸多优势,从肝功能恢复,技术的改善等方面已进行了方法的研究[15-16]。但针对肝脏这一特殊的免疫特惠器官,是否可从免疫角度来探讨精准肝切除的优势机理?细胞免疫是机体抗肿瘤的主要免疫机制,CD3+淋巴细胞是其主要的活性细胞,是肿瘤免疫反应的重要效应器,可分为CD4+及CD8+亚群。CD4+主要通过分泌细胞因子调节其它细胞活性,对免疫反应的启动和强弱起关键作用。CD4+/CD8+的稳态维持机体正常的免疫反应,是反映机体免疫损害的敏感指标[17-18]。CD4+/CD8+下降,机体免疫功能低下,提示预后不良,而免疫功能恢复首先表现为CD4+/CD8+上升。本研究中,术后7 d,两组CD3+水平均降低,说明机体遭受手术打击后均处于免疫低下状态。这一改变以CD4+及CD4+/CD8+为主,但精准肝切除组水平高于常规肝切除组;术后14 d,两组水平均恢复正常。这一变化趋势,与肝功能变化保持高度一致,从而说明免疫功能的改善与肝脏功能的恢复密切相关,而精准肝切除对免疫功能的恢复无论从时间还是强度均优于常规肝切除,相应地对肝脏功能带来的打击小,恢复快。同时发现,术后两组CD8+水平虽较术前升高,但无统计学差异,并且常规肝切除组CD8+水平甚至略高于精准肝切除组。CD8+又称细胞毒性T淋巴细胞,是肿瘤细胞杀伤作用的重要效应细胞。结合各淋巴细胞亚群的功能是否可推断,在手术对机体打击造成的免疫功能整体下降的基础上,精准肝切除通过延缓CD4+的降低及CD8+的上升,提升CD4+/CD8+比例,在一定程度上促进了机体免疫功能的恢复,从而改善了肝脏功能。但能否就此说明肝功能改善仅与免疫因素有关呢?
研究[19]发现,间隔30 min的2次失血20%,刺激T细胞分裂,抑制T细胞增殖。在严重失血后,CD4+细胞数量明显减少,CD4+/CD8+比例降低甚至倒置,引起细胞免疫功能下降,这也是导致失血后免疫应答表现紊乱的原因之一[20-21]。术中出血减少是精准肝切除的一大特征[22],相应的对机体造成的免疫打击也减少,这从另一方面解释了精准肝切除组术后肝功能更好的恢复。同时,精准肝切除组术后胆汁漏,腹腔出血发生率显著降低,相应地在手术基础上给机体带来的二次打击减少,也促进了术后免疫功能的恢复。精准肝切除要求之一就是最大程度地保留具有有效功能的剩余肝脏[23]。而关于肝脏切除的范围,一直存在着争议,切除范围过大,术后易出现肝功能失代偿;切除范围不足,则又可能增加复发[24-25]。目前的策略是在保留有效残肝的基础上保证切缘阴性。精准肝切除的术前精确规划,术中精细操作从理论和实际操作上保证了这一点的实施。有效残肝保留越多,则机体免疫功能及肝功能恢复越好,相应地预后也更好。
因此,笔者认为,精准肝术后免疫功能的恢复与肝功能的改善两者变化趋势保持一致,互为因果,相互作用,而非单纯的单向作用。精准肝切除免疫功能及肝功能恢复优于常规肝切除组的原因在于:⑴ 术中出血量的减少;⑵ 尽量保留了残余肝脏功能,减少了无效肝的存在;⑶ 对功能性管道的保护,如肝静脉,胆管等,保证了残余肝的有效灌注及回流;⑷ 术后并发症的减少,降低了对机体的二次打击。
综上所述,针对肝癌的手术治疗,精准肝切除在术后免疫功能的恢复方面优于常规肝切除,而这一变化与肝脏功能的恢复及手术相关指标的改变一致,这从免疫学角度结合手术具体操作解释了精准肝切除给患者带来的诸多受益。但本研究仅探讨了T淋巴细胞亚群水平的变化,是免疫系统改变的基础性指标,若需进一步了解精准肝切除对机体免疫功能的影响,尚需扩大研究范围,深入探讨。
[1] Germano D, Daniele B. Systemic therapy of hepatocellular carcinoma: current status and future perspectives[J]. World J Gastroenterol, 2014, 20(12):3087–3099. doi: 10.3748/wjg.v20.i12.3087.
[2] Xiu P, Dong XF, Li XP, et al. Clusterin: Review of research progress and looking ahead to direction in hepatocellular carcinoma[J].World J Gastroenterol, 2015, 21(27):8262–8270. doi: 10.3748/wjg.v21.i27.8262.
[3] Amr KS, Ezzat WM, Elhosary YA, et al. The potential role of miRNAs 21 and 199-a in early diagnosis of hepatocellular carcinoma[J]. Gene, 2016, 575(1):66–70. doi: 10.1016/j.gene.2015.08.038.
[4] Kumar AM, Fredman ET, Coppa C, et al. Patterns of cancer recurrence in localized resected hepatocellular carcinoma[J].Hepatobiliary Pancreat Dis Int, 2015, 14(3):269–275.
[5] Kanda T, Ogasawara S, Chiba T, et al. Current management of patients with hepatocellular carcinoma[J]. World J Hepatol, 2015,7(15):1913–1920. doi: 10.4254/wjh.v7.i15.1913.
[6] Schlachterman A, Craft WW Jr, Hilgenfeldt E, et al. Current and future treatments for hepatocellular carcinoma[J]. World J Gastroenterol, 2015, 21(28):8478–8491. doi: 10.3748/wjg.v21.i28.8478.
[7] 王新青, 卜阳, 于松宁, 等. 精准肝切除治疗原发性肝癌近期疗效的Meta分析[J]. 中国普通外科杂志, 2016, 25(1):57–67.doi:10.3978/j.issn.1005–6947.2016.01.010.Wang XQ, Bo Y, Yu SN, et al. Short-term efficacy of precise hepatectomy for primary liver cancer: a Meta-analysis[J]. Chinese Journal of General Surgery, 2016, 25(1):57–67. doi:10.3978/j.issn.1005–6947.2016.01.010.
[8] 安东均, 安琳, 张成, 等. 精准肝切除与非规则性肝切除治疗肝癌的疗效分析[J]. 中国普通外科杂志, 2011, 20(7):784–786.An DJ, An L, Zhang C, et al. Efflcacy evaluation of precise hepatectomy and irregular hepatectomy in the treatment of liver cancer[J]. Chinese Journal of General Surgery, 2011, 20(7):784–786.
[9] 荚卫东. 精准肝切除治疗肝细胞癌关键技术[J]. 中国普通外科杂志, 2014, 23(1):1–5. doi:10.7659/j.issn.1005–6947.2014.01.001.Jia WD. Key techniques in precise hepatectomy for hepatocellular carcinoma[J]. Chinese Journal of General Surgery, 2014, 23(1):1–5.doi:10.7659/j.issn.1005–6947.2014.01.001.
[10] Truant S, Boleslawski E, Sergent G, et al. Liver function following extended hepatectomy can be accurately predicted using remnant liver volume to body weight ratio [J]. World J Surg, 2015,39(5):1193–1201. doi: 10.1007/s00268–014–2929–9.
[11] Okabe H, Beppu T, Hayashi H, et al. Rank classification based on the combination of indocyanine green retention rate at 15 min and (99m)Tc-DTPA-galactosyl human serum albumin scintigraphy predicts the safety of hepatic resection[J]. Nucl Med Commun,2014, 35(5):478–483. doi: 10.1097/MNM.0000000000000075.
[12] Honda K, Oda S, Katahira K, et al. Three-dimensional computed tomographic angiography of the liver for planning hepatic surgery:eあect of low tube voltage and the iterative reconstruction algorithm on image quality[J]. J Comput Assist Tomogr, 2014, 38(1):131–136.doi: 10.1097/RCT.0b013e3182a9a518.
[13] Yang W, Yan K, Wang S, et al. Differential Diagnosis of Arterial Phase Enhanced Hepatic Inflammatory Lesions and Hepatocellular Carcinomas with Contrast-enhanced Ultrasound[J]. Ultrasound Med Biol, 2016, 42(1):82–91. doi: 10.1016/j.ultrasmedbio.2015.07.014.
[14] Felsted AE, Shi Y, Masand PM, et al. Intraoperative ultrasound for liver tumor resection in children[J]. J Surg Res, 2015, 198(2):418–423. doi: 10.1016/j.jss.2015.03.087.
[15] Yin DL, Jiang HC, Liang YJ, et al. Precise hepatectomy guided by minimally invasive surgery: a novel strategy for liver resection[J].Hepatogastroenterology, 2012, 59(118):1951–1959. doi: 10.5754/hge10815.
[16] Jarufe N, Figueroa E, Muñoz C, et al. Anatomic hepatectomy as a definitive treatment for hepatolithiasis: a cohort study[J].HPB (Oxford), 2012, 14(9):604–610. doi: 10.1111/j.1477–2574.2012.00488.x.
[17] Schmidt N, Neumann-Haefelin C, Thimme R. Cellular immune responses to hepatocellular carcinoma: lessons for immunotherapy[J]. Dig Dis, 2012, 30(5):483–491. doi:10.1159/000341697.
[18] Rathore AS, Kumar S, Konwar R, et al. CD3+, CD4+ & CD8+tumour infiltrating lymphocytes (TILs) are predictors of favourable survival outcome in infiltrating ductal carcinoma of breast[J]. Indian J Med Res, 2014, 140(3):361–369.
[19] Reino DC, Pisarenko V, Palange D, et al. Trauma hemorrhagic shock-induced lung injury involves a gut-lymph-induced TLR4 pathway in mice[J]. PLoS One, 2011, 6(8) :e14829. doi: 10.1371/journal.pone.0014829.
[20] Ohashi R, Mu H, Yao Q, et al. Atherosclerosis:immunopathogenesis and immunotherapy[J]. Med Sci Monit, 2004, 10(11):RA255–260.
[21] Oberbeck R, Nickel E, von Griensven M. The effect of dehydroepiandrosterone on hemorrhage-induced suppression of cellular immune function[J]. Intensive Care Med, 2002, 28(7):963–968.
[22] 薛冬冬, 脱红芳, 彭彦辉. 精准肝切除技术在减轻肝切除术后炎症方面的作用[J]. 中国普通外科杂志, 2016, 25(7):1063–1068.doi:10.3978/j.issn.1005–6947.2016.07.021.Xue DD, Tuo HF, Peng YH. Decreasing postoperative inflammation after liver resection by using precise hepatectomy technique[J].Chinese Journal of General Surgery, 2016, 25(7):1063–1068.doi:10.3978/j.issn.1005–6947.2016.07.021.
[23] 董家鸿, 杨世忠. 精准肝切除的技术特征与临床应用[J]. 中国实用外科杂志, 2010, 30(8):638–640.Dong JH, Yang SZ. Technical characteristics and clinical application of precision liver resection[J]. Chinese Journal of Practical Surgery,2010, 30(8):638–640.
[24] Eguchi S, Kanematsu T, Arii S, et al. Comparison of the outcomes between an anatomical subsegmentectomy and a non-anatomical minor hepatectomy for single hepatocellular carcinomas based on a Japanese nationwide survey[J]. Surgery, 2008, 143(4):469–475. doi:10.1016/j.surg.2007.12.003.
[25] But DY, Lai CL, Yuen MF. Natural history of hepatitis-related hepatocellular carcinoma[J]. World J Gastroenterol, 2008,14(11):1652–1656.
