Ⅲ级和Ⅳ级脑胶质瘤术后放疗联合替莫唑胺化疗的疗效观察
2017-04-01贾敬好王静王巍孙璐刘建平刘卫东韩春
贾敬好 王静 王巍 孙璐 刘建平 刘卫东 韩春
Ⅲ级和Ⅳ级脑胶质瘤术后放疗联合替莫唑胺化疗的疗效观察
贾敬好 王静 王巍 孙璐 刘建平 刘卫东 韩春
目的 评价Ⅲ、Ⅳ级脑胶质瘤术后放疗联合替莫唑胺化疗的近期疗效。方法 回顾分析2011年1月至2013年10月收治的52例Ⅲ、Ⅳ级脑胶质瘤术后放疗或放化疗患者的临床资料,其中单纯放疗19例,放疗联合替莫唑胺化疗33例。分析患者近期疗效。结果 随访率100%,随访时间满1、2年样本数分别为22、7例。1、2年总生存率分别为44.0%、13.46%。单因素分析显示:手术切除程度、术前有无癫痫、是否同期化疗均为影响患者生存的因素(P=0.000、0.013、0.003)。多因素分析显示:肿瘤切除程度、术前有无癫痫发作、放疗是否联合替莫唑胺化疗、化疗周期数是影响患者生存预后的独立影响因素(P=0.001、0.018、0.028、0.006)。结论 Ⅲ、Ⅳ级脑胶质瘤术后患者放疗联合替莫唑胺化疗可取得较好疗效,同时肿瘤切除程度、术前有无癫痫发作、放疗联合替莫唑胺化疗及化疗周期数是影响恶性胶质瘤患者长期生存的重要因素。
脑肿瘤;术后放射疗法;脑肿瘤;术后放化疗法;预后
恶性脑胶质瘤是中枢神经系统最常见的恶性肿瘤,包括间质性星形细胞瘤和胶质母细胞瘤,世界卫生组织(WHO)分级为Ⅲ、Ⅳ级,呈浸润性生长,手术难以彻底切除,复发率和死亡率极高,其中恶性胶质瘤在原发性脑瘤中占35%~45%,而Ⅳ级胶质母细胞瘤占原发性神经系统肿瘤54%,Ⅲ级间变中心型星形细胞瘤占7%[1,2]。由于Ⅲ、Ⅳ级神经胶质瘤患者单纯手术治疗预后较差,故多采用术后放疗联合化疗。我们对52例Ⅲ、Ⅳ级脑胶质瘤患者的临床及病理因素和治疗模式进行生存分析研究,评价近期疗效,为恶性胶质瘤患者寻求更佳治疗方案。
1 资料与方法
1.1 一般资料 选取2011年1月至2013年10月在河北省唐山市人民医院放化二科接受治疗的Ⅲ、Ⅳ级脑胶质瘤患者52例,所有患者有完整病案及随访资料,均行手术及术后放疗,均经组织病理学检查确诊。其中男38例,女14例;行单纯放疗19例,放疗同期替莫唑胺化疗者33例;≥60岁16例,<60岁36例;活检术5例,部分切除12例,次全切除25例,完全切除10例;肿瘤分级:Ⅲ级20例,占38.5%,Ⅳ级32例,占61.5%。
1.2 方法
1.2.1 手术:术后<72 h内复查头颅MRI,根据术前和术后影像学检查的容积定量分析为标准评估肿瘤切除程度,分为活检(肿瘤切除<10%)、部分切除(肿瘤切除10%~15%)、次全切除(肿瘤切除51%~99%)和全切除[1]。
1.2.2 放疗:均为术后三维适形放疗或调强放疗,CT模拟定位,结合术前增强MRI勾画放疗靶区:大体肿瘤体积GTV为CT显示术后残留肿瘤和(或)术腔。临床靶体积CTV为GTV外扩2.5~3.0 cm,PTV为CTV外扩0.3~0.5 cm。处方剂量58~66 Gy,50 Gy后将CTV缩小至GTV外扩1 cm,三维适形和调强放疗计划一般要求95%PTV体积接受处方剂量58~66 Gy。
1.2.3 化疗:术后放疗同期连续口服替莫唑胺75 mg/m2,至放疗结束,放疗后4周开始辅助替莫唑胺治疗150~200 mg/m2,第1~5天,28 d为1个周期,6个周期为标准治疗,体质和经济条件允许建议做足8个周期。
1.3 评价标准 放疗结束后每3个月复查1次头颅MRI、CT,观察肿瘤缩退情况。按世界卫生组织(WHO)实体瘤近期疗效评价标准评估疗效。部分患者放疗后3~6个月影像学检查可见原有增强病灶体积变大,甚或出现新增强病变现象,动态观察影像学资料并经肿瘤科及影像科专家讨论后排除假性进展。生存期从手术当天起算,终点事件为复发和死亡。
1.4 统计学分析 应用SPSS 22.0统计软件,用Kaplan-Meier法行生存分析,Log-rank行单因素分析,Cox回归模型行多因素分析,P<0.05为差异有统计学意义。
2 结果
2.1 全组生存情况 采用电话、门诊或住院等方式随访,截至2014年12月31日,随访时间3~34个月(中位随访时间为12个月),随访率100%,全组1、2年总生存率分别为44.00%、13.46%。
2.2 影响生存预后单因素分析 肿瘤全切(P=0.000)、术前无癫痫发作(P=0.013)、术后放疗同步联合替莫唑胺化疗(P=0.003)是预后的影响因素,差异有统计学意义(P<0.05)。见表1,图1~3。
2.3Cox模型多因素分析 肿瘤切除程度、术前有无癫痫发作、放疗是否联合替莫唑胺化疗以及化疗周期数是影响患者生存预后的独立影响因素。见表2。

表1 52例Ⅲ、Ⅳ级脑胶质瘤预后的单因素分析结果 %

图1 肿瘤切除程度对生存曲线的影响

图2 术前有无癫痫对生存曲线的影响
2.4 全组患者生存曲线 见图4。

图3 放疗是否联合替莫唑胺化疗对生存曲线的影响

图4 全组患者总生存曲线
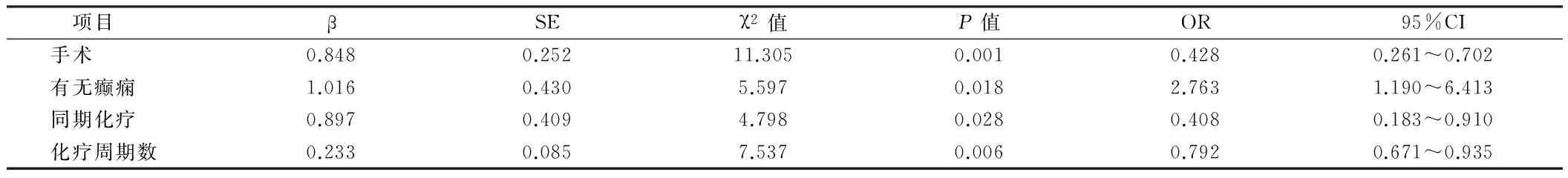
项目βSEχ2值P值OR95%CI手术0.8480.25211.3050.0010.4280.261~0.702有无癫痫1.0160.4305.5970.0182.7631.190~6.413同期化疗0.8970.4094.7980.0280.4080.183~0.910化疗周期数0.2330.0857.5370.0060.7920.671~0.935
3 讨论
高级别胶质瘤即2007年WHO中枢神经系统肿瘤病理分类中Ⅲ~Ⅳ级胶质瘤,患者预后差,多预后不良,其中Ⅲ级胶质瘤患者中位生存期为15~28个月、5年生存率约为30%,而Ⅳ级胶质瘤患者中位生存期仅8~12个月、5年生存率仅为2.50%~5%,Ⅳ级脑胶质瘤预后极差[3]。手术虽然为治疗高级别脑胶质瘤的基本手段,但患者单纯术后治疗后5年生存率不足5%,术后同步放化疗其2 年生存率可提高到20%~30%。由于高级别胶质瘤呈浸润性生长,复发率几乎高达100%,临床上高级别的脑胶质瘤治疗非常棘手,患者生存情况很不乐观,手术是高级别脑胶质瘤的主要治疗手段,可以明确病理,缓解颅高压,减少瘤负荷,为后续放化疗创造条件。Mayo等[4]分析了临床数据有关视神经和交叉的耐受剂量。研究者认为:接受50Gy放疗照射,放射性视神经病变的发生率为0,而照射55~60Gy时风险为3%~7%,而这些损伤的发生几乎全在59Gy左右,这些数据表明较高的耐受剂量认为是安全的,且放射治疗对高级别胶质瘤治疗有效。替莫唑胺是目前治疗高级别脑胶质瘤的化疗的首选药物,以其口服易吸收、毒副作用小、作用明显等特点受到临床医生和患者的欢迎。TMZ是一种新型的口服二代烷化剂-咪唑四嗪类衍生物,口服后迅速吸收。TMZ进入体内不经肝脏代谢广泛分布于全身,并可透过血脑脊液屏障,进入脑脊液,在中枢神经系统达到有效的药物浓度,该药有近100%的生物利用度及广谱抗肿瘤活性。有文献报道,其血浆/脑脊液比接近30%~40%[5]。TMZ对肿瘤细胞的核酸、蛋白质及肽亲核区发生作用,故该药可作用于肿瘤细胞分裂的各个时期。临床及病理对照研究均证实,对于高级别的恶性脑胶质瘤联合治疗优于其他任何一种单一治疗手段,单一治疗的长期随访结果让人失望,本研究尝试将放疗与替莫唑胺相结合。
本研究显示,手术切除程度是影响患者总生存的独立预后因素,肿瘤全切的生存率明显优于次全切除、部分切除、以及活检术患者,生存时间为19.3个月、17.3个月、13.6个月及6.4个月,差异有统计学意义(P<0.01)。胶质瘤的不同部位的形态学表现存在异质性,活检或部分切除肿瘤,在进行病理分级时可能造成肿瘤级别的低估,而肿瘤的完整切除,能够提供准确的病理诊断。相关研究证实肿瘤局部复发是治疗失败的主要原因,并且90%的复发病灶发生在距离原发灶2 cm的范围内,术后放疗可杀灭残余的肿瘤细胞,控制亚临床病灶,降低复发率,延长生存期,但单纯术后放疗的疗效不尽如人意,患者5年生存率小于5%[6-8]。高级别恶性胶质瘤即使做到达99%切除后可使肿瘤细胞负荷由109降低至107,即使手术残留1%的肿瘤组织,8周后肿瘤细胞就可恢复到原来的数目。即使肉眼全切,仍可能有约1 g左右肿瘤残留,将成为日后肿瘤复发根源。由此术后需尽早开始放射治疗、化学治疗,让术后放化疗的疗效为手术切除保驾护航。近年来多项研究均证实了最大程度的切除肿瘤可以给患者带来较好的短期控制,从而可以提高局部控制率,进而改善患者的远期生存[7-9]。由于不同医院的手术水平、病例选择、放疗方案以及病理技术方面均会存在一定的差距,因此脑胶质瘤手术患者预后会有不同程度的差异性,如何延缓复发,延长脑胶质瘤患者生存时间是神经外科领域医生面临的共同的研究热点及难题。
本研究结果显示:术前是否伴有癫痫发作与肿瘤复发风险及生存时间有关,癫痫的每次发作,均可对人体造成损害,并且耐胶质瘤引发的特异性癫痫发作常常提示侵犯功能区域引起,提示局部侵犯明显或是肿瘤有播散倾向,从而影响患者的存活时间,与相关研究[10]相符。但也有认为其作用机制可能为癫痫发作患者症状出现相对较早,有利于早期诊断和早期治疗,使得病灶切除较彻底,因而预后相对较好。关于术前有无癫痫症状对于预后的影响说法不一致。
放疗是高级别胶质瘤标准治疗的重要组成部分。本研究数据结果还显示与术后单纯放疗患者相比,术后放疗联合替莫唑胺化疗患者具有明显生存优势。相关研究证实年龄、病理分级及是否有替莫唑胺化疗影响患者生存时间,并奠定了高级别胶质瘤术后放疗联合化疗(替莫唑胺)的基石作用,手术切除范围与神经胶质瘤放疗的预后关系[11-13],有的报道还存在分歧。多项研究结果显示,手术切净程度与预后有着密切关系。Chen等[14]回顾性分析125例诊断为Ⅲ、Ⅳ级脑胶质瘤的治疗模式,对年龄进行分层分析,显示≥50岁和<50岁年龄组生存时间有明显差异,发现年龄较小的脑胶质瘤患者预后明显优于年龄较大的患者,显示脑胶质瘤患者预后与年龄密切相关。多因素分析还显示病理分级以及是否规范化化疗为影响患者预后的独立因素。Stupp等[15]组织的一项大规模前瞻性随机对照实验显示:3D-CRT组:术后6周开始放疗,处方剂量,2 Gy/次,5次/周,共6周,DT 60 Gy。3D-CRT+TMZ组:放疗同上,在放疗第1天同时口服TMZ,1次/d,75 mg·m-2·d-1,共6周。放疗结束后休息4周,再接受6个周期TMZ方案,第1个周期,1次/d,150 mg·m-2·d-1,连服5 d,28 d为1个周期。第2个周期开始,200 mg·m-2·d-1,连服5 d,28 d为1个周期。结果发现替莫唑胺联合放疗较单纯放疗可延长中位生存时间2.5个月,同时2、5年生存者比例分别提高了16%、8%,充分显示了替莫作案的治疗作用和患者明显生存获益。Athanassiou等[16]研究分析了3D-CRT组:术后放疗,处方剂量,2 Gy/次,5次/周,共6周,DT 60 Gy;3D-CRT+TMZ组:放疗同上,在放疗第1天同时口服TMZ,1次/d,75 mg·m-2·d-1,共6周。放疗结束后休息4周,再接受6个周期TMZ方案,第1个周期,150 mg·m-2·d-1,同样显示了替莫唑胺联合放疗的优势。目前对于高级别的脑胶质瘤,术后放疗期间联合化疗然后进行化疗基本已达成共识,其中研究较多的其他联合药物还有贝伐单抗等效果也有优势。此外关于放疗对胶质瘤的影响因素除放疗剂量的提升外,对于手术后开始放疗的时间也很关键,一般在术后4~6周开始,不建议超过6周,应该尽早开始术后放疗。
化疗在胶质瘤治疗中的作用越来越受到重视。本组结果显示术后放疗联合替莫唑胺化疗治疗高级别胶质瘤的初步尝试,短期对方结果令人满意,但最终还需增加随访时间来证实。本组资料统计结果显示,胶质细胞瘤手术+放疗+化疗与手术+放疗相比,化疗的加入可使患者明显获益,且与化疗周期数明显有关,本研究显示化疗周期数显著影响患者的生存时间,本研究进一步将化疗周期数分为≥4周期和<4周期2组(P=0.017);将化疗周期数分为≥6周期和<6周期2组(P=0.053),考虑替莫唑胺及放疗的骨髓抑制、高级别胶质瘤治疗过程中的病情进展导致的体质消耗以及患者的经济承受能力,初步认为化疗4周期可能获益更大,因本研究样本数较少可能存在偏倚。
临床研究显示,影响脑胶质瘤术后放疗患者预后的因素较多,包括年龄、手术方式、术前癫痫、术前水肿、病灶大小、病灶位置、放疗方式、照射剂量、手术至放疗时间、级别以及术前KPS评分等因素[17]。但是否为影响患者生存的独立因素有待更大规模的研究证实。本研究提示对Ⅲ、Ⅳ级脑胶质瘤术后患者术前无癫痫发作、肿瘤切除程度、是否合并替莫唑胺化疗及化疗周期数是影响患者长期生存的独立预后因素。如何进一步提高Ⅲ、Ⅳ级脑胶质瘤患者的疗效,延缓肿瘤复发时间及延长生存时间,仍需开展大量前瞻性随机对照研究。另外Fukushima等[18]报道,脑胶质瘤细胞O6-甲基鸟嘌呤-DNA甲基转移酶(O6-methylguanineDNAmethyltransferase,MGMT)基因甲基化对烷化剂敏感,替莫唑胺治疗更有效,提示基因检测为替莫唑胺的应用提供更为有效的途径。因此建议本病还应以手术治疗为主,术中尽可能最大限度切除肿瘤,实施放疗同期或辅助联合替莫唑胺化疗可取得较好疗效。此外,本入组患者治疗期间的对症治疗措施如使用激素及降低颅内压等药物,还有根据患者的一般情况评分、病理分级程度、靶区的大小等调整放疗剂量等因素均可影响患者整个治疗过程的顺利实施,所以,对于高级别胶质瘤的治疗是一个多因素相互影响的复杂过程,需要综合患者的所有因素,综合、客观的给予患者合理的个体化治疗,使患者获益最大化。
综上所述,三维适形放射治疗联合TMZ化疗的近期疗效明显,可作为当前治疗恶性脑胶质瘤的中治疗方法。TMZ对高级别脑胶质瘤的短期疗效要优于其他同类药物,但是TMZ对高级别脑胶质瘤的长期疗效分析则未能展开。同时,是TMZ单独使用的疗效好,还是与其他药物(或治疗方式)联合使用疗效更好仍未明确,及是否会叠加毒副作用,都需要在未来开展进一步的研究才能证实。
1KleihuesP,CaveneeWK(eds).Worldhealthorganizationclassificationoftumorsofthenervoussystem.Lyon:IARCPress,2000.
2DolecekTA,ProppJM,StroupNE,etal.CBTRUSstatisticalreport:primarybrainandcentralnervoussystemtumorsdiagnosedintheUnitedStatesin2005-2009.NeuroOncol,2012,14:1-49.
3StuppR,MasonWP,vandenBentMJ,etal.Radiotherapyplusconcomitantandadjuvanttemozolomideforglioblastoma.NewEnglJMed,2005,352:987-996.
4MayoC,MartelMK,MarksLB,etal.Radiationdosevolumeeffectsofopticnervesandchiasm.IntJRadiatOncolBiolPhys,2010,76:S28eS35.
5StuppR,ReniM,GattaG,etal.Anaplasticastrocytomainadults.CritRevOncolHematol,2007,63:72-80.
6DeaN,Fournier-GosselinMP,MathieuD,etal.Doesextentofresectionimpactsurvivalinpatientsbearingglioblastoma.CanJNeurolSci,2012,39:632-637.
7YamaguchiS,KobayashiH,TerasakaS,etal.Theimpactofextentofresectionandhistologicalsubtypeontheoutcomeofadultpatientswithhigh-gradegliomas.JpnJClinOncol,2012,42:270-277.
8StewartLA.Chemotherapyinadulthigh-gradeglioma:asystematicreviewandmeta-analysisofindividualpatientdatafrom12randomisedtrials.Lancet,2002,359:1011-1018.
9IzmalovTR,Pan'shinGA,DatsenkoPV.Theroleofageandtumorgradeinthechoiceoffractionationregimeninpatientswithhigh-gradegliomas.VoprOnkol,2012,58:374-379.
10SizooEM,KoekkoekJA,PostmaTJ,etal.Seizuresinpatientswithhigh-gradeglioma:aseriouschallengeintheend-of-lifephase.BMJSupportPalliatCare,2014,4:77-80.
11ParisiS,CorsaP,RagusoA.Temozolomideandradiotherapyversusradiotherapyaloneinhighgradegliomas:averylongtermcomparativestudyandliteratureReview.BiomedresInt,2015.620643.
12StephanieE.Combs,ThomasBruckner,Jun-EtsoMizoe.Comparisonofcarbonionradiotherapytophotonradiationaloneorincombinationwithtemozolomideinpatientswithhigh-gradegliomas:Explorativehypothesis-generatingretrospectiveanalysis,RadiotherOnco,2013,108:132-135.
13MinnitiGi,ScaringiCl,DeSanctisVi,etal.Hypofractionatedstereotacticradiotherapyandcontinuouslow-dosetemozolomideinpatientswithrecurrentorprogressivemalignantgliomas.JNeurooncol,2013,111:187-194.
14ChenJW,ZhouaCF,LinZX,etal.Theinfluenceofdifferentclassificationstandardsofagegroupsonprognosisinhigh-gradehemisphericgliomapatients.JNeurolSci,2015,15:148-152.
15StuppR,MasonWP,VandenBentMJ,etal.Radiotherapyplusconcomitantandadjuvanttemozolomideforglioblastoma.NEngJMed,2005,352:987-996.
16AthanassiouH,SynodinouM,MaragoudakisE,etal.RandomizedphaseⅡstudyoftemozolomideandradiotherapycomparedwithradiotherapyaloneinnewlydiagnosedglioblastomamultiforme.JClinOncol,2005,23:2372-2377.
17YamaguchiS,KobayashiH,TerasakaS,etal.Theimpactofextentofresectionandhistologicalsubtypeontheoutcomeofadultpatientswithhigh-gradegliomasa.JpnJClinOncol,2012,42:270-277.
18FukushimaTI,TakeshimaH,KataokaH.Anti-gliomatherapywithtemozolomideandstatusoftheDNA-repairgeneMGMT.AnticancerRes,2009,29:4845-4854.
Therapeutic effects of postoperative radiotherapy combined with temozolomide chemotherapy on grade Ⅲ or Ⅳ brain glioma
JIAJinghao,WANGJing,WANGWei,etal.
DepartmentofChemoradiotherapy,People’sHospitalofTangshanCity,Hebei,Tangshan063001,China
Objective To evaluate the short-term therapeutic effects of postoperative radiotherapy combined with temozolomide chemotherapy on grade Ⅲ or Ⅳ brain glioma.Methods The clinical data about 52 patients with grade Ⅲ or Ⅳ brain glioma who were admitted and treated in our hospital from January 2011 to October 2013 were retrospectively analyzed,in which 19 patients were treated by simple radiotherapy and 33 patients were treated by radiotherapy combined with temozolomide chemotherapy.The short-term therapeutic effects were observed and compared between two groups.Results The follow-up rate was 100%.The 22 patients were followed up for at least 1 year,and 7 patients were followed up over 2 years.The 1-year and 2-year overall survival rates were 44.0%and 13.46%,respectively. The single factor analysis showed that the surgical ablation extent of tumor,with or without epilepsy seizures before surgery,radiotherapy combined with synchronization chemotherapy were main factors influencing survival time of patients (P<0.01).Themultiplefactoranalysisshowedthatthesurgicalablationextentoftumor,withorwithoutepilepsyseizuresbeforesurgery,radiotherapycombinedwithsynchronizationtemozolomidechemotherapyandchemotherapycyclenumberwereindependentinfluencingfactorsonthesurvivaltimeandprognosisofpatients. (P<0.05orP<0.01).Conclusion The postoperative radiotherapy combined with temozolomide chemotherapy has better therapeutic effects on grade Ⅲ/Ⅳ brain glioma,moreover, the surgical ablation extent of tumor,with or without epilepsy seizures before surgery,radiotherapy combined with synchronization chemotherapy and chemotherapy cycle number are important influencing factors on the survival time and prognosis of patients with malignant brain glioma.
brain neoplasms;postoperative radiotherapy;postoperative radiochemotherapy;prognosis
10.3969/j.issn.1002-7386.2017.03.004 ·论著·
063001 河北省唐山市人民医院放化二科(贾敬好、王巍、孙璐、刘卫东),放化六科(王静),放疗中心(刘建平);河北医科大学第四医院放二科(韩春)
R
A
1002-7386(2017)03-0337-05
2016-10-16)
