超声波和糖基化复合改性对小麦面筋蛋白性质和结构的影响
2017-03-31臧艳妮赵妍嫣罗水忠钟昔阳穆冬冬姜绍通
臧艳妮,赵妍嫣,罗水忠,钟昔阳,穆冬冬,姜绍通,郑 志
(合肥工业大学食品科学与工程学院,安徽省农产品精深加工重点实验室,安徽 合肥 230009)
超声波和糖基化复合改性对小麦面筋蛋白性质和结构的影响
臧艳妮,赵妍嫣,罗水忠,钟昔阳,穆冬冬,姜绍通,郑 志*
(合肥工业大学食品科学与工程学院,安徽省农产品精深加工重点实验室,安徽 合肥 230009)
采用超声波处理小麦面筋蛋白并经葡萄糖糖基化改性后,研究其溶解性和乳化性的变化,同时对改性小麦面筋蛋白的结构进行表征。结果表明,适当的超声波处理有利于小麦面筋蛋白的糖基化改性,40 kHz、300 W超声波处理40 min的小麦面筋蛋白糖基化改性效果最为显著,其在等电点处的溶解性较对照组提高了82.15%,且乳化活性及乳化稳定性最高,分别达到56.82 m2/g和36.27 min。适当的超声波处理使小麦面筋蛋白表面疏水性提高,而与葡萄糖接枝后,蛋白的表面疏水性降低。傅里叶变换红外光谱表明,小麦面筋蛋白以共价键的结合形式接入了葡萄糖分子,生成了糖蛋白。
小麦面筋蛋白;糖基化;超声波;性质;结构
小麦面筋蛋白,又称谷朊粉,是从小麦粉中提取出来的天然蛋白质,其氨基酸组成齐全,是一种营养丰富的植物蛋白[1-2]。由于小麦面筋蛋白含有较多的疏水氨基酸,导致其溶解性较差,从而影响其功能性质,限制了其应用范围[3]。
蛋白质的糖基化是依据美拉德反应(Maillardreaction)的基本原理,由蛋白质分子侧链上的自由氨基和糖分子还原末端的羰基之间发生的羰氨反应。由于该反应是由蛋白质和还原糖经加热自发进行的,不需要加入任何其他化学试剂,是一种相对理想的化学改性方式,能够有效地改善蛋白质的溶解性、乳化性、起泡性、凝胶性、热稳定性等功能性质[4-6]。由于天然的小麦面筋蛋白是一种致密的球形三维结构,一些反应基团可能被包裹在分子内部,使得蛋白分子与糖分子不能充分接触,不利于糖基化反应的进行[7]。通过对小麦面筋蛋白进行适当的预处理,可以使其结构变得松散,反应基团暴露,促进糖基化反应的发生。
近年来,超声波技术因具有操作简单、过程易控制、作用时间短等优点在食品工业中的发展正受到全世界的广泛关注[8]。超声波技术的作用机制主要是超声波在体系中产生的机械作用和空化作用[9-10]。研究表明,超声波处理能够改善蛋白质的溶解性和其他功能性质。汤虎[11]研究了超声波处理小麦面筋蛋白,发现其溶解性、乳化性能及起泡性能得到了改善。王喜波等[12]用超声波辅助琥珀酰化改性大豆蛋白,其乳化性和乳化稳定性分别提高了94.5%和268.9%。Arzeni等[13]解释并论证了超声波能够改变大豆分离蛋白、乳清蛋白和蛋清蛋白的功能性质是因为超声波使蛋白质内部的疏水基团暴露,提高了其疏水性。因此,本研究采用超声波处理小麦面筋蛋白,再对处理后的小麦面筋蛋白进行糖基化改性,研究改性前后小麦面筋蛋白溶解性和乳化性的变化,探究超声波处理结合糖基化改性提高小麦面筋蛋白功能特性的相关机制,为拓宽其应用范围提供理论依据。
1 材料与方法
1.1 材料与试剂
小麦面筋蛋白 安徽瑞福祥食品有限公司;葡萄糖国药集团化学试剂有限公司;大豆油 家乐福超市;透析袋(8 000~14 000 D) 北京Solarbio公司;2,4,6-三硝基苯磺酸(2,4,6-trinitro-benzenesulfonicacid,TNBS)、十二烷基苯硫酸钠(sodium dodecyl benzene sulfonate,SDS)、8-苯胺-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS) 美国Ameresco公司;牛血清蛋白 上海缘聚生物科技有限公司;其他化学试剂均为国产分析纯。其中小麦面筋蛋白的组成如表1所示。

表 1 小面筋蛋白的基本组成Table 1 Basic components of wheat gluten
1.2 仪器与设备
HH-2数显恒温水浴锅 国华电器有限公司;PHS-3C雷磁pH计 上海仪电科学仪器股份有限公司;MX-S涡旋混合器 美国Scilogex公司;Hop-L7粉碎机无锡赫普轻工设备公司;FD-1B-50冷冻干燥机 北京博医康实验仪器有限公司;UDK152全自动凯氏定氮仪意大利VELP公司;UV757CRT紫外-可见分光光度计北京浦西通用仪器有限责任公司;Nicolet 67傅里叶红外光谱仪 美国Thermo Nicolet公司;电泳仪 美国Bio-Rad公司。
1.3 方法
1.3.1 改性小麦面筋蛋白样品的制备
用蒸馏水配制5g/100 mL的小麦面筋蛋白悬液,室温条件下搅拌1 h使其充分分散,然后采用40 kHz、300 W的超声波处理模式处理0、10、20、30、40、50 min,分别记为WG-0、WG-10、WG-20、WG-30、WG-40、WG-50,处理过程中用冰袋将温度保持在25 ℃以下。处理结束后,一部分样品进行冷冻干燥、备用。另一部分用1 mol/L的NaOH调节pH值至12.0,室温条件下磁力搅拌1 h使其充分分散。再加入葡萄糖(葡萄糖、小麦面筋蛋白质量比为1∶1),室温条件下搅拌1 h,使小麦面筋蛋白和糖混合均匀,用1 mol/L的HCl调节pH值至10.0,放入80 ℃水浴中进行美拉德反应1 h,反应完毕后迅速转移至冰水浴中冷却至室温,于8 000 r/min离心20 min,除去不溶物。将上清液装入预先处理好的截留分子质量为8 000~14 000 D的透析袋里于4 ℃冰箱中透析24 h,以便除去实验过程中未反应的葡萄糖,用斐林试剂检测上清液中的葡萄糖是否完全除去,然后冷冻干燥,即得到糖基化小麦面筋蛋白,记为WG-G0、WG-G10、WG-G20、WG-G30、WG-G40、WG-G50。
1.3.2 指标检测
1.3.2.1 接枝度的测定
根据Lertittikula等[14]的方法稍作修饰,取125 μL糖基化样品蛋白溶液与2 mL 0.21 mol/L的磷酸盐缓冲溶液(pH 8.2)混合,再加入1 mL 0.01%的TNBS溶液,振荡混匀,在50 ℃水浴中避光反应1 h,然后再加入2 mL 0.1 mol/L Na2SO3溶液,室温冷却30 min,于420 nm波长处测定吸光度为At。以相同条件下加入125 μL未经水浴加热的小麦蛋白溶液作为空白对照,在420 nm波长处测定其吸光度A0,按式(1)计算接枝度。
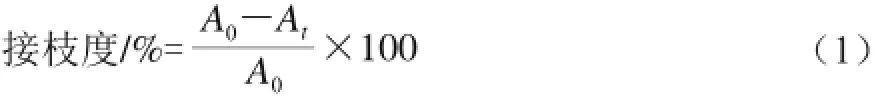
式中:A0表示未反应样品吸光度;At表示反应t时间后样品吸光度。
1.3.2.2 褐变程度的测定
参照文献[15]的方法。将待测糖基化样品蛋白用蒸馏水稀释10 倍,测定其在420 nm波长处的吸光度,以水作空白对照。
1.3.2.3 溶解性的测定
将超声波处理未糖基化的样品蛋白及糖基化样品蛋白分别溶于蒸馏水中,室温条件下磁力搅拌使其充分溶解,配制成蛋白质量浓度1 g/100 mL的样品溶液。以1 mol/L的NaOH溶液或1 mol/L的HCl溶液分别调节pH 4~10,充分振荡混匀,室温条件下于8 000 r/min离心20 min,采用考马斯亮蓝法[16]测定上清液中的蛋白含量。利用牛血清蛋白作标准曲线。根据上清液中蛋白含量与溶液中总蛋白含量比值计算糖基化产物的溶解性。
1.3.2.4 乳化性测定
参照文献[17]的方法稍作修饰。分别取24 mL 2 mg/mL超声波处理未糖基化蛋白及糖基化蛋白溶液(蛋白溶于0.2 mol/L pH 8.2磷酸盐缓冲液中),边搅拌边缓慢加入8 mL大豆油,在10 000 r/min、25 ℃条件下高速均质1 min,制备得到的乳状液分别于不同时间(0、10 min)从溶液底部取样50 μL,加到5 mL质量分数为0.1% SDS溶液中,测定500 nm波长处的吸光度(A0、A10),以SDS溶液作空白。乳化活性指数(emulsifuing activity index,EAI)和乳化稳定性指数(emulsion stanbility index,ESI)的计算公式如(2)、(3)所示:

式中:DF为稀释倍数(DF=100);C为样品质量浓度/(g/mL);φ为光程(φ=1 cm);θ为乳液中油相所占比例(θ=0.25);A0为0 min时测定的吸光度;A10为10 min时测定的吸光度。
1.3.2.5 表面疏水性测定
表面疏水性根据Mu Lixia等[18]的方法稍作修饰。取100 mg超声处理未糖基化的样品蛋白及糖基化样品蛋白分别分散于15 mL pH 7.0的0.01 mol/L磷酸盐缓冲液中,于7 000 r/min离心10 min,上清液蛋白含量由考马斯亮蓝法测得,ANS试剂(8.0 mmol/L)由上述的磷酸缓冲液配制。将上清液分别稀释1.00、0.75、0.50、0.25、0.125 倍,再取40 μL ANS试剂加到4 mL的蛋白质溶液中,选择激发波长365 nm、发射波长484 nm,测定不同质量浓度样品蛋白的荧光强度,以荧光强度对蛋白质质量浓度作曲线,将曲线的最开始的斜率定义为被检测样品的表面疏水度H0。
1.3.2.6 聚丙烯酰氨凝胶电泳
SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE)是根据Laemmli[19]的方法稍作修饰,选用12%的分离胶(pH 8.8)和5%的浓缩胶(pH 6.8)。将蛋白样品溶于0.125 mol/L Tris-HCl(pH 6.8)的缓冲液(含5% SDS、10% β-巯基乙醇、20%甘油和0.5%溴酚蓝)中,配制成20 mg/mL的样品溶液。然后在沸水浴中煮沸5 min,冷却至室温,于7 000 r/min离心15 min,取上清液10 μL上样。电泳过程采用恒压模式,电泳结束后,将凝胶分别进行考马斯亮蓝R-250染色和PAS(perodic acid schiff)反应染色[20],脱色液脱色,拍照,观察小麦面筋蛋白亚基条带变化。
1.3.2.7 红外光谱分析
准确称量2 mg的样品,按照质量比1∶100比例加入溴化钾,用研钵研磨成均匀粉末,压制成薄片,再用傅里叶变换红外光谱仪做全波段扫描(400~4 000 cm-1),扫描次数32 次。
1.4 数据处理
所有的实验进行3 次重复,数据以±s的形式表示。数据的显著性(P<0.05)通过SPSS软件进行分析。
2 结果与分析
2.1 预处理时间对糖基化反应的影响
接枝度和体系的褐变程度是衡量糖基化反应的两个重要指标。接枝度是通过测定体系中自由氨基的减少来反映美拉德反应进行的程度;褐变程度是通过测定420 nm波长处的吸光度来反映美拉德反应高级阶段产物的形成[21]。不同超声波处理时间对糖基化反应的影响如图1所示。
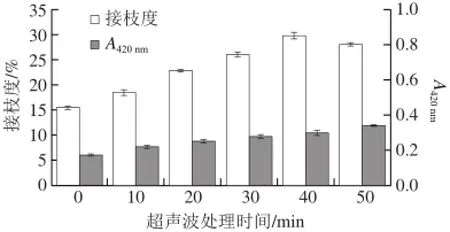
图 1 不同超声波处理时间对糖基化反应的影响Fig. 1 Effect of ultrasonic pretreatment time on the degree of glycosylation
由图1可以看出,随着超声波处理时间的延长,小麦面筋蛋白与葡萄糖的接枝度先增加后减少,在超声波处理40 min时达到最大,这是由于超声波处理时间过长,蛋白发生聚合,使得自由氨基被包埋,反应程度降低。体系的褐变程度缓慢增加,表明美拉德反应正在向着高级阶段进行。
2.2 预处理时间对改性小麦面筋蛋白在不同pH值条件下溶解性的影响
溶解性是蛋白质的一种重要的功能性质,因为它影响着蛋白质的其他功能性质。超声波处理和超声波-糖基化复合改性对小麦面筋蛋白溶解性的影响如图2所示。
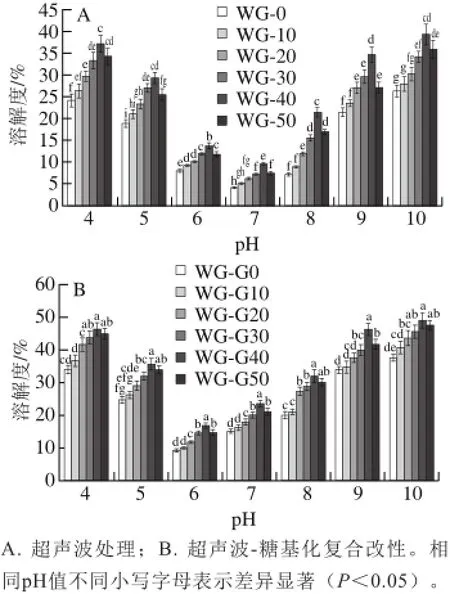
图 2 超声波处理和超声波-糖基化复合改性对小麦面筋蛋白溶解性的影响Fig. 2 Effect of ultrasonic treatment and ultrasonic-glycosylation modif i cation on the solubility of wheat gluten
由图2A可以看出,随着超声波处理时间的延长,小麦面筋蛋白在同一pH值条件下的溶解性呈现出先增加后减少的趋势,这说明适当的超声波处理能够提高小麦蛋白的溶解性。由图2B可以看出,超声波处理结合糖基化改性的小麦面筋蛋白较仅超声波处理的小麦面筋蛋白的溶解性在不同pH值条件均显著提高(P<0.05),这是由于超声波处理促进了小麦面筋蛋白与糖基进行共价结合,从而引入了较多的亲水羟基增加其溶解性[22]。经过超声波处理后结合糖基化改性的小麦面筋蛋白的溶解性随着超声波处理时间的延长呈现出先增加后减小的趋势,在超声波处理40 min时,小麦面筋蛋白糖基化产物的溶解性最高,较对照组提高了82.15%,这是由于超声波处理时间过长,使得蛋白质重新聚集,降低了其溶解性。对比图2A和图2B发现,小麦面筋蛋白的等电点发生了偏移,由pI=7变为pI=6,这可能是因为小麦面筋蛋白共价交联含有多羟基的葡萄糖,与游离氨基共价交联使其电荷发生变化,从而导致等电点发生变化[23]。
2.3 预处理时间对改性小麦面筋蛋白乳化特性的影响
乳化特性包括EAI和ESI这两个方面。EAI是蛋白质参与形成乳浊液的能力,ESI是指蛋白质能保持乳液稳定的状态,在一定时间内不会出现乳液分层、絮凝的能力[24]。不同超声波处理时间对改性小麦面筋蛋白EAI及ESI的影响如图3、4所示。
由图3和图4可知,小麦面筋蛋白仅经过超声波处理后,其乳化活性和乳化稳定性有所提升,且随着时间的延长呈现出先增加后降低的趋势。再经糖基化改性后,其乳化性和乳化稳定性均显著提高(P<0.05),且经超声波处理结合糖基化改性的小麦面筋蛋白的乳化活性及乳化稳定性在超声波处理时间为40 min时达到最大,分别为56.82 m2/g和36.27 min,较对照组显著提高(P<0.05),随着时间进一步延长乳化性、乳化稳定性降低。Dickinson等[25]研究表明:无表面活性的亲水性糖分子可以通过增强蛋白膜的厚度来提高蛋白的乳化性和乳化稳定性。适当的超声波处理时间使得小麦面筋蛋白质的结构变得较为松散,促进了糖基化反应的发生,使得糖基化产物中的亲水基团增多,提高了其乳化性。当葡萄糖以共价键连接入小麦面筋蛋白肽链中,增加了空间阻力,使得界面蛋白很难发生聚合,提高了其乳化稳定性。而过度的预处理,就会使得小麦面筋蛋白重新聚集,糖基化反应减弱,乳化活性也随之降低。
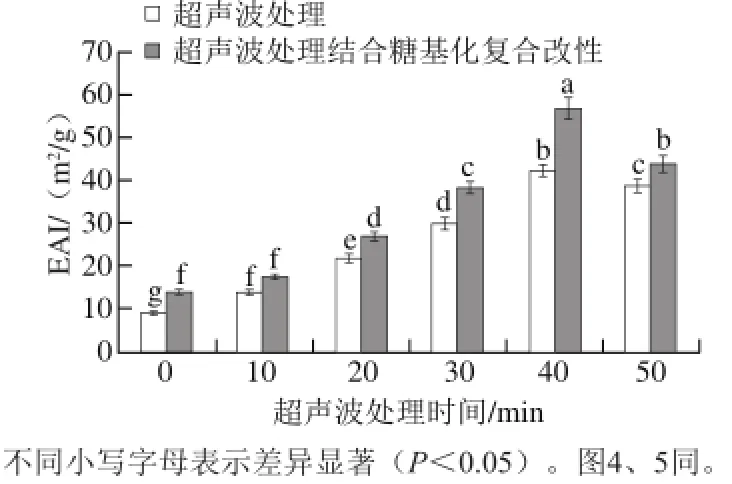
图 3 不同超声波处理时间对糖基化小麦面筋蛋白乳化活性的影响Fig. 3 Effect of ultrasonic pretreatment time on the emulsifying capacity of glycosylated wheat gluten

图 4 不同超声波处理时间对糖基化小麦面筋蛋白乳化稳定性的影响Fig. 4 Effect of ultrasonic pretreatment time on the emulsion stability of glycosylated wheat gluten
2.4 小麦面筋蛋白疏水性变化

图 5 不同超声波处理时间对小麦面筋蛋白表面疏水性的影响Fig. 5 Effect of ultrasonic pretreatment time on the surface hydrophobicity of wheat gluten
蛋白质表面疏水性是指在极性环境中蛋白质表面疏水性基团的数量,它是评价蛋白质构象改变的一个指标,且与蛋白质的功能性质密切相关。不同超声波处理时间对小麦面筋蛋白表面疏水性的影响如图5所示。
图5表明随着超声波处理时间的延长,小麦面筋蛋白的表面疏水性显著提高(P<0.05),且呈现出先升高后降低的趋势,当超声波处理时间为40 min时,小麦面筋蛋白的表面疏水性达到最大。有研究表明,超声波处理产生的机械效应以及空穴效应能破坏蛋白质的结构,使埋藏于小麦面筋蛋白内部的疏水性氨基酸暴露,提高其表面疏水性[10];当超声波处理时间超过40 min时,表面疏水性下降,导致这种现象的原因可能是长时间的超声波处理使得小麦面筋蛋白的疏水性基团过多暴露,疏水性相互作用导致了蛋白质的聚集,降低了表面疏水性[26]。本研究中还发现,与仅超声波处理的小麦面筋蛋白相比,超声波处理结合糖基化改性的小麦面筋蛋白的表面疏水性显著降低(P<0.05),这可能是由于超声波处理后的小麦面筋蛋白经糖基化反应后,产物中引入了较多的亲水性羟基,从而导致表面疏水性降低,同时也说明小麦面筋蛋白与葡萄糖发生了共价交联[27]。
2.5 SDS-PAGE分析
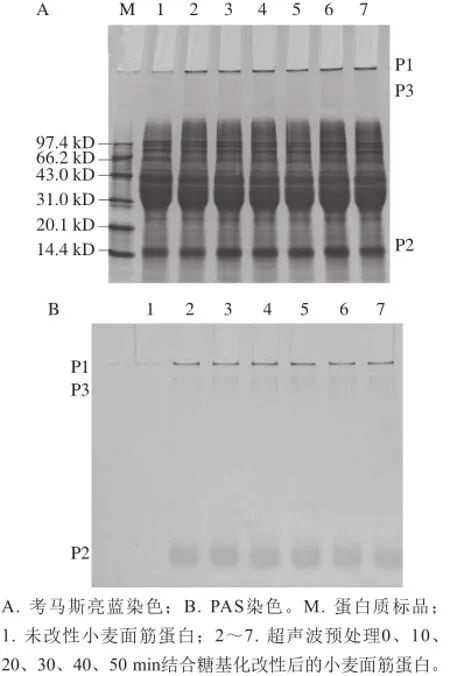
图 6 小麦面筋蛋白的SDS-PAGE图谱Fig. 6 SDS-PAGE patterns of glycosylated wheat gluten samples
SDS-PAGE用于对蛋白质的亚基及分子质量的分析。在实验中,由于超声波处理后的小麦面筋蛋白与葡萄糖共价结合后,形成了糖蛋白,对此,除了进行考马斯亮蓝染色显示蛋白质外,还用PAS与接枝物中的葡萄糖分子进行颜色反应,从而检测糖分子的存在。
图6中的还原性SDS-PAGE反映不同超声波处理时间结合糖基化改性的小麦面筋蛋白各亚基条带的变化。图6A中可以发现经过超声波处理结合糖基化改性小麦面筋蛋白在P1和P3处新增了两个条带,产生这种现象的原因是糖基化反应的热处理过程中,部分小麦面筋蛋白亚基发生聚集形成了分子质量更大的条带,在电泳时这些大分子质量的蛋白质条带由于不能通过浓缩胶和分离胶而积累在P1和P3处,这与程熙茜[28]的电泳结果相一致。在图6A中P2处,对比亚基条带的光密度值可以发现,光密度值随着超声波处理时间的延长逐渐增强,表明超声波处理结合糖基化改性的小麦面筋蛋白反应中有分子量为14.4 kD左右的分子形成。同时在图6B中的P1、P2和P3处也出现了红色的糖基谱带,说明小麦面筋蛋白与葡萄糖发生了共价结合,生成了糖蛋白。
2.6 傅里叶变换红外光谱分析
傅里叶变换红外光谱是分析蛋白结构的一种很有效的方法,它依据蛋白分子中的不同化学键或官能团对红外光的吸收以及振动频率不同,从而反映出蛋白分子的结构。蛋白质红外光谱图谱的特征吸收谱带主要是位于1 650、1 540 cm-1处的酰胺Ⅰ带和Ⅱ带,一些由C—C、C=O和C—H键的伸缩振动引起的交叉重叠带主要位于1 180~953 cm-1处,这些谱带通常被认为是糖类的重要特征带[29]。不同超声波处理时间结合糖基化改性小麦面筋蛋白表的傅里叶变换红外谱图如图7所示。

图 7 小麦面筋蛋白傅里叶变换红外光谱分析Fig. 7 FTIR analysis of glycosylated wheat gluten
图7表明,超声波处理小麦面筋蛋白的糖基化产物在3 700~3 200 cm-1及1 200~900 cm-1处吸收峰强度较未超声处理小麦面筋蛋白的糖基化产物有不同程度的增加,尤其是超声波处理40 min的小麦面筋蛋白糖基化产物的吸收峰增强,这说明超声处理对于小麦面筋蛋白的糖基化反应有着明显的促进作用。当蛋白质与糖发生共价交联后,蛋白质中的羟基含量增加,其红外光谱表现为羟基的特征吸收增强,上述两处谱带范围分别是游离羟基和极性的C=O键伸缩振动的范围,由此可以证明,小麦面筋蛋白与葡萄糖发生了共价交联[30],这与Srivastava[31]和Wang Wenqiong[15]等的研究结果相一致。此外,图中在1 540 cm-1处的吸收峰增强,这是因为蛋白质引入糖分子造成了N—H键的伸缩振动[32]。以上各种现象均表明小麦面筋蛋白与葡萄糖发生了共价交联。
对去酰胺Ⅰ带的谱带进行了如下归属:1 650~1 660 cm-1为α-螺旋,1 610~1 640 cm-1和1 670~1 690 cm-1为β-折叠,1 660~1 670 cm-1和1 690~1 700 cm-1为β-转角,1 640~1 650 cm-1为无规则卷曲结构[33]。对傅里叶变换红外光谱中的去酰胺Ⅰ带进行去卷积,然后进行二阶导数拟合的结果,针对各峰所对应的归属,计算出不同超声波处理时间的糖基化小面蛋白的各种二级结构所占的比例如表2所示。

表 2 改性面筋蛋白二级结构的变化Table 2 Change in secondary structure of modif i ed gluten proteins
从表2可以发现,未经改性的小麦面筋蛋白主要以β-折叠为主,通过超声波处理(40 min)结合糖基化改性后,小麦面筋蛋白的α-螺旋结构的含量由22.51%下降为16.33%,β-折叠和无规则卷曲结构的含量分别由37.21%和22.00%增加为40.33%和25.09%,β-转角结构的含量基本不变。这说明,超声波处理结合糖基化改性的小麦面筋蛋白基本是由α-螺旋结构的解螺旋转换成β-折叠和无规则卷曲结构,这与蔺海鑫等[6]的研究结果一致。由于α-螺旋结构过于稳定,不利于功能特性所需要的某种构象变化,β-折叠结构和无规则卷曲结构较α-螺旋结构而言,构象稳定性差,但蛋白质的柔韧性明显改善,有利于发挥蛋白质的功能特性。Kato等[34]研究表明蛋白分子柔性越大,乳化性越好。研究发现,WG-G40样品中的α-螺旋与β-折叠的比例为0.40,显著低于WG-G0样品中的0.61(P<0.05),这说明超声波处理结合糖基化改性的小麦面筋蛋白在引入糖分子后,使小麦面筋蛋白的二级结构发生改变,蛋白分子柔韧性变强,接枝物的溶解性和乳化特性也得到较大的改善。与WG-G0相比,超声波处理辅助糖基化制备的接枝物二级结构变化更加显著,从而进一步改善了接枝物的功能特性。
3 结 论
本实验研究了超声波和糖基化复合改性对小麦面筋蛋白功能特性及其结构的影响。结果表明:1)适当的超
声波预处理结合糖基化复合改性小麦面筋蛋白,可以提高其溶解性及乳化特性,其中超声波处理时间为40 min时,溶解性最好,且乳化性及乳化稳定性达到最高,分别为56.82 m2/g和36.27 min;2)表面疏水性测定表明,适当的预处理能够使小麦面筋蛋白的结构变得松散,疏水基团暴露,提高其表面疏水性,而与糖接枝后,引入了较多的亲水性羟基,从而导致表面疏水性下降;3)傅里叶变换红外光谱表明小麦面筋蛋白与葡萄糖发生了共价交联,且超声波处理对小麦面筋蛋白糖基化反应具有促进作用。
[1] 付博菲, 刘晓, 徐绍建, 等. 谷朊粉的功能特性及改性研究[J]. 中国食物与营养, 2012, 18(11): 35-37. DOI:10.3969/ j.issn.1006-9577.2012.11.010.
[2] WIESER H. Chemistry of gluten proteins[J]. Food Microbiology, 2007, 24(2): 115-119. DOI:10.1016/j.fm.2006.07.004.
[3] DAY L, AUGUSTIN M A, BATEY I L, et al. Wheat-gluten uses and industry needs[J]. Trends in Food Science & Technology, 2006, 17(2): 82-90. DOI:10.1016/j.tifs.2005.10.003.
[4] LI Y, LU F, LUO C R, et al. Functional properties of the Maillard reaction products of rice protein with sugar[J]. Food Chemistry, 2009, 117(1): 69-74. DOI:10.1016/j.foodchem.2009.03.078.
[5] ZHANG B, CHI Y J, LI B. Effect of ultrasound treatment on the wet heating Maillard reaction between β-conglycinin and maltodextrin and on the emulsifying properties of conjugates[J]. European Food Research & Technology, 2014, 238(1): 129-138. DOI:10.1007/s00217-013-2082-y.
[6] 蔺海鑫, 林洪, 王晓斐, 等. 美拉德反应对菲律宾蛤仔原肌球蛋白结构及免疫活性的影响[J]. 食品科学, 2016, 37(3): 22-26. DOI:10.7506/spkx1002-6630-201603005.
[7] MATSUDOMI N, INOUE Y, NAKASIMA H, et al. Emulsion stabilization by Maillard-type covalent complex of plasma protein with galactomannan[J]. Journal of Food Science, 1995, 60(2): 265-268. DOI:10.1111/j.1365-2621.1995.tb05652.x.
[8] CHEN L, CHEN J S, REN J Y, et al. Effects of ultrasound pretreatment on the enzymatic hydrolysis of soy protein isolates and on the emulsifying properties of hydrolysates[J]. Journal of Agricultural amd Food Chemistry, 2011, 59(6): 2600-2609. DOI:10.1021/ jf103771x.
[9] JAMBRAK A R, HERCEG Z, ŠUBARIĆ D, et al. Ultrasound effect on physical properties of corn starch[J]. Carbohydrate Polymers, 2010, 79(1): 91-100. DOI:10.1016/j.carbpol.2009.07.051.
[10] 毕爽, 马文君, 李杨, 等. 脉冲电场-超声波作用对黑豆球蛋白功能性质的影响[J]. 食品科学, 2016, 37(9): 7-12. DOI:10.7506/spkx1002-6630-201609002.
[11] 汤虎. 超声波及琥珀酰化法改性小麦面筋蛋白的研究[D]. 武汉: 华中农业大学, 2008: 9-19.
[12] 王喜波, 迟玉杰, 胥伟. 超声辅助琥珀酰化改性大豆蛋白研究[J]. 东北农业大学学报, 2011, 42(5): 6-14. DOI:10.3969/ j.issn.1005-9369.2011.05.002.
[13] ARZENI C, MARTINZ K, ZEMA P, et al. Comparative study of high intensity ultrasound effects on food proteins functionality[J]. Journal of Food Engineering, 2012, 108(3): 463-472. DOI:10.1016/ j.jfoodeng.2011.08.018.
[14] LERTITTIKUL W, BENJAKUL S, TANAKA M. Characteristics and antioxidative activity of Maillard reaction products from a porcine plasma protein-glucose model system as influenced by pH[J]. Food Chemistry, 2007, 100(2): 669-677. DOI:10.1016/ j.foodchem.2005.09.085.
[15] WANG W Q, BAO Y H, CHEN Y. Characteristics and antioxidant activity of water-soluble Maillard reaction products from interactions in a whey protein isolate and sugars system[J]. Food Chemistry, 2013, 139(1): 355-361. DOI:10.1016/j.foodchem.2013.01.072.
[16] 王爱军, 王凤山, 王友联, 等. 低浓度蛋白质含量测定方法的研究[J]. 中国生化药物杂志, 2003, 24(2): 78-80. DOI:10.3969/ j.issn.1005-1678.2003.02.009.
[17] TANG S, HETTIARACHCHY N S, HORAX R, et al. Physicochemical properties and functionality of rice bran protein hydrolyzate prepared from heat-stabilized defatted rice bran with the aid of enzymes[J]. Journal of Food Science, 2003, 68(1): 152-157. DOI:10.1111/j.1365-2621.2003.tb14132.x.
[18] MU L X, ZHAO M M, YANG B, et al. Effect of ultrasonic treatment on the graft reaction between soy protein isolate and gum acacia and on the physicochemical properties of conjugates[J]. Journal of Agricultural and Food Chemistry, 2010, 58(7): 4494-4499. DOI:10.1021/jf904109d.
[19] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227: 680-685. DOI:10.1038/227680a0.
[20] ZACHARIUS R M, ZELL T E, MORRISON J H, et al. Glycoprotein staining following electrophoresis on acrylamide gels[J]. Analytical Biochemistry, 1969, 30(1): 148-152.
[21] 任仙娥, 杨锋, 曹燕, 等. 糖基化改性对谷朊粉功能性质的影响[J].粮食与饲料工业, 2013(4): 30-33.
[22] 许彩虹, 于淑娟, 杨晓泉. 糖基化对大豆7S球蛋白凝胶流变性质的影响(Ⅱ)[J]. 现代食品科技, 2010, 26(12): 1293-1296. DOI:10.3969/ j.issn.1673-9078.2010.12.001.
[23] 王军, 王忠合, 宋凤艳, 等. 糖基化反应对鸡蛋清蛋白与低聚麦芽糖交联物活性和功能性的影响[J]. 现代食品科技, 2014, 30(10): 24-29. [24] 毕伟伟. 微波对酪蛋白的糖基化反应及产物功能性质的研究[D]. 哈尔滨: 东北农业大学, 2015: 61-63.
[25] DICKINSON E. Hydrocolloids at interfaces and the inf l uence on the properties of dispersed systems[J]. Food Hydrocolloids, 2003, 17(1): 25-39. DOI:10.1016/S0268-005X(01)00120-5.
[26] ZHANG H H, LI Q, CLAVER I P, et al. Effect of cysteine on structural, rheological properties and solubility of wheat gluten by enzymatic hydrolysis[J]. International Journal of Food Science and Technology, 2010, 45(10): 2155-2161. DOI:10.1111/j.1365-2621.2010.02384.x.
[27] GALAZKA V, SMITH D, LEDWARD D, et al. Interactions of ovalbumin with sulphated polysaccharides: effects of pH, ionic strength, heat and high pressure treatment[J]. Food Hydrocolloids, 1999, 13(2): 81-88. DOI:10.1016/S0268-005X(98)00073-3.
[28] 程熙茜. 超声辅助湿热法制备大豆分离蛋白糖接枝物[D]. 无锡: 江南大学, 2012: 30-31.
[29] ICONOMIDOU V A, CHRYSSIKOS D G, GIONIS V, et al. Secondary structure of chorion proteins of the teleostean fish Dentex dentex, by ATR FT-IR and FT-Raman spectroscopy[J]. Journal of Structural Biology, 2000, 132(2): 112-122. DOI:10.1006/jsbi.2000.4307.
[30] 林花. 牛血清白蛋白-葡聚糖接枝改性及机理研究[D]. 广州: 华南理工大学, 2010: 26-29.
[31] SRIVASTAVA A K, ICONOMIDOU V A, CHRYSSIKOS G D, et al. Secondary structure of chorion proteins of the Lepidoptera Pericallia ricini and Ariadne merione by ATR FT-IR and micro-Raman spectroscopy[J]. International Journal of Biological Macromolecules, 2011, 49(3): 317-322. DOI:10.1016/j.ijbiomac.2011.05.006.
[32] LI W W, ZHAO H B, HE Z Y, et al. Modification of soy protein hydrolysates by Maillard reaction: effects of carbohydrate chain length on structural and interfacial properties[J]. Colloids & Surfaces B Biointerfaces, 2015, 138: 70-77. DOI:10.1016/j.colsurfb.2015.11.038.
[33] KAO F J, SU N W, LEE M H. Effect of calcium sulfate concentration in soymilk on the microstructure of firm tofu and the protein constitutions in tofu whey[J]. Journal of Agricultural and Food Chemistry, 2003, 51(21): 6211-6216. DOI:10.1021/jf0342021.
[34] KATO A, KOMATSU K, FUJIMOTO K, et al. Relationship between surface functional properties and f l exibility of proteins detected by the protease susceptibility[J]. Journal of Agricultural and Food Chemistry, 1985, 33(5): 931-934. DOI:10.1021/jf00065a039.
Effect of Ultrasonic Treatment and Glycosylation Modif i cation on Characteristics and Structure of Wheat Gluten
ZANG Yanni, ZHAO Yanyan, LUO Shuizhong, ZHONG Xiyang, MU Dongdong, JIANG Shaotong, ZHENG Zhi*
(Key Laboratory for Agriculture Products Processing of Anhui Province, School of Food Science and Engineering, Hefei University of Technology, Hefei 230009, China)
Wheat gluten was glycosylated with glucose after ultrasonic pre-treatment to investigate changes in solubility and emulsifying activity. Meanwhile, the structural properties of glycosylated wheat gluten were characterized. Results indicated that appropriate ultrasonic pretreatment facilitated the glycosylation of wheat gluten. It was found that the glycosylation of wheat gluten with 40 min ultrasonic pretreatment at 40 kHz, 300 W signif i cantly improved its solubility at the isoelectric point by 82.15% compare to the control group. In addition, the emulsifying capacity and emulsion stability reached the maximum level of 56.82 m2/g and 36.27 min, respectively. Appropriate ultrasonic pretreatment could increase the surface hydrophobicity (H0) of wheat gluten, while it decreased after grafting with glucose. Fourier transform infrared spectroscopy indicated that wheat gluten grafted with glucose through covalent bonds to form glycoprotein.
wheat gluten; glycosylation; ultrasonic; characteristics; structure
10.7506/spkx1002-6630-201705020
TS213.2
A
1002-6630(2017)05-0122-07
臧艳妮, 赵妍嫣, 罗水忠, 等. 超声波和糖基化复合改性对小麦面筋蛋白性质和结构的影响[J]. 食品科学, 2017, 38(5): 122-128. DOI:10.7506/spkx1002-6630-201705020. http://www.spkx.net.cn
ZANG Yanni, ZHAO Yanyan, LUO Shuizhong, et al. Effect of ultrasonic treatment and glycosylation modification on characteristics and structure of wheat gluten[J]. Food Science, 2017, 38(5): 122-128. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201705020. http://www.spkx.net.cn
2016-06-29
国家高技术研究发展计划(863计划)项目(2013AA102201);安徽省科技攻关项目(1301031031);
安徽省科技攻关重大专项(1301031031;16030701082)
臧艳妮(1990—),女,硕士研究生,研究方向为食品资源综合利用。E-mail:zangyanni@mail.hfut.edu.cn
*通信作者:郑志(1971—),男,教授,博士,研究方向为谷物科学。E-mail:zhengzhi@hfut.edu.cn
