HMGB1在扁平苔藓皮损中的异常分布
2017-03-31段姣雄李劲然毕黎琦朱明姬
段姣雄,辛 然,李劲然,毕黎琦,朱明姬*
(吉林大学中日联谊医院 1.皮肤科;2.医疗保险管理部;3.风湿免疫科,吉林 长春130033)
*通讯作者
HMGB1在扁平苔藓皮损中的异常分布
段姣雄1,辛 然2,李劲然1,毕黎琦3,朱明姬1*
(吉林大学中日联谊医院 1.皮肤科;2.医疗保险管理部;3.风湿免疫科,吉林 长春130033)
高迁移率族蛋白1(HMGB1)是体内细胞处于稳态时,普遍存在于哺乳动物细胞核内的非组蛋白染色体结合蛋白,主要参与基因调节和转录[3]。当外界有适当的信号刺激细胞时,HMGB1赖氨酸残基被乙酰化,然后释放到细胞外,参与炎症反应。已有研究表明HMGB1在各种炎症性和自身免疫性疾病如系统性红斑狼疮(SLE)[2-5]、类风湿关节炎(RA)[6-8]、寻常型银屑病(Psoriasis Vulgaris)、特应性皮炎(atopic dermatitis)[9]中发挥重要作用。但其在扁平苔藓发病机制中的作用未见报道,本研究探讨了HMGB1在扁平苔藓中的分布特点。
1 材料和方法
1.1 石蜡标本
收集吉林大学中日联谊医院皮肤科2014-2015年具有完整资料的扁平苔藓存档石蜡标本19例,分别是经典型6例、急性泛发性3例、肥厚性3例、毛囊性1例、反向性2例、萎缩性2例、色素性2例。正常皮肤9例。
扁平苔藓诊断基于临床和组织病理学标准。标本采集前3周内患者接受放射或免疫治疗的排除在外。正常皮肤标本取自9名外科手术后正常皮肤。每个标本进行病理学苏木精-伊红染色检查,这项研究由吉林大学白求恩医学部临床研究伦理委员会批准。
1.2 方法
Anti-HMGB1抗体 (ab79823 Abcam 美国)。免疫组化方法按试剂盒说明书操作。
1.3 结果分析
分别以细胞核、细胞浆(或细胞外)出现黑褐色或棕褐色颗粒为强阳性表达,棕黄色颗粒为阳性染色,浅黄色为弱阳性,无色为阴性表达,随机观察5个具有代表性的高倍镜视野,阳性细胞(强阳性+阳性)百分比为5个视野阳性细胞百分比的平均数。采用SPSS19.0版本,计量资料采用t检验。
2 结果
HMGB1在正常皮肤及扁平苔藓皮损中的分布(见图1、图2)。在9例正常皮肤组织中,HMGB1在表皮细胞核中呈强阳性,表皮细胞核阳性细胞比率约为57 %,在19例扁平苔藓皮损中,表皮细胞核阳性细胞比率约为39%。HMGB1在正常表皮细胞浆及细胞间隙为阴性;在19例扁平苔藓表皮细胞胞浆及细胞间隙可见阳性分布,阳性分布主要位于扁平苔藓皮损基底层液化变性区域外围即扁平苔藓皮损正常区域到基底层细胞完全液化变性前的区域。

在正常皮肤中,多数角质形成细胞细胞核强阳性表达,细胞浆及细胞间隙为阴性
图1 正常皮肤组织HMGB1 免疫组化组织病理像(a:×100 b:×400)
3 讨论
扁平苔藓作为一种由T 细胞介导的自身免疫反应性疾病[10],多种炎性介质参与了LP的发病[11]。 HMGB1在扁平苔藓角质形成细胞核中减少,胞浆及细胞外增多。急性泛发性LP、肥厚性 LP、反向性LP、毛囊LP及唇黏膜LP皮损内明显,扁平苔藓皮损基底层液化变性区域外围即扁平苔藓皮损正常区域到基底层细胞完全液化变性前的区域胞浆及细胞外增多明显,基底层完全液化变性甚至消失处细胞核中减少。
HMGB1在扁平苔藓皮损胞浆中增多可能是作为一种致炎因子由细胞核迁移到细胞浆、进而释放到细胞外,参与局部或全身炎症反应。表皮角质形成细胞中的HMGB1由细胞核释放到胞浆而引起核中量减少,提示LP中细胞外HMGB1主要来源于角质形成细胞的释放,且其表达在炎症过程存在动态变化,随着炎症反应阶段、范围的不同而发生量及分布部位的改变。在LP早期,角质形成细胞因各种刺激主动释放HMGB1,HMGB1在角质形成细胞胞浆及细胞外增多,与下游的表达增高的受体TLR2、TLR4、TLR9[12,13]、CXCR4[14]等结合后,促进T细胞趋化作用、炎症反应。随着炎症进展,导致角质形成细胞损伤、凋亡,基底层液化变性,HMGB1再次释放,形成正反馈。角质形成细胞核、胞浆及细胞外表达较前明显减少。当炎症反应渐渐消退,皮损进入恢复阶段,HMGB1在表皮中的分布渐渐趋于正常。
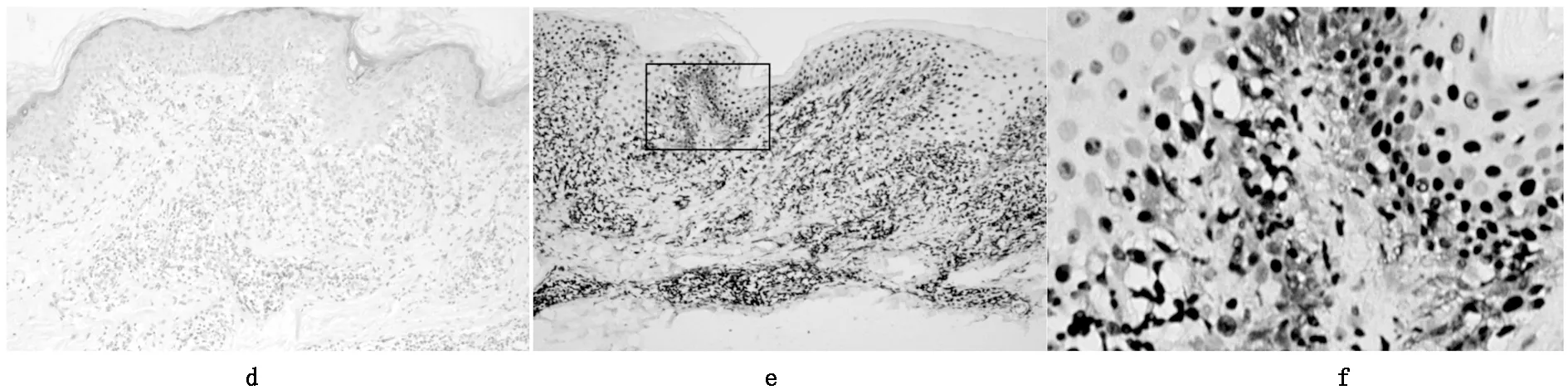
扁平苔藓皮损中HMGB1在角质形成细胞胞核阳性、胞浆、细胞间隙表达仍阳性
此外,HMGB1 参与调节Treg 细胞的活化及迁移趋化[4,15]以及Treg 细胞诱导的Th1向Th2细胞的漂移[16],这可能也与LP皮损中Foxp3的异常增多[17]及口腔LP患者血清及唾液中IFN -γ/IL-4降低[18]有关。
由此看来,阻断HMGB1的释放可能是治疗LP的有效途径。目前,已知能阻断HMGB1释放的物质近100种[19],其中甘草甜素[20,21]等在治疗LP时的确获得了较好的疗效。
本研究首次探讨了HMGB1在LP皮损中表达及分布情况,我们认为HMGB1在LP皮损角质形成细胞胞浆中的增多是LP的发病过程中非常重要的环节,HMGB1在扁平苔癣的发病机制中起非常重要的作用,其确切的机制有待进一步研究。阻断HMGB1的释放可能是治疗LP的有效途径。
[1]Einck L,Bustin M.The intracellular distribution and function of the high mobility group chromosomal proteins[J].Experimental cell research,1985,156(2):295.
[2]Abdulahad DA,Westra J,Reefman E,et al.High mobility group box1 (HMGB1) in relation to cutaneous inflammation in systemic lupus erythematosus (SLE)[J].Lupus,2013,22(6):597.
[3]Cully M.Connective tissue diseases:HMGB1 helps elicit anti-dsDNA antibody production in SLE[J].Nature reviews Rheumatology,2013,9(6):321.
[4]Wild CA,Brandau S,Lotfi R,et al.HMGB1 is overexpressed in tumor cells and promotes activity of regulatory T cells in patients with head and neck cancer[J].Oral oncology,2012,48(5):409.
[5]Pisetsky DS.The complex role of DNA,histones and HMGB1 in the pathogenesis of SLE[J].Autoimmunity,2014,47(8):487.
[6]Taniguchi N,Kawahara K,Yone K,et al.High mobility group box chromosomal protein 1 plays a role in the pathogenesis of rheumatoid arthritis as a novel cytokine[J].Arthritis and rheumatism,2003,48(4):971.
[7]Zuo XX,Zhou YO,Gong YH,et al.Expression of high mobility group box chromosomal protein 1 in peripheral blood of patients with rheumatoid arthritis[J].Zhonghua nei ke za zhi,2007,46(7):547.
[8]Andersson U,Erlandsson-Harris H.HMGB1 is a potent trigger of arthritis[J].Journal of internal medicine,2004,255(3):344.
[9]Chen T,Guo ZP,Li L,et al.Increased HMGB1 serum levels and altered HMGB1 expression in patients with psoriasis vulgaris[J].Archives of dermatological research,2013,305(3):263.
[10]Sugerman PB,Savage NW,Walsh LJ,et al.The pathogenesis of oral lichen planus[J].Critical reviews in oral biology and medicine,2002,13(4):350.
[11]Kurago ZB.Etiology and pathogenesis of oral lichen planus:an overview[J].Oral Surg,Oral Medi Oral Pathol Oral Radiol,2016,122(1):72.
[12]Siponen M,Kauppila JH,Soini Y,et al.TLR4 and TLR9 are induced in oral lichen planus[J].Journal of oral pathology & medicine,2012,41(10):741.
[13]Ohno S,Tateishi Y,Tatemoto Y,et al.Enhanced expression of Toll-like receptor 2 in lesional tissues and peripheral blood monocytes of patients with oral lichen planus[J].The Journal of dermatology,2011,38(4):335.
[14]Ichimura M,Hiratsuka K,Ogura N,et al.Expression profile of chemokines and chemokine receptors in epithelial cell layers of oral lichen planus[J].Journal of oral pathology & medicine,2006,35(3):167.
[15]Wild CA,Bergmann C,Fritz G,et al.HMGB1 conveys immunosuppressive characteristics on regulatory and conventional T cells[J].International immunology,2012,24(8):485.
[16]Zhang Y,Yao YM,Huang LF,et al.The potential effect and mechanism of high-mobility group box 1 protein on regulatory T cell-mediated immunosuppression[J].Journal of interferon & cytokine research,2011,31(2):249.
[17]Tao XA,Xia J,Chen XB,et al.FOXP3 T regulatory cells in lesions of oral lichen planus correlated with disease activity[J].Oral diseases,2010,16(1):76.
[18]Liu WZ,He MJ,Long L,et al.Interferon-gamma and interleukin-4 detected in serum and saliva from patients with oral lichen planus[J].International journal of oral science,2014,6(1):22.
[19]Schiraldi M,Raucci A,Munoz LM,et al.HMGB1 promotes recruitment of inflammatory cells to damaged tissues by forming a complex with CXCL12 and signaling via CXCR4[J].The Journal of experimental medicine,2012,209(3):551.
[20]Nagao Y,Sata M,Tanikawa K,et al.A case of oral lichen planus with chronic hepatitis C successfully treated by glycyrrhizin[J].Kansenshogaku zasshi,1995,69(8):940.
[21]Da Nagao Y,Sata M,Suzuki H,et al.Effectiveness of glycyrrhizin for oral lichen planus in patients with chronic HCV infection[J].Journal of gastroenterology,1996,31(5):691.
1007-4287(2017)03-0488-03
2016-05-09)
