经典干细胞标志物CD34、PDGF-βR 、VEGF-R2在早孕蜕膜组织中的表达研究
2017-03-29郎福地郭丽群孙欣杨舒奇孙敬霞田海黄明莉
郎福地 郭丽群 孙欣 杨舒奇 孙敬霞 田海 黄明莉
干细胞是一类具有自我复制能力的多潜能细胞,根据干细胞所处的发育阶段可分为胚胎干细胞和成体干细胞,在一定条件下,它可以分化为多种功能细胞。儿童和成人组织中存在的多能干细胞统称成体干细胞,是组织或器官特异性的干细胞,拥有自我更新、多向分化及高度增殖的潜能,以及集落形成或克隆单位形成能力。近年来的研究,人们发现子宫内膜存在干细胞,早孕的蜕膜来源于子宫内膜[1]。据此,本研究推测早孕期蜕膜组织也可能存在干细胞,通过流式细胞仪检测CD34、PDGF-βR、VEGF-R2这些经典干细胞标记物在早孕蜕膜组织的表达含量,采用双染法、三染法探讨其相互关系,旨在探索干细胞在早孕期蜕膜组织的作用。
材料与方法
一、试剂及仪器
1.主要试剂及仪器:FITC Mouse Anti-Human CD34(BD公司,货号555821),PE Mouse Anti-Human PDGF ReceptorβBD(100Tests,2.0 ml,原液纯度100%,BD公司,货号558821,批号:6091779,有效期至2021-02-28),APC Mouse Anti-Human VEGF-R2(100Tests,2.0 ml,原液纯度100%,BD公司,货号560495,批号:5061833,有效期至2016-02-29),FITC Mouse IgG1 k Isotype control(100Tests,2.0 ml,原液纯度100%,BD公司,货号555748,批号:88030,有效期至2016-06-30),PE Mouse IgG2a k Isotype control(100Tests,2.0 ml,原液纯度100%,BD公司,货号555574,批号:5064504,有效期至2020-12-31),胶原酶IV(0.1mg,浓度:0.2%,GIBCO公司,货号17104019,批号:5153811,有效期至2021-03-31),DNA酶I (0.1mg,浓度:0.1%,Sigma公司,货号D5025),胰酶(100ml,碧云天公司,货号C0201),流式细胞仪(BD公司,Canto II型),其他相关仪器由哈尔滨医科大学黑龙江省心肌缺血重点实验室提供。
2.实验标本采集:标本为2015年7月—2016年1月在哈尔滨医科大学附属第一医院提取早孕6~8周行人工流产术的早孕蜕膜组织(n=16例,患者年龄在20~35岁且均无内膜疾病病史,近期内无服用激素类药物史),提取过程中避免将绒毛组织带入蜕膜中,立即置入盛有0.9%冷生理盐水的无菌组织瓶中,低温保存转移至实验室,在超净台内将新鲜蜕膜组织用磷酸缓冲盐溶液(phosphate buffer saline,PBS)反复冲洗,除去血凝块,经反复冲洗后,显微镜下观察,其制成的病理切片,证实为蜕膜组织。后用此方法获取组织,经过反复消化获得蜕膜组织细胞。本实验经哈尔滨医科大学附属第一医院伦理委员会审核通过。
3.实验细胞获取:标本为2015年7月—2015年10月在哈尔滨医科大学附属第一医院选取末次月经及彩超证实为6~8周正常早孕行人工流产手术患者的子宫蜕膜组织,患者年龄在20~35岁且均无子宫内膜疾病相关病史。无菌条件下在手术室取新鲜的蜕膜组织(n=16),立即置于盛有冷生理盐水的无菌瓶中,迅速转移至实验室,在超净操作台中进行原代细胞分离获得。
二、实验方法
1.早孕蜕膜组织来源的原代细胞提取及干细胞标志物的检测:提取的早孕蜕膜组织标本无菌操作台上经PBS反复冲洗、除去血凝块,经反复冲洗后,显微镜下观察,其制成的病理切片,证实为蜕膜组织。后用此方法获取组织,经过反复消化、离心收集蜕膜组织单细胞悬液,通过细胞计数法计数,每组用于流式细胞仪检测的样本细胞量为2×106个,置于PBS中吹打混匀。单染法中,采用FITC Mouse Anti-Human CD34,PE Mouse Anti-Human PDGF Receptorβ,APC Mouse Anti-Human VEGF-R2加入对应的同型对照抗体FITC Mouse IgG1 k Isotype control,PE Mouse IgG2a k Isotype control,进行避光孵育30 min;双染法中采用FITC Mouse Anti-Human CD34 和PE Mouse Anti-Human PDGF Receptorβ抗体进行避光孵育30 min;三染法中采用FITC Mouse Anti-Human CD34 ,PE Mouse Anti-Human PDGF Receptorβ和APC Mouse Anti-Human VEGF-R2进行避光孵育30 min。用500 ul PBS冲洗后,置于离心机中离心(3 000 r,5 min),去上清;以上过程重复三遍,加入500 μl 1%多聚甲醛进行固定即可上机于流式细胞仪中进行检测。若不能立即上机检测,应放置4 ℃冰箱避光保存,48 h内进行检测。
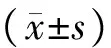
结 果
一、CD34、PDGF-βR、VEGF-R2在早孕蜕膜组织的含量
CD34、PDGF-βR、VEGF-R2在早孕蜕膜组织都有表达,其含量分别为(0.81±1.07)%,(9.94±7.36)%,(0.90±1.19)%。见图1。
二、双染法观察
CD34不仅表达于干细胞,而且表达于内皮细胞,因此,本实验进一步采用双染法分析早孕蜕膜组织CD34和VEGF-R2的表达含量。CD34+/VEGF-R2+的细胞含量为(0.16±0.1)%,CD34+/ VEGF-R2 -的细胞含量为(0.59±0.61)%。见图2。
三、三染法观察在早孕蜕膜组织中CD34、PDGF-βR、VEGF-R2表达的相互关系
CD34+/ VEGF-R2+/ PDGF-βR+的细胞含量为(0.09±0.06)%,CD34+/ VEGF-R2-/ PDGF-βR+表达量为(0.15±0.13)%。(见图3)。CD34阳性的细胞群中,表现为PDGF-βR+的细胞多数为VEGF-R2阴性的细胞。

图1 早孕蜕膜组织中CD34、PDGF-βR、VEGF-R2的含量
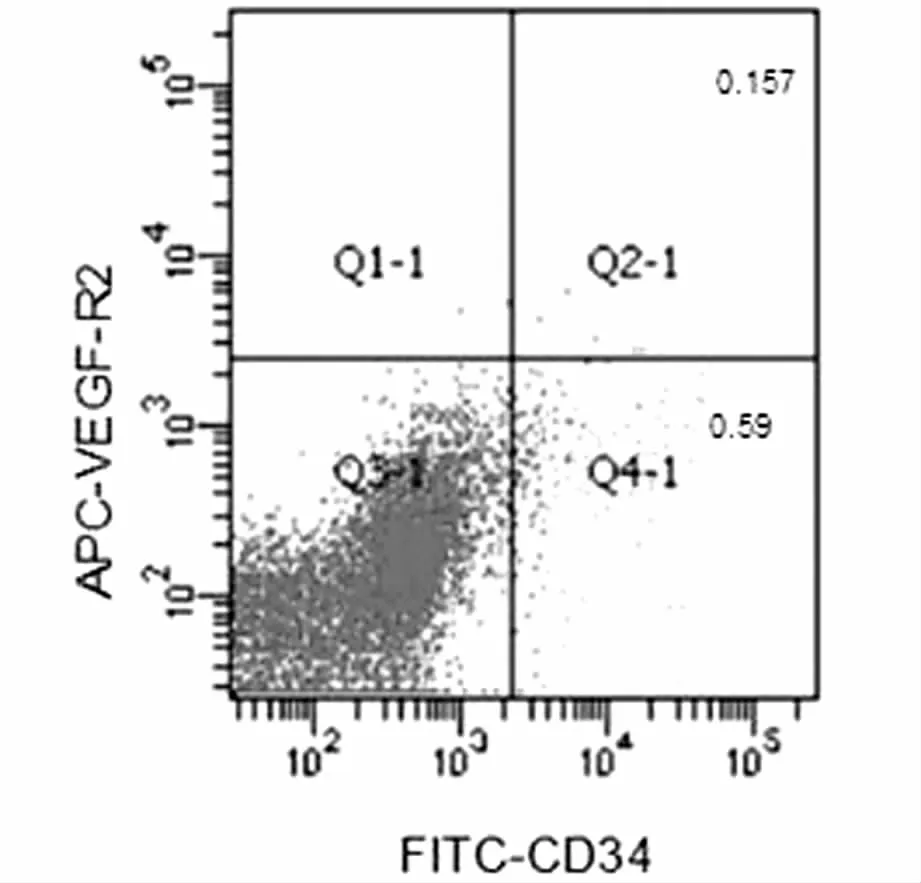
图2 早孕蜕膜组织中CD34、VEGF-R2相互关系
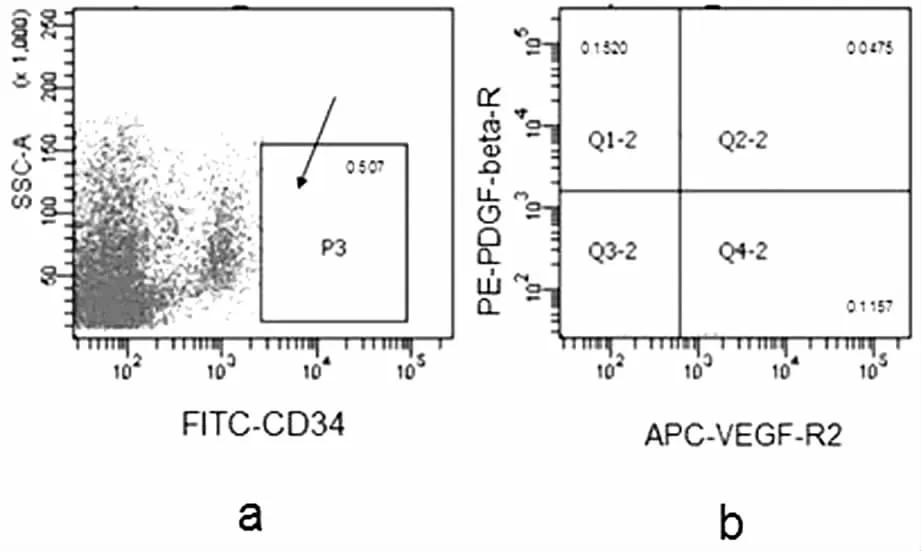
图3 早孕蜕膜组织中CD34、PDGF-βR、VEGF-R2 表达的相互关系
讨 论
CD34最早于1984年发现于造血干细胞和祖细胞[2]。临床应用方面,它与骨髓移植后的造血干细胞富集及选择有关,检测CD34的表达,可以评估骨髓的快速移植效果,并且CD34表达与高集落形成率和长期增殖能力有关[2]。Schwab等[3]通过收集从胎儿到绝经后妇女子宫内膜组织,发现子宫内膜组织基底层间质细胞终生持续表达CD34。CD34+细胞存在于人蜕膜组织中,也表达于血管内皮细胞。研究发现,蜕膜组织提取的CD34+细胞在合适的细胞因子存在时可体外诱导分化为成熟的NK细胞,在诱导分化之前CD34+细胞不具备NK细胞的特性,说明蜕膜组织提取的CD34+细胞存在干细胞的特性,为蜕膜组织的干细胞[4]。蜕膜NK细胞(dNK细胞)是一群独特型的淋巴细胞群,dNK细胞从子宫内膜分泌期开始增加,在妊娠成功后,dNK细胞持续存在孕早期蜕膜中,其中底蜕膜上含量最多,妊娠20周以后,滋养层细胞向蜕膜的侵蚀已经完成, 此时dNK细胞的数量开始明显下降, 至孕晚期完全消失[5]。仅在妊娠早期出现大量dNK 细胞,这一现象提示可能与子宫内膜的蜕膜化以及胚胎滋养层的侵入有关[6]。dNK细胞在妊娠过程中的功能尚不十分明确。但研究证实, 正常妊娠早期, NK细胞大量浸润子宫蜕膜,并与着床处的胎盘滋养层细胞紧密接触、相互识别, 对胚胎植入、早期胎盘形成以及胎儿生长发育可能起调节作用[7]。
在血管生成方面,dNK 细胞可直接分泌血管内皮生长因子(VEGF)、胎盘生长因子(PIGF)、促血管生成素1、促血管生成素 2、转化生长因子-β1(TGF-β1)等促进血管生长[8-9];通过产生粒细胞巨噬细胞集落刺激因子(GM-CSF),与滋养层细胞上的受体相互作用, 使滋养细胞转化为合体细胞, 释放出胎盘生乳素和绒毛膜促性腺激素,从而加速胚胎向内膜层的种植,GM-CSF还能抑制NK 细胞的排异功能,减少流产的发生。dNK细胞还可通过活化受体NKp30和NKp44与蜕膜基质细胞和绒毛滋养层细胞上特异性配体的相互作用参与促血管生成因子的分泌。除此之外,dNK细胞的受体KIR2DL4(其特异配体为可溶性HLA-G)可诱导促血管生成细胞因子的产生[10]。KIR2DL4可表达于细胞表面和胞内,可溶性 HLA-G 可由绒毛膜滋养层分泌,因此,这种受体-配体的结合可能有助于妊娠早期母体血管的重塑[11]。最新研究发现CD3-CD56brightCD25+dNK 细胞亚型通过分泌IL-8、IFN-γ在螺旋动脉重塑过程中发挥始动作用[12]。
从胚胎植入到分娩生产的整个妊娠过程,细胞因子始终发挥着重要的作用。dNK 细胞分泌的TGF-β可限制滋养层细胞过度侵蚀,白血病抑制因子(LIF)可启动胚泡着床必需的细胞因子,GM-CSF调节胚胎植入和胎盘的生长发育,IL-15R是蜕膜NK细胞分化增殖的重要因子,IFN-γ则是维持蜕膜正常发育的重要因素。dNK 细胞分泌的干扰素诱导蛋白-10(IP-10) 趋化因子、白细胞介素-8(IL-8),通过与滋养层细胞上的配体CXCR1 和CXCR3 相互作用,促进绒毛外滋养层细胞迁移到底蜕膜[11],导致螺旋动脉的浸润,从而有助于胎盘发育和妊娠结局;而活化的dNK 细胞受体通过产生GM-CSF溶解因子,有助于滋养层细胞的迁移。内皮血管生成和滋养细胞的迁移则依赖于dNK 细胞的鞘氨醇信号通路调节[13]。
综上所述,dNK 细胞作为母-胎界面主要的免疫细胞,其数量变化、功能失调等均会打破母胎界面的平衡状态,导致妊娠早期阴道流血、胚胎发育异常、坏死、流产、胎盘植入、宫内生长受限、子痫前期等发生,给家庭、社会造成重大影响。
在体情况下蜕膜的CD34+细胞到底发挥哪些作用,其细胞的含量以及相关的细胞标志物目前均属空白。本实验推测通过研究蜕膜中CD34+细胞含量,有可能进一步反映dNK细胞功能状态与妊娠的关系,并且CD34+细胞可能作为干细胞在蜕膜的生理变化中发挥重要的作用[4]。因此,深入研究早孕期蜕膜的CD34+细胞,无疑从一个全新的干细胞角度探索妊娠早孕期复杂的蜕膜变化,有利于诠释妊娠早孕期的免疫、蜕膜血管生长、胎盘形成的这一生理现象,为揭示病理性妊娠在早孕期的发生机制及最终有效防治提供新的思路,并为生殖免疫的发展提供了新的理论依据。
血小板源性生长因子(PDGF)早在70年代由ROSS在研究创伤愈合与动脉粥样硬化时首先发现,人体多种组织均有分布,可参与多种生理、病理功能的调节[14]。PDGF作为细胞的促有丝分裂剂[15],在细胞迁移、血管形成、组织损伤及修复中起到重要作用[16],有研究发现PDGF有刺激血管内皮细胞和平滑肌细胞增殖与迁移,从而促进新生血管形成的作用;此外,PDGF在胚胎期血管、神经、骨骼等系统的器官发育中起着重要的作用[17]。PDGF受体有两种,即PDGF受体-α和PDGF受体-β(CD140b)。有研究证实PDGF-βR是子宫内膜干细胞的标志物之一。Schwab等[3]利用CD146 和PDGF-βR(CD140b)从子宫内膜中分离出具有间充质干细胞(MSC)表型和特性的间质细胞。用该方法分离得到的CD146+和PDGF-βR+细胞具有多分化潜能,并且分布在功能层和基底层的血管周围,表达与血管形成相关的基因。
本实验通过流式细胞仪检测早孕蜕膜组织中PDGF-βR+细胞表达,发现其含量为(9.94±7.36)%。有研究证明与骨髓间充质干细胞相比,子宫内膜干细胞具有27倍更高水平的PDGF-BB,和14倍更高水平的血管生成素。这表明子宫内膜干细胞可激活血管生成途径[18]。Saji等[19]研究发现PDGF-BB及其受体PDGF-βR存在于早孕期蜕膜组织中,且PDGF-BB能以剂量依赖方式促进蜕膜细胞DNA合成,参与早孕期子宫间质细胞蜕膜化作用,PDGF还可以诱导人子宫内膜蜕膜细胞、上皮细胞和子宫螺旋动脉平滑肌细胞增殖,促进胚胎植入。蜕膜来源于子宫内膜,蜕膜中含有的PDGF、PDGF-βR含量可能比骨髓等组织含有的量更多。在血管生成过程中,PDGF-BB能诱导内皮细胞增殖,迁移,促进结构形成和细胞存活,聚集周细胞以促进血管结构的完整性[20-21],诱导血管平滑肌细胞及脐静脉内皮细胞表达VEGF[22-23]。PDGF-BB表达水平降低,致绒毛血管结构发育不良,血管生成受阻,血管数目减少,形态异常,血管渗透性增加,是胎儿胎盘单位灌注不足,胎盘缺血缺氧,从而导致流产发生,对孕产妇及家庭产生深远影响。
血管内皮祖细胞(endothelial progenitor cell,EPC),是一类能循环、增殖并分化为血管内皮细胞,但尚未表达成熟血管内皮细胞表型,也未形成血管的前体细胞。在胚胎发育过程中 ,血液与血管的发生密切相关,在鼠胚7.5日龄, 胚外卵黄囊出现造血岛,造血岛中心是呈圆形的造血干细胞,而周边的细胞则分化为伸展的血管内皮细胞。这种发育上的时空联系,以及造血细胞与血管内皮细胞共同具有的众多细胞表面标记( 如 CD34 、VEGFR-2 等)使人设想这两者可能来自共同的中胚层前体细胞-血液血管干细胞。近十年来的研究发现,外周血中存在造血干/祖细胞,这使 Asahara等[24]推想外周血中也可能存在EPC,人外周血CD34+或 VEGFR-2+细胞在体外能增殖并转化为血管内皮细胞。
CD34 作为富集造血干/祖细胞的主要标记,也表达于胚胎早期血管上,因而可用于富集 EPC 。VEGFR-2(即鼠的 Flk-1 ,人的KDR)作为胚胎血液血管发育时的关键受体,是血液血管干细胞的表面标记,在出生后也同时表达于早期造血干细胞和成熟血管内皮细胞上。以上不同富集EPC方法所得皆为异质性群体,其本质部分为 VEGFR-2+细胞组份。血管内皮细胞分化过程对VEGF的绝对依赖性也反映了作为VEGF主要信号传导受体的 VEGFR-2 在血管内皮细胞不同分化阶段表达的必然性。然而,即使是CD34+/VEGFR-2+也包含了最原始的造血干细胞[24]。
CD34不仅表达于干细胞,而且表达于内皮细胞,VEGF-R2的表达阳性还存在于内皮细胞以及一些祖细胞。因此,本实验进一步采用双染法分析早孕蜕膜组织CD34和VEGF-R2的表达含量。发现CD34+/VEGFR2+含量为(0.16±0.1)%, CD34+/ VEGF-R2-含量为(0.59±0.61)%,早孕蜕膜组织中的CD34+细胞群可能既含有内皮细胞,又含有祖细胞、干细胞。
本实验通过流式细胞仪检测早孕蜕膜组织中CD34+细胞群中PDGF-βR表达,发现CD34+/ VEGF-R2+/ PDGF-βR+的细胞含量为(0.09±0.06)%,CD34+/ VEGF-R2-/ PDGF-βR+表达量为(0.15±0.13)%。二者对比可以看出CD34+细胞群中更多的是VEGF-R2-细胞表达PDGF-βR,差异尽管无统计学意义,但可能与样本量不够大有关,这类含量为(0.15±0.13)%的CD34+/ VEGF-R2-/ PDGF-βR+细胞群很有可能是一类具有特殊作用具有分化潜能的干细胞群。在血管生成过程中,PDGF-BB能诱导内皮细胞增殖、迁移,促进结构形成和细胞存活,聚集周细胞以促进血管结构的完整性[20-21],诱导血管平滑肌细胞及脐静脉内皮细胞表达VEGF,因此,这类干细胞群可能与血管形成作用相关。
总之,本研究证实在早孕期蜕膜组织存在一定含量经典干细胞标志物CD34、PDGF-βR、VEGF-R2阳性的细胞群,并且采用双染法及三染法证实上述标志物阳性表达的内在含量关系。本实验推测,表达这些经典干细胞标志物的细胞群为蜕膜组织存在的干细胞,并可能与蜕膜血管的发生发展相关,进而从一个新的视角探索早孕期蜕膜组织的生理过程,其异常可能与部分妊娠过程异常如胚胎停育、胎盘功能不良等相关,这为进一步的蜕膜干细胞研究提供了研究依据。深入探讨早孕蜕膜组织中的干细胞的含量及作用,明确其在妊娠中的机制,有助于深化对人类妊娠的了解,对病理妊娠和其他妊娠相关疾病的机制及有效防治提供新思路,将有助于女性更好的妊娠及胎儿的孕育。
1Mutlu L,Hufnagel D,Taylor HS.The endometrium as a source of mesenchymal stem cells for regenerative medicine.Biol Reprod,2015,92:138.
2Sidney LE,Branch MJ,Dunphy SE,et al.Concise review:evidence for CD34 as a common marker for diverse progenitors.Stem Cells,2014,32:1380-1389.
3Schwab KE,Gargett CE.Co-expression of two perivascular cell markers isolates mesenchymal stem -like cells from human endometrium.Hum Reprod,2007,22:2903-2911.
4Vacca P,Vitale C,Montaldo E,et al.CD34+ hematopoietic precursors are present in human decidua and differentiate into natural killer cells upon interaction with stromal cells.Pro Natl Acad Sci USA,2011,108:2402-2407.
5Trundley A,Moffett A.Human uterine leukocytes and pregnancy.Tissue Antigens,2004,63:1-12.
6Sindram-Trujillo AP,Scherjon SA,van Hulst-van Miert PP,et al.Differential distribution of NK cells in decidua basalis compared with decidua parietalis after uncomplicated human term pregnancy.Hum Immunol,2003,64:921-929.
7赵丽丽,曲迅,梁璐.妊娠早期子宫微环境中蜕膜、滋养层及子宫NK细胞基因表达的研究.中华微生物学和免疫学杂志,2006,26:61-64.
8Kalkunte SS,Mselle TF,Norris WE,et al.Vascular endothelial growth factor C facilitates immune tolerance and endovascular activity of human uterine NK cells at the maternal-fetal interface.J Immunol,2009,182:4085-4092.
9Cerdeira AS,Rajakumar A,Royle CM,et al.Conversion of peripheral blood NK cells to a decidual NK-like phenotype by a cocktail of defined factors.J Immunol,2013,190:3939-3948.
10Rajagopalan S,Bryceson YT,Kuppusamy SP,et al.Activation of NK cells by an endocytosed receptor for soluble HLA-G.PLoS Biol,2006,4:e9.
11Le Bouteiller P.Human decidual NK cells:unique and tightly regulated effector functions in healthy and pathogen-infected pregnancies.Front Immunol,2013,4:404.
12Tao Y,Li YH,Piao HL,et al.CD56(bright)CD25+ NK cells are preferentially recruited to the maternal/fetal interface in early human pregnancy.Cell Mol Immunol,2015,12:77-86.
13Zhang J,Dunk CE,Lye SJ.Sphingosine signalling regulates decidual NK cell angiogenic phenotype and trophoblast migration.Hum Reprod,2013,28:3026-3037.
14Fang L,Yan Y,Komuves LG,et al.PDGF C is a selective a Platelet-derived growth factor receptor agonist that is highly expressed in Platelet a granules and vaseular smooth muscle.Arterioscler Thromb Vasc Biol,2004,24:787-792.
15Mantor M,Koper O.Platelet-derived growth factor—the construction,role and it’s receptors.Pol Merkur Lekarski,2008,24:173-176.
16Hudkins KL,Gilbertson DG,Carling M,et al.Exogenous PDGF-D is a potent mesangial cell mitogen and causes a severe mesangial proliferative glomerulopathy.J Am Soc Nephrol ,2004,15:286-298.
17Klinghoffer RA,Mueting-Nelsen PF,Faerman A,et al .The two PDGF receptors maintain conserved signaling in vivo despite divergent embryological functions.Mol Cell,2001,2:343-354.
18Verdi J,Tan A,Shoae-Hassani A,et al.Endometrial stem cells in regenerative medicine.J Biol Eng,2014,8:2-10.
19Saji M,Taga M,matsui H,et al.Gene expression and specific binding of Platelet一derived growth faetor and its dffect on DNA synthesis in human Deeidual cells.Mol Cell Endoerinol,1997,132:73-80.
20Sano H,Ueda Y,Takakura N,et al.Blockade of Platelet-Derived Growth Factor Receptor-beta Pathway Induces Apoptosis of Vascular Endothelial Cells and Disrupts Glomerular Capillary Formation in Neonatal Mice.Am J Pathol ,2002,161:135-143.
21Crosby JR,Seifert RA,Soriano P,et al.Chimaeric analysis reveals role of PDGF receptor in all muscle lineages.Nat Genet,1998,18:385-388.
22夏豪,李庚山,尹丽娅,等.血小板源性生长因子对于培养内皮细胞血管内皮细胞生长因子水平的影响.湖北医科大学学报,1999,20:291-292.
23Chang HJ,Park JS,Kim MH,et al.Extracellular signal-regulated kinases and AP-1 mediate the up-regulation of vascular endothelial growth factor by PDGF in human vascular smooth muscle cells.Int J Oncol,2006,28:135-141.
24杨晨,杨仁池,韩忠朝.血管内皮祖细胞的研究进展.基础医学与临床,2002,22:391-396.
