选择性胎儿宫内生长受限与代谢异常的关系
——基于气相色谱-飞行时间质谱的脐血代谢组学研究
2017-03-29张晓威王学举魏瑗赵扬玉
张晓威 王学举 魏瑗 赵扬玉
成年疾病的胎儿起源假说和发育可塑性[1-3]已经得到越来越多的流行病学调查及动物实验研究结果的支持。在此基础上,2003年学者们提出了健康和疾病的发育起源(developmental origins of health and disease, DOHaD)假说。DOHaD假说认为,人类在早期发育过程(胎儿、婴儿、儿童时期)经历胎盘功能不良、营养不良等不利因素,子代组织器官在结构和功能上会发生永久性或程序性改变,将会影响成年后糖尿病、心血管疾病、神经精神疾病的发病风险。
虽然单胎宫内生长受限(intrauterine growth restriction, IUGR)与成年后的心血管疾病风险[4]及包括肥胖、高血压、2型糖尿病、血脂异常等在内的代谢综合征[5-6]已得到证实,但是在双胎特殊并发症——选择性宫内生长受限(selective intrauterine growth restriction, sIUGR)中却鲜有研究。sIUGR是单绒毛膜性双胎(monochorionic twins, MC)较为常见的并发症,发生率约为10%~15%[7]。其诊断尚未形成共识,目前广泛使用的标准为,单绒毛膜性双胎中任一胎儿超声检查估测体质量小于相应孕周的第10百分位,除外两个胎儿均为小于胎龄儿(small for gestational age, SGA)。sIUGR胎儿围生期发病率和死亡率较高[8],严重影响围产儿的健康。
代谢组学(metabolomics)是继基因组学、转录组学及蛋白质组学之后发展起来的新兴组学技术,可对生物体内所有代谢途径的小分子产物进行定性定量分析,寻找生理、病理状态下代谢产物和模式的改变。在妇产科学中,代谢组学还尚未大规模展开,但在妇科肿瘤、病理妊娠以及胎儿医学相关方面已有初步应用。在生长受限的不良宫内环境中,这些紊乱可以导致生物代谢产物的含量、相对比例发生改变,而代谢组学的蓬勃发展为此提供了一个新的方法。MC双胎来自同一受精卵,为在相似的遗传背景下研究胎儿对于营养以及宫内环境的应激反应提供了独特的视角。
本文基于气相色谱-飞行时间质谱(gas chromatography/time-of-flight mass spectrometry, GC-TOF/MC)技术,研究sIUGR双胎的脐血代谢轮廓,并利用多元变量统计分析和单变量统计分析筛选SGA胎儿与大胎儿的差异代谢物并加以鉴定,以寻找生长受限儿的代谢变化,并探索发生异常的相关代谢通路。
对象与方法
一、对象
选取2013年4月—2015年10月在北京大学第三医院产科以剖宫产术分娩的双胎妊娠,分娩后检查胎盘个数、羊膜囊个数和隔膜层数。严格筛选后,纳入9例sIUGR进行研究。研究组为sIUGR双胎中生长受限(small for gestational age, SGA)胎儿,对照组为双胎中生长正常的大胎儿(appropriate gestational age, AGA)。
单绒毛膜双羊膜性(MCDA)诊断标准[9-10]:妊娠6~9周,超声检查结果显示宫内仅见一个孕囊,囊内可见2个胚芽;妊娠10~14周,双胎间羊膜分隔与胎盘呈“T”征;分娩后经组织学确认。sIUGR诊断及分型:单绒毛膜性双胎中,任一胎儿超声检查估测体质量小于相应孕周的第10百分位,除外两个胎儿均为SGA。排除标准:双胎输血综合征(twin-to-twin transfusion syndrome, TTTS)、三胎以上妊娠、胎儿结构或染色体异常、选择性减胎术后、胎儿宫内窘迫;严重母体并发症如子痫前期、妊娠期糖尿病、高血压疾病合并妊娠;代谢异常如甲状腺及肾上腺疾病、高脂血症等;绒毛膜羊膜炎;辅助生殖技术等。
二、方法
1.仪器和试剂:Agilent 7890气相色谱仪,串联LECO Pegasus 4D TOF/MS检测器;低温高速离心机(Thermo)等。所用甲醇(Merck, Lot:1772435515)及盐酸甲氧胺(20 mg/mL,吡啶溶液,Supellco,Lot:LC01949V)均为色谱级,氯仿(国药集团化学试剂有限公司,批号:20131206)为分析纯;核糖醇水溶液(>99%, 0.2 mg/mL, Fluca, Lot:12661714330b044)和TMCS购自Fluca,MSTFA (含1% TMCS,Lot: BCBN4262V)购自Aldrich,超纯水为自制(18.2 Ω/cm)。
2.脐血采集与处理:胎儿娩出后断脐,止血钳夹闭近胎儿段脐带,一次性无菌注射器抽取脐带血5 ml,转移至含EDTA抗凝管中,轻轻颠倒抗凝管,立即4℃下3 000 rpm离心10 min,分离血浆。-80 ℃冻存。标本的采集已经过本院医学伦理委员会审议批准,所有对象均签署知情同意书。
3.样品前处理:于4 ℃解冻,取100 μl血浆样品立即加500 μl甲醇,充分涡旋混合后加入10 μl 0.2 mg/ml核糖醇水溶液作为内标。混合溶液在70 ℃水浴中震摇15 min后放置室温下冷却,13 000转离心后取上清液加入450 μl去离子水和270 μl氯仿萃取,经过萃取后将极性相氮气吹干,并由含1% TMCS的MSTFA完成衍生化后,取0.3 μl样品进行仪器分析。
4. 分析条件:采用气相色谱-飞行时间质谱(GC-TOF/MC)技术分析sIUGR生长受限儿和正常大胎儿血浆代谢图谱。(1)色谱条件:Gerstel MPS进样系统;Agilent色谱柱DB-5MS 30 m×250 μm×0.25 mm。程序升温:70 ℃保持1 min,以5 ℃/min升至280 ℃,保持10 min。载气:氦气;流速:1 ml/min;进样体积:1 μl;不分流进样。(2)质谱条件:EI源:70 eV;溶剂延迟:330 s;质量扫描范围:50~800 Da;采集电压:1600 V;采集速度:10 Spectra/second;进样口、传输线和离子源温度分别为:250 ℃、250 ℃及220 ℃。
5.数据处理:采用Agilent色谱工作站软件自动识别噪比大于100的色谱峰。经对齐、去卷积、峰查找等处理后,得到包含保留时间及峰面积的数据集,得到代谢物总离子流色谱图(total ion chromatogram, TIC)。利用NIST02数据库检索鉴定质谱数据。过滤原始数据,挑选共有峰利用内标法处理,将处理后的数据导入SIMCA 10.0(UmetricsAB, Umea, Sweden)进行主成分分析(principal components analysis, PCA)和偏最小二乘-判别分析(partial least squares discrimination analysis, PLS-DA)。PCA是一种典型的无监督模式识别方法,可直观反映样品间的差异和距离;而PLS-DA是一种有监督的模式识别方法,可以寻找与分组密切相关的标志。自动建模分析后,结果以得分图形式表示,判断生长受限组与正常组的样品差异性。用第一主成分的变量投影重要度(variable importance in the projection, VIP)表示不同代谢物对PLS-DA模型的贡献,VIP值大于1的变量表示该物质对模型贡献高于平均水平,是区分两组的潜在标记物。筛选VIP值>1的代谢物,为验证筛选出的候选差异代谢物是否有统计学意义。本研究使用KEGG数据库(http://www.genome.jp/kegg/)查询差异代谢物信息。
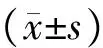
结 果
一、一般情况
9例sIUGR孕妇,平均年龄(27.56±2.70)岁;孕周31+2~35+3周,平均孕周(33.0±1.3)周;SGA与大胎儿的出生体重分别为(1 093.33±363.73)g、(2 021.11±244.51)g,差异有统计学意义;身长分别为(36.94±5.23)cm、(43.56±2.46)cm,差异有统计学意义。
二、GC-TOF/MS检测结果
sIUGR双胎脐血血浆经处理分析后,典型总离子流色谱图(total ion chromatorgraphy, TIC)如图1。TIC图中每个色谱峰代表一种流出峰,可见,生长受限组样本2(图1B)与正常组样本2(图1A)的脐血代谢物谱峰存在一定差异。详细情况还需要进一步分析。

A.为sIUGR 中正常胎儿一个脐血血浆样本的典型TIC图;B.为sIUGR生长受限儿一个脐血血浆样本的典型TIC图。纵坐标为离子强度,横坐标为扫描的保留时间,TIC图中每个峰代表了一种流出峰,从该图可以看出,A与B存在一定差异 图1 GC-TOF/MS测定两组脐血血浆代谢物典型总离子流色谱图
三、代谢物PCA及PLS-DA分析结果
原始数据经对齐、去卷积、峰查找等处理后匹配后,得到包含保留时间及峰面积的18样品×751峰数的数据集,过滤数据并模拟缺失值,利用内标进行归一化处理后,得到18样品×617个变量。
使用SIMCA软件建模进行PCA分析,数据降维后得到8个主成分,模型参数R2X为0.917,说明建立的模型符合数据的真实情况。绘制PCA得分图如图2A所示。图中每一个点代表一个样品,各样品在第一主成分(t[1])与第二主成分(t[2])构成的平面上的投影得分图可直观反应样品间的相似或差异,数据点间的距离越小说明所代表的样品的含有的代谢物组成和浓度越接近;反之,其差异越大[11]。PCA得分图显示该模型不能有效区分两组样品的差异,进而采用有监督的PLS-DA进行分析。PLS-DA得分图如图2B所示。从中可以看到,两组样品在第二主成分(t[2])上可较好的分离,可见SGA与对照组(大胎儿)血浆代谢差异区分较明显。PLS-DA模型的参数R2X、R2Y和Q2分别是0.259、0.848和-0.0486。由于样本量较小,变量数远大于样品数,所以虽然该模型能较好的解释数据的情况,但Q2说明原模型存在过拟合现象,模型稳健性一般,预测能力较差。

A.为生长受限组对大胎儿组(对照组)的PCA得分图;B.为生长受限组对大胎儿组(对照组)PLS-DA得分图。得分图中每个数据点代表一个样品,其中,■代表对照组,○代表生长受限组。数据点间的距离越小说明所代表的样品之间的代谢物组成越相似;反之,差异则越大。横坐标t[1]表示第一主成分,纵坐标t[2]表示第二主成分,图B可以看到生长受限组与对照组在第二主成分上可较好的分离 图2 生长受限组和大胎儿组(对照组)的PCA及PLS-DA得分图
四、差异代谢物鉴定及分析
为了确认生长受限组与对照组出现图2B差异的变量,选择PLS-DA模型中的变量投影重要度(VIP)值大于1的变量51个,鉴定后得到39种作为潜在的差异代谢物质,经Wilcoxon符号秩检验显著性检验,最终筛选出10种有统计学差异的代谢物(见表1)。
这些代谢物形成复杂的代谢调控网络,最终导致了sIUGR生长受限胎儿脐血代谢组的差异。搜索KEGG数据库(http://www.genome.jp/kegg/),查询差异代谢物,并映射到数据库已有的代谢通路,最终发现sIUGR生长受限儿相较于正常胎儿发生改变的代谢通路主要集中于碳水化合物、氨基酸及脂代谢等,部分差异代谢物映射的代谢通路整理见表2。

表1 生长受限儿和大胎儿脐血血浆差异代谢物
注:保留时间为该化合物达到流出浓度峰值的时间,VIP值为该物质对PLS-DA模型的贡献程度。数据保留3位有效数字,采用Wilcoxon符号秩检验,*P<0.05,**P<0.01;下调表示该代谢物脐血水平在生长受限儿中低于大胎儿
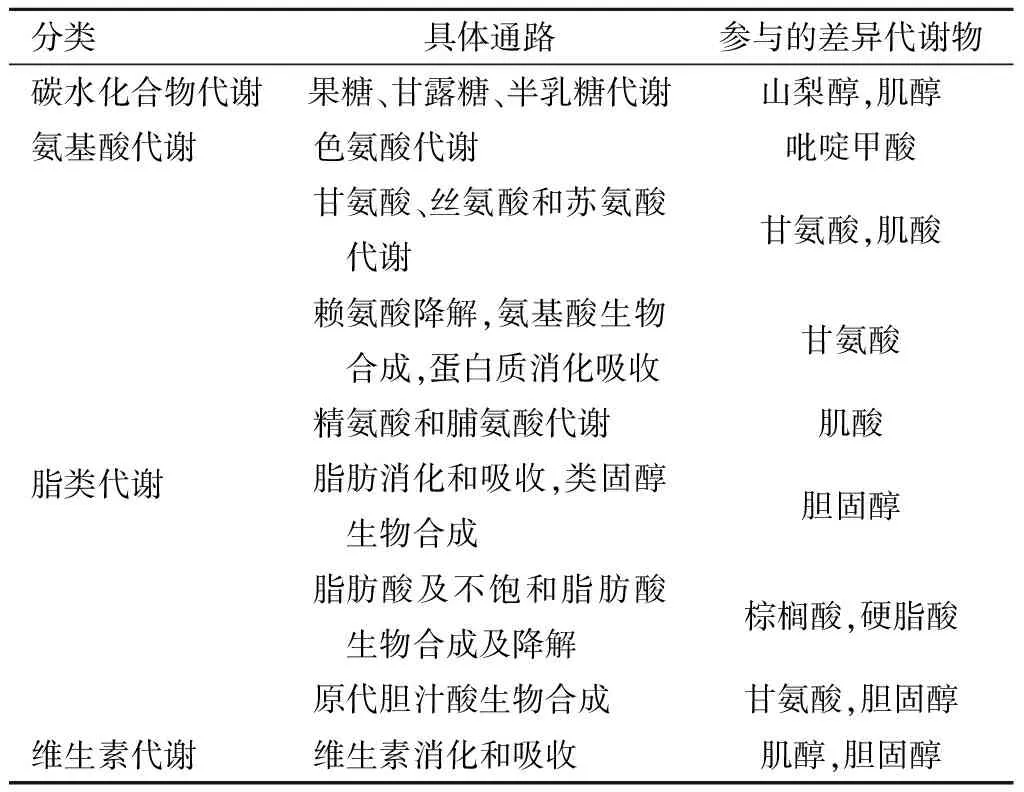
表2 sIUGR双胎差异代谢物映射的部分代谢通路
讨 论
目前认为sIUGR的发病与胎盘分隔不均及不同类型的胎盘吻合血管存在[12]相关,但具体机制目前仍不清楚,而代谢组学是研究生物体受外部刺激或遗传修饰后,细胞或组织产生的代谢应答变化的科学[13],可以为探讨sIUGR病因提供了新的研究思路。本研究基于GC-TOF/MS的代谢组学方法,通过检测反映胎儿宫内生理功能代谢情况的脐血,探讨sIUGR双胎的代谢变化。结果发现,sIUGR双胎中生长受限胎儿相较于正常胎儿代谢轮廓不同,在SGA胎儿中,代谢水平增加的代谢产物包括山梨醇、肌醇、甘氨酸、吡啶甲酸,降低的代谢物有亮氨酸、缬氨酸、棕榈酸、硬脂酸、胆固醇和肌酸。部分结果与单胎IUGR的报道类似[14-19]。
氨基酸代谢方面,在生长受限儿组代谢水平下调的亮氨酸和缬氨酸属于支链氨基酸(BCAA),BCAA在刺激蛋白质合成和抑制骨骼肌中蛋白质的降解起主要作用[20],并可增强真核细胞翻译起始因子的合成、参与mRNA翻译的蛋白质的活性[21],以促进蛋白质表达;甘氨酸参与了蛋白质和与许多重要的代谢相关分子的合成,对缺血再灌注损伤等病理损伤也具有抗炎和免疫调节[22]作用。这里对于甘氨酸的变化水平不同的研究有一定的分歧,Bajoria等[23]对sIUGR胎儿血浆氨基酸水平直接进行检测后发现受限儿血浆甘氨酸浓度较AGA低,而另外几项质谱研究[15,24]则发现甘氨酸水平在IUGR胎儿血浆和尿液中上调,本研究结论支持上调。鉴于不同研究的样本量、研究方法等差异,小分子代谢物的变化水平确实有着相反的报道,如Cosmi等发现色氨酸在FGR胎儿下调[25],而在另一下研究中则上调[24]。虽然甘氨酸水平的上调可以解释生长受限儿在氨基酸代谢方面出现了异常,并提示在炎症反应和氧化应激对于sIUGR的发生发展有一定的作用,但对于这一矛盾的结论,我们认为还需要后期大样本的验证。以游离和磷酸化形式存在体细胞内的肌酸[26]除了参与氨基酸代谢,也与ATP的生成相关,肌酸水平的增加可能由增强的氧化代谢及高渗状态引起,并可能与成年后肾衰竭发生率的增加[15]相关。
脂代谢方面,棕榈酸(PA)可引起胰岛素抵抗、线粒体功能障碍[27],与非妊娠状态的肥胖相关疾病相关[28]。此外,PA还是脑细胞膜和髓磷脂片的必要部分[29],在神经系统发育中发挥关键作用;胆固醇水平降低与单胎IUGR的文献报道一致[19],其异常脂质代谢可能是因为低氧损伤诱导血浆脂质代谢紊乱,导致高脂血症及高胆固醇[30]。
在碳水化合物代谢方面,山梨醇是糖代谢的中间产物,糖尿病或半乳糖血症患者山梨醇水平增加[31-32],并能影响组织对肌醇的吸收,共同参与半乳糖代谢;肌醇是一类环状糖醇,在真核细胞中作为第二信使的结构基础[33],参与细胞内的信号转导。肌醇代谢异常与与成年后糖耐量低减、胰岛素抵抗和糖尿病的长期微血管并发症相关[34-35],研究中肌醇水平的增高可能由生长受限儿的高胰岛素水平[15]引起。
这些代谢反应并不单独进行,其相互调控形成一个巨大的代谢网络,最终构成了sIUGR双胎的代谢组差异。总之,本研究采用同卵双胎作为研究对象,较好的去除了外界环境、遗传背景以及母体因素等混杂因素的干扰,有利于展开复杂性双胎的病因研究,并建立了sIUGR脐血代谢组的分析模型,发现了部分差异代谢标志物,为后期临床干预提供一定的思路。先前已有若干关于单胎或双胎生长受限儿营养补充的研究,例如给予胎儿高能量饮食喂养[36]或宫内补充氨基酸[37],代谢水平及生长发育都得到了一定的改善。我们期望通过sIUGR代谢组学的研究,可增强人们对于营养和生活方式在健康和疾病管理作用的认识,在宫内及分娩后针对代谢通路进行有效的临床干预,进而预防远期代谢疾病的发生。然而本研究也存在一定的不足,由于对sIUGR胎儿和母体的严格筛选,样本量较小,得到的差异代谢物可能会有偏差,这需要后期进一步扩大样本量进行更加深入的研究与验证。
1Barker DJ.In utero programming of chronic disease.Clin Sci (Lond),1998,95:115-128.
2Barker DJ.The developmental origins of adult disease.Eur J Epidemiol,2003,18:733-736.
3Barker DJ.Adult consequences of fetal growth restriction.Clin Obstet Gynecol,2006,49:270-283.
4Skilton MR,Evans N,Griffiths KA,et al.Aortic wall thickness in newborns with intrauterine growth restriction.Lancet,2005,365:1484-1486.
5Barker DJ,Osmond C,Golding J,et al.Growth in utero,blood pressure in childhood and adult life,and mortality from cardiovascular disease.BMJ,1989,298:564-567.
6Curhan GC,Willett WC,Rimm EB,et al.Birth weight and adult hypertension,diabetes mellitus,and obesity in US men.Circulation,1996,94:3246-3250.
7Lewi L,Gucciardo L,Huber A,et al.Clinical outcome and placental characteristics of monochorionic diamniotic twin pairs with early- and late-onset discordant growth.Am J Obstet Gynecol,2008,199:511 e1-7.
8Lopriore E,Sluimers C,Pasman SA,et al.Neonatal morbidity in growth-discordant monochorionic twins:comparison between the larger and the smaller twin.Twin Res Hum Genet,2012,15:541-546.
9Bora SA,Papageorghiou AT,Bottomley C,et al.Reliability of transvaginal ultrasonography at 7-9 weeks' gestation in the determination of chorionicity and amnionicity in twin pregnancies.Ultrasound Obstet Gynecol,2008,32:618-621.
10Sepulveda W,Sebire NJ,Hughes K,et al.The lambda sign at 10-14 weeks of gestation as a predictor of chorionicity in twin pregnancies.Ultrasound Obstet Gynecol,1996,7:421-423.
11阿基业.代谢组学数据处理方法——主成分分析.中国临床药理学与治疗学,2010,20:481-489.
12孙路明,赵扬玉,段涛,等.双胎妊娠临床处理指南(第二部分)——双胎妊娠并发症的诊治.中国产前诊断杂志(电子版),2015:57-64.
13夏建飞,梁琼麟,胡坪,等.代谢组学研究策略与方法的新进展.分析化学,2009,1:136-143.
14Barberini L,Noto A,Fattuoni C,et al.Urinary metabolomics (GC-MS) reveals that low and high birth weight infants share elevated inositol concentrations at birth.J Matern Fetal Neonatal Med,2014,27 Suppl 2:20-26.
15Dessi A,Marincola F C,Pattumelli M G,et al.Investigation of the (1)H-NMR based urine metabolomic profiles of IUGR,LGA and AGA newborns on the first day of life.J Matern Fetal Neonatal Med,2014,27 Suppl 2:13-19.
16Dessi A,Atzori L,Noto A,et al.Metabolomics in newborns with intrauterine growth retardation (IUGR):urine reveals markers of metabolic syndrome.J Matern Fetal Neonatal Med,2011,24 Suppl 2:35-39.
17Sanz-Cortes M,Carbajo R J,Crispi F,et al.Metabolomic profile of umbilical cord blood plasma from early and late intrauterine growth restricted (IUGR) neonates with and without signs of brain vasodilation.PLoS One,2013,8:e80121.
18Liu J,Chen XX,Li X W,et al.Metabolomic Research on Newborn Infants With Intrauterine Growth Restriction.Medicine (Baltimore),2016,95:e3564.
19Sattar N,Greer I A,Galloway P J,et al.Lipid and lipoprotein concentrations in pregnancies complicated by intrauterine growth restriction.J Clin Endocrinol Metab,1999,84:128-130.
20Yin Y,Yao K,Liu Z,et al.Supplementing L-leucine to a low-protein diet increases tissue protein synthesis in weanling pigs.Amino Acids,2010,39:1477-1486.
21Wu G,Bazer F W,Burghardt R C,et al.Impacts of amino acid nutrition on pregnancy outcome in pigs:mechanisms and implications for swine production.J Anim Sci,2010,88:E195-204.
22Zhong Z,Wheeler M D,Li X,et al.L-Glycine:a novel antiinflammatory,immunomodulatory,and cytoprotective agent.Curr Opin Clin Nutr Metab Care,2003,6:229-240.
23Bajoria R,Sooranna SR,Ward S,et al.Placental transport rather than maternal concentration of amino acids regulates fetal growth in monochorionic twins:implications for fetal origin hypothesis.Am J Obstet Gynecol,2001,185:1239-1246.
24Favretto D,Cosmi E,Ragazzi E,et al.Cord blood metabolomic profiling in intrauterine growth restriction.Anal Bioanal Chem,2012,402:1109-11021.
25Cosmi E,Visentin S,Favretto D,et al.Selective intrauterine growth restriction in monochorionic twin pregnancies:markers of endothelial damage and metabolomic profile.Twin Res Hum Genet,2013,16:816-826.
26Guzun R,Timohhina N,Tepp K,et al.Systems bioenergetics of creatine kinase networks:physiological roles of creatine and phosphocreatine in regulation of cardiac cell function.Amino Acids,2011,40:1333-1348.
27Listenberger LL,Schaffer JE.Mechanisms of lipoapoptosis:implications for human heart disease.Trends Cardiovasc Med,2002,12:134-8.
28Pankow JS,Duncan BB,Schmidt MI,et al.Fasting plasma free fatty acids and risk of type 2 diabetes:the atherosclerosis risk in communities study.Diabetes Care,2004,27:77-82.
29VanVliet E,Eixarch E,Illa M,et al.Metabolomics reveals metabolic alterations by intrauterine growth restriction in the fetal rabbit brain.PLoS One,2013,8:e64545.
30Horgan RP,Broadhurst DI,Dunn WB,et al.Changes in the metabolic footprint of placental explant-conditioned medium cultured in different oxygen tensions from placentas of small for gestational age and normal pregnancies.Placenta,2010,31:893-901.
31Tomlinson DR.Aldose reductase inhibitors and the complications of diabetes mellitus.Diabet Med,1993,10:214-230.
32Thomas TP,Porcellati F,Kato K,et al.Effects of glucose on sorbitol pathway activation,cellular redox,and metabolism of myo-inositol,phosphoinositide,and diacylglycerol in cultured human retinal pigment epithelial cells.J Clin Invest,1994,93:2718-2724.
33Lam YY,Hatzinikolas G,Weir JM,et al.Insulin-stimulated glucose uptake and pathways regulating energy metabolism in skeletal muscle cells:the effects of subcutaneous and visceral fat,and long-chain saturated,n-3 and n-6 polyunsaturated fatty acids.Biochim Biophys Acta,2011,1811:468-475.
34Nissen PM,Nebel C,Oksbjerg N,et al.Metabolomics reveals relationship between plasma inositols and birth weight:possible markers for fetal programming of type 2 diabetes.J Biomed Biotechnol,2011,30:2011.
35Croze ML,Soulage CO.Potential role and therapeutic interests of myo-inositol in metabolic diseases.Biochimie,2013,95:1811-1827.
36Manlan G,Scott KE.Contribution of twin pregnancy to perinatal mortality and fetal growth retardation; reversal of growth retardation after birth.Can Med Assoc J,1978,118:365-368.
37Tchirikov M,Zhumadilov ZS,Bapayeva G,et al.The effect of intraumbilical fetal nutrition via a subcutaneously implanted port system on amino acid concentration by severe IUGR human fetuses.J Perinat Med,2016,45.
