功能失调性子宫出血育龄期女性生殖激素水平、MMP-9及TIMP-1的变化及其意义
2017-03-29温云花葛菲符爱贞周冰
温云花 葛菲 符爱贞 周冰
功能失调性子宫出血(dysfunctional uterine bleeding,DUB)是临床上较为常见的妇科急症,流行病学研究显示,DUB的发病率呈现出了一定的上升趋势,可达0.05%以上[1]。DUB导致的月经量及月经周期的紊乱,严重影响患者的生活质量。神经-内分泌机制紊乱及下丘脑-垂体-卵巢轴的调节异常,是促进DUB发生、发展的主要因素。但近年来基础研究显示,子宫内膜局部微环境中的相关因子的改变,同样可以加剧DUB患者的症状,促进DUB的发生[2]。雌激素(estrogen,E2)、孕激素(progestrogen,P)可以影响子宫内膜的周期性改变,而基质金属蛋白酶-9(matrix metalloproteinase 9,MMP-9)、基质金属蛋白酶抑制剂-1(tissue inhibitor of matrix metalloproteinase 1,TIMP-1)可以通过损伤子宫内膜血管内皮层,加剧DUB出血症状[3]。本研究选取2012年1月—2015年1月在本院妇产科诊治的49例育龄期DUB患者,探讨DUB育龄期妇女生殖激素水平、MMP-9、TIMP-1的表达变化及意义,报道如下。
对象与方法
1.对象:选取2012年1月—2015年1月在海口市妇幼保健院妇产科诊治的育龄期DUB患者49例(DUB组)、月经周期正常的健康女性20例(对照组)。DUB组年龄21~41岁,平均(29.8±5.1)岁;已婚32例,未婚17例;体质量指数(BMI)(23.1±1.8)kg/m2。对照组年龄21~41岁,平均(29.4±5.5)岁;已婚12例,未婚8例;月经周期26~30 d,平均(28.2±1.2)d;BMI为(22.9±2.0)kg/m2。两组年龄、婚姻状况、BMI比较,差异均无统计学意义。
纳入标准为(1)DUB患者的诊断标准参考美国妇产科协会制定的标准[4];(2)DUB组3个月内均未使用过激素、避孕药物及避孕器具;(3)对照组为因男方因素导致不孕,准备接受人工受精的妇女;(4)所有纳入患者均为排卵性子宫出血;(5)本研究获得研究对象的知情同意,并签署保密协议。
排除标准:(1)近3个月内服用激素类药物、避孕类药物或使用避孕器械的患者;(2)患有全身系统性疾病;(3)患有生殖道感染性疾病;(4)患有生殖道肿瘤;(5)患有妊娠并发症或异常妊娠;(6)有精神紧张、恐惧、忧伤、情绪不稳定、焦虑、抑郁者。
2.免疫组化检测方法:采用石蜡切片,切片厚度3 mm,室温下用3% H2O2孵育5 min,应用去离子水冲洗3次,每次3 min,采用浓度为10%牛奶蛋白(1 g蛋白加入100 ml纯水)封闭,室温孵育5 min,加入MMP-9、TIMP-1抗体(鼠来源,南京碧云天生物科技有限公司),37 ℃孵育2 h,PBS缓冲液冲洗3次,每次5 min,滴加HRP标记的二抗(兔来源,购自罗氏检测公司),37 ℃孵育30 min,PBS冲洗3次,每次5 min,加入NBT/BCIP色剂显色5 min,复染,脱水,透明,封片,镜下观察。
3.免疫组化评分标准:MMP-9和TIMP-1阳性着色主要表达于细胞浆、细胞核中,呈黄色、淡黄色、棕色、褐色颗粒表达;在高倍光镜下随机选取5个视野进行阳性细胞计数和观察。(1)根据着色强度,0分为无色,1分为淡黄色,2分为棕黄色,3分为褐色、黑色;(2)根据阳性细胞比例,阳性细胞数目所占比例<10%为1分,阳性细胞所占比例11%~50%为2分,阳性细胞数51%~75%为3分,阳性细胞数所占比例>75%为4分,两种积分相乘总分<3分为阴性、≥3分为阳性。
3.血清中的E2及P标本采集及检测:清晨空腹采集静脉血(诊刮术术前24 h),按照10 000 r/min的离心速度对血清进行离心分离,-20 ℃保存待测,采集标本后1周内检测E2、P,采用瑞士罗氏全自动生化分析仪E170模块进行检测,检测试剂盒购自上海泰康生物科技有限公司。具体检测方法参照试剂盒说明书,试剂盒内配有质控血清或质控标准品,所有操作严格按照操作说明完成。
4.子宫内膜组织中的E2及P标本采集及检测:诊断性刮宫过程中刮取的子宫内膜组织,采用组织研磨法进行研磨,加入细胞裂解液,采用去离子水作为阴性对照,采用50 μl cryab作为阳性对照,平衡摇晃20 s混匀,室温下孵育2 h,采用TBSP缓冲液清洗3次,每次5 min,加入100 μl底物,平衡摇晃30~45 s,25℃室温下孵育40 min,加入250 μl终止物,直到96孔板中每孔的颜色变黄,最后以空白对照为基准,采用分光光度计进行读数。应用ELISA法检测E2、P。E2、P等抗体购自罗氏检测公司,相关配套试剂购自南京凯基生物科技有限公司,严格按照说明书的要求进行操作。
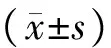
结果
1.两组血清生殖激素水平比较:DUB组和对照组的血清E2、P水平比较,差异均无有统计学意义,见表1。
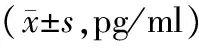
表1 两组血清生殖激素水平比较
2.两组子宫内膜E2、P表达水平比较:DUB组子宫内膜中E2表达水平显著高于对照组,P表达水平显著低于对照组,差异均有统计学意义,见表2。
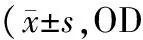
表2 两组子宫内膜E2、P表达水平比较值)
注:两组比较,*P<0.05
3.两组子宫内膜MMP-9、TIMP-1表达水平比较:DUB组子宫内膜腺体和间质中MMP-9表达水平显著高于对照组,DUB组子宫内膜腺体和间质中TIMP-1表达水平显著低于对照组,差异均有统计学意义,见表3,图1、2。

表3 子宫内膜MMP-9、TIMP-1表达水平比较分)
注:*P<0.05
4.DUB组子宫内膜MMP-9、TIMP-1表达与子宫内膜E2、P表达水平的关系:DUB组子宫内膜腺体和间质中MMP-9与E2表达水平呈正相关(r=0.411、0.502,P<0.05),腺体和间质中TIMP-1表达与E2表达呈负相关(r=-0.368、-0.407,P<0.05);DUB组子宫内膜腺体和间质中MMP-9、TIMP1与子宫内膜中P的表达水平无相关性。
讨论
1.DUB的流行病学研究:性激素分泌紊乱、多次人工流产病史等,均可以促进DUB的发生、发展,特别是在具有慢性盆腔炎症性疾病病史的人群中,DUB的发病率更高,可较普通人群上升3~4倍[5]。临床上DUB的长期进展可以导致子宫内膜不典型增生等倾向恶性病变的发生,同时可以导致月经量增多引起的严重贫血,危及生命。现阶段,临床上主要采用诊断性刮宫进行DUB的诊断和治疗,但刮宫联合术后进行雌孕激素治疗的临床总体有效率较低,不足45%[6-7]。而通过对DUB发生、发展过程中相关生物学机制的研究,可以为DUB的治疗提供理论依据,进而提高其临床治疗效果。
2.E2及P的改变对于DUB的影响:子宫内膜的增生期、分泌期过程中性激素水平的稳定对于维持正常的月经周期及月经量具有重要的意义。E2可以促进子宫内膜的增生期持续性改变,而P可以在增生期改变的基础上诱导子宫内膜呈现分泌期改变,促进子宫内膜的正常脱落。有国内外相关研究认为,DUB患者血清中或者子宫内膜局部组织中的E2及P的表达紊乱,可以促进DUB患者子宫内膜异常脱落,进而导致DUB患者发生反复出血[8],但相关研究的样本量较少,临床资料的收集偏倚较为严重,可信度不高。
3.MMP-9及TIMP-1的改变与DUB的关系:MMP-9可以通过激活细胞间质中的纤维蛋白分解酶原,进而促进胶原纤维的分解和代谢,并调控局部组织的炎症损伤、细胞修复等,特别重要的是,MMP-9可以促进子宫内膜间质成分的分解,诱导子宫内膜血管的损伤,加剧内膜出血;TIMP-1作为MMP-9的特异性抑制物,在稳定MMP-9活性的同时,还可避免过度激活MMP-9[9]。本研究的创新性在于探讨了子宫内膜局部组织中的TIMP-1及MMP-9等的表达,揭示了子宫内膜局部微生态环境改变对于DUB的影响。
4.子宫内膜局部组织中TIMP-1及MMP-9等指标的变化分析:本研究发现,在DUB患者血清中并不存在明显的E2及P的改变,DUB及正常对照人群的E2及P表达无差异,考虑雌激素或者孕激素上调导致的子宫内膜相关性激素受体的激活,并不会促进子宫内膜的不规则脱落,不会引起异常子宫出血或者功能失调性出血的发生。通过对比分析子宫内膜组织中E2及P的定量表达可以发现,DUB患者局部子宫内膜组织中的E2表达强度较高,而P的表达强度较低,E2的高表达可以促进子宫内膜的增生期改变,而P表达的下降使得子宫内膜的分泌期变化减弱,子宫内膜的不同时期的变化失去了其原有的平衡。石晓敏等[10]和薛薇等[11]通过回顾性分析了39例DUB患者的临床资料,采用蛋白定量检测技术分析了E2及P的表达,发现E2可较正常女性上升25%以上,表达强度明显上升,这与本研究的结论较为一致。免疫组化切片分析可见,MMP-9主要表达于子宫内膜腺体的周边,TIMP-1主要表达于细胞间质中,特别是在血管周边,MMP-9及TIMP-1的表达强度更高,提示二者的表达可能与影响子宫内膜局部组织中的血管生理功能有关。同时本研究也发现,MMP-9及TIMP-1的表达同样呈现出了一高一低的趋势,MMP-9的相对表达过多促进内膜血管的分解和破坏,促进了子宫异常出血的发生,二者可能在促进子宫内膜剥脱或者增生性修复过程中发挥了一定的协同作用,但具体的机制仍然需要后续研究的进一步证实。但需要注意的是,Shirota等[12]、Nouri等[13]和Jain等[14]并未发现DUB患者子宫内膜组织中TIMP-1的表达下降,这与本研究的结论存在一定的差别,考虑认为与样本量的不足、检测方法的不同等有关,这均可能导致研究结论的差别。
综上所述,DUB患者子宫内膜局部组织性激素表达的改变,以及MMP-9与TIMP-1平衡的打破,可能是促进DUB发生、发展的重要因素。临床上可以通过检测子宫内膜组织中的MMP-9等的表达变化,进而为评估病情的远期预后提供一定的参考。本研究的局限性在于未能探讨DUB患者治疗转归过程中MMP-9等指标的动态变化,存在一定的不足。
(图1、图2见封三)
1黄颖,高波,李玲.两种方法治疗青春期功能失调性子宫出血98例临床疗效分析.海军医学杂志,2016,25:170-172.
2王国建.功能失调性子宫出血发病机制和治疗进展.世界最新医学信息文摘,2015,25:129-130.
3刘书言,武斌,陈西华,等.ROS调控MMPs对子宫内膜崩解的作用.基因组学与应用生物学,2015,22:12-16.
4王名芳,马润玫.美国妇产科医师学会“妇产科临床紧急准备(2014)”共识解读.中华产科急救电子杂志,2015,24:162-165.
5袁会英.功能失调性子宫出血316例临床表现分析.云南医药,2016,32:306-308.
6Learman LA,Nakagawa S,Gregorich SE,et al.Success of uterus-preserving treatments for abnormal uterine bleeding,chronic pelvic pain,and symptomatic fibroids:age and bridges to menopause.Am J Obstet Gynecol,2011,204:271-272.
7Kim TH,Lee HH.Reply:Methods of holding the cervix and applying compression based on uterine bleeding:caudal or cephalad to the uterus.Acta Obstet Gynecol Scand,2014,93:315-316.
8Klenske J,Knoll M,Kornovski Y.[Global ablation of endometrium as a new uterus sparing operative method in uterine dysfunctional bleeding].Akusherstvo I Ginekologiia,2013,25:90-92.
9高红艳,陈继明,刘芳,等.TGF-β1对小鼠子宫内膜基质细胞MMP-9表达的影响.重庆医学,2015,42:5054-5056.
10石晓敏,吴春寒,魏玮,等.459例育龄期妇女异常子宫出血病理分析.中国当代医药,2016,25:95-97.
11薛薇,孙爱军.性激素在围绝经期异常子宫出血中的作用机制.中国实用妇科与产科杂志,2012,22:742-744.
12Shirota M,Kawashima J,Nakamura T,et al.Vascular hamartoma in the uterus of a female Sprague-Dawley rat with an episode of vaginal bleeding.Toxicol Pathol,2013,32:90-93.
13Nouri M,Tavakkolian A,Mousavi SR.Association of dysfunctional uterine bleeding with high body mass index and obesity as a main predisposing factor.Diabetes Metab Syndr,2014,8:1-2.
14Jain S,Vaid NB,Narang Y,et al.A Randomised Controlled Trial Comparing the Efficacy and Side-Effects of Intravaginal Ring (Nuvaring(?)) With Combined Oral Hormonal Preparation in Dysfunctional Uterine Bleeding.J Clin Diagnos Res,2016,10:21-23.
