浙江省柯萨奇病毒A16 VP1基因特征分析及B细胞抗原表位预测*
2017-03-29徐莉崔大伟戴玉柱王磊杨先知谢国良郑书发孙长贵成军陈瑜
徐莉,崔大伟,戴玉柱,王磊,杨先知,谢国良,郑书发,孙长贵,成军,陈瑜
(1.浙江大学医学院附属第一医院检验科,杭州 310003;2.浙江省临床体外诊断技术研究重点实验室,杭州 310003;3.中国人民解放军第一一七医院检验科,杭州 310013)
·研究生园地·
浙江省柯萨奇病毒A16VP1基因特征分析及B细胞抗原表位预测*
徐莉1,2,3,崔大伟1,2,戴玉柱3,王磊1,2,3,杨先知1,2,谢国良1,2,郑书发1,2,孙长贵3,成军3,陈瑜1,2
(1.浙江大学医学院附属第一医院检验科,杭州 310003;2.浙江省临床体外诊断技术研究重点实验室,杭州 310003;3.中国人民解放军第一一七医院检验科,杭州 310013)
目的 了解浙江省柯萨奇病毒A16(CA16)VP1基因特征及其变迁规律并预测VP1蛋白上B细胞抗原表位。方法 在GenBank检索并下载35个浙江省CA16流行株及69个已知基因型CA16参考株的VP1基因序列,使用MEGA 6.0软件进行比对分析和构建种系进化树,确定浙江省CA16流行株的基因型,并分析VP1核苷酸和氨基酸同源性及氨基酸变异;运用DNA Star中的Protean模块预测VP1上可能的线性B淋巴细胞抗原表位。结果 浙江省CA16病毒基因型为B1基因型(34株)和A基因型(1株)。B1型中以B1b亚型(24株)占绝对优势,其次为B1a亚型(10株)。浙江省CA16流行株VP1核苷酸和氨基酸同源性分别为75.5%~100%和89.5%~100%;VP1区氨基酸序列高度保守,但也存在部分变异。VP1中可能的B细胞抗原表位(氨基酸肽段)有13个,分别为10-20、30-38、57-62、73-79、98-106、118-123、159-168、173-177、184-189、240-246、265-273、274-284和289-295。结论 浙江省CA16流行株存在A、B1 2个基因型,B1b和B1a为主要基因型,其VP1区氨基酸变异程度较低,VP1中13个预测的B细胞抗原表位可为CA16疫苗的研制提供科学依据。
柯萨奇病毒A16;VP1;基因特征;氨基酸变异;B细胞抗原表位
柯萨奇病毒属于小RNA病毒科肠道病毒属,共有30个血清型,包括A组病毒的24个血清型(A1~A24)和B组病毒的6个血清型(B1~B6),其中柯萨奇病毒A16(Coxsaekievirus A16,CA16)是引起儿童手足口病(hand,foot and mouth disease,HFMD)的主要病原体之一[1]。CA16感染除了引起轻症感染外,还可导致重症或死亡病例发生[2-3]。近年来浙江省HFMD发病率一直位居法定传染病前两位[4],而且发病数一直处于全国前列,防控形势不容乐观。2008至2015年浙江省共报告HFMD 875 945例,重症患者1 885 例,死亡111例,经实验室确证的HFMD中CA16占21.82%[5],且呈逐年上升趋势。病毒结构蛋白1(viral protein 1, VP1)中包含主要的中和抗原决定簇和毒力相关位点,是分型的主要依据[6-8]。本文对浙江省CA16流行株VP1基因特征进行研究,旨在分子水平上为HFMD预防和CA16疫苗研制提供科学依据。
1 材料与方法
1.1 CA16VP1基因序列的获取 从GenBank(http://www.ncbi.nlm.nih.gov/genbank/)检索并下载浙江省CA16VP1基因序列,共35株,见表1。选取69个经文献[6,9]确定基因型且包含CA16各个基因型(亚型)的国内外CA16VP1基因序列及1个肠道病毒71型(EV71)原型株(EV71BrCr,GenBank 序列号:U22521)的VP1区序列作为参比序列,见表2。
1.2 CA16VP1进化树构建和基因序列分析 采用MEGA 6.0软件将下载的序列进行比对并截齐,EV71BrCr作为外群,用邻接法(Neighbour-Jioning,N-J)构建CA16VP1全基因系统进化树,采用Bootstrap法(replication=1 000)进行检验,并分析浙江省CA16流行株和参考株间VP1基因和由其推导出的氨基酸序列同源性及氨基酸变异情况。
1.3 CA16 VP1结构蛋白B淋巴细胞表位预测 用DNA Star软件Protean模块,采用Kyte-Oolittle、Karplus-Schultz、Emini和Jameson-Wolf对VP1蛋白氨基酸的亲水性、柔韧性、表面可能性及抗原指数进行单参数分析。
2 结果
2.1 CA16VP1区同源性和系统进化分析 CA16VP1系统进化树显示,浙江CA16流行株及参考株分为 A和B 2个基因型,B基因型可分为B1和B2 2个亚型,B1型又可分为B1a、B1b和B1c 3个亚型。浙江省CA16流行株彼此间同源性为75.5%~100%,与CA16原型株(U05876)同源性为75.8%~99.3%,亲缘关系较远,分别处在A、B 2个基因型分支上,其中宁波株(JQ315094)分布于A型分支上,与安徽株(EU812514)同源性为99.8%;其他均属于B1亚型,彼此间同源性为89%~100%,其中24株分布于B1b分支上,彼此间同源性为93.1%~100%,与B1b参考株同源性为92.3%~99.4%,与江苏(KT327155)参考株亲缘关系较近,同源性为94.4%~99.4%;10株分布于B1a分支上,彼此间同源性为94.4%~99.4%,与B1a参考株同源性为90.7%~99.1%,与安徽(KC755230)参考株亲缘关系较近,同源性为96%~99.1%。见图1。
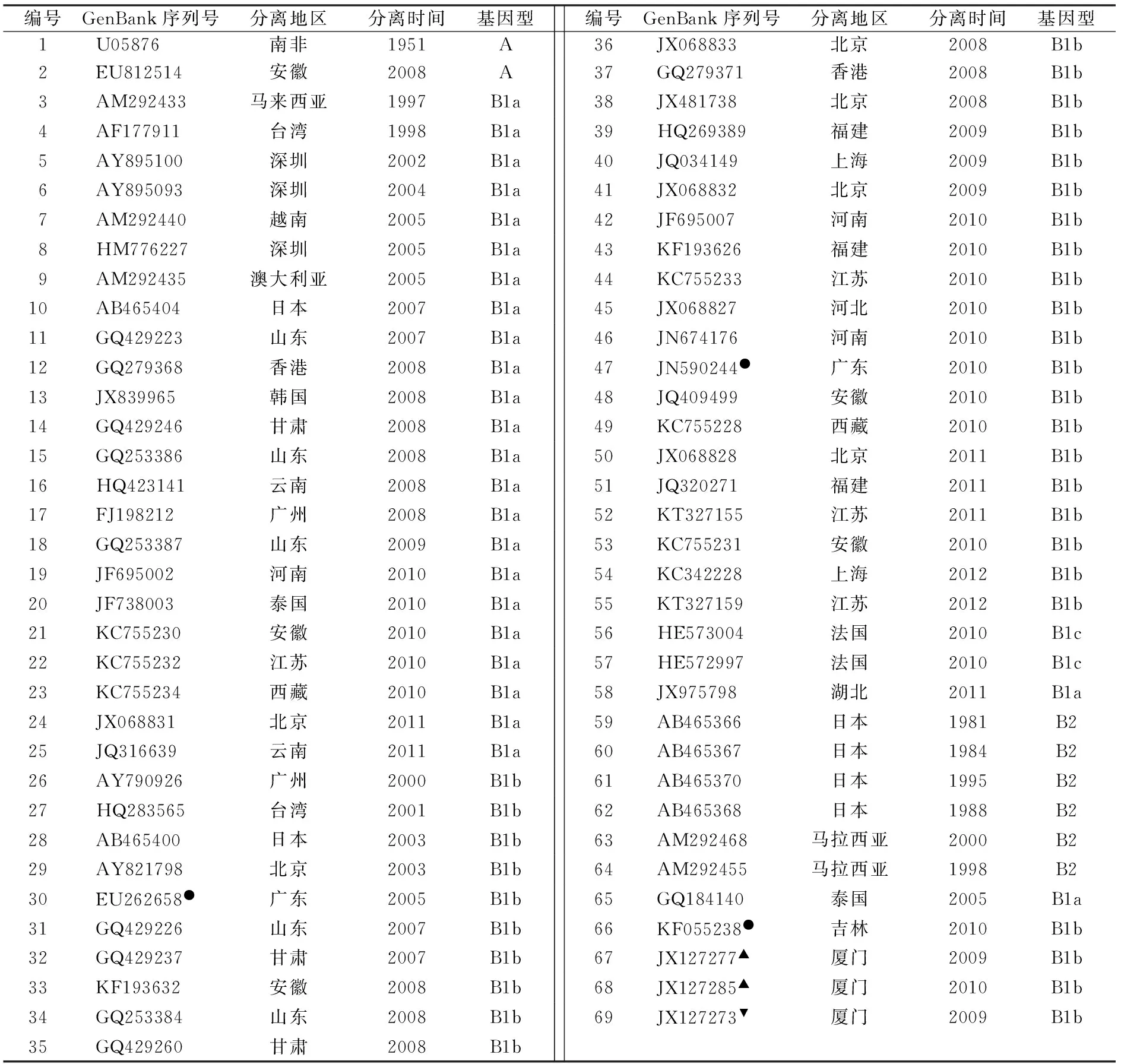
表2 CA16各基因型参考序列信息[6, 8-15]
注:●,为疫苗候选株[8,10-14];▲,为强毒株;▼,为弱毒株[15]。
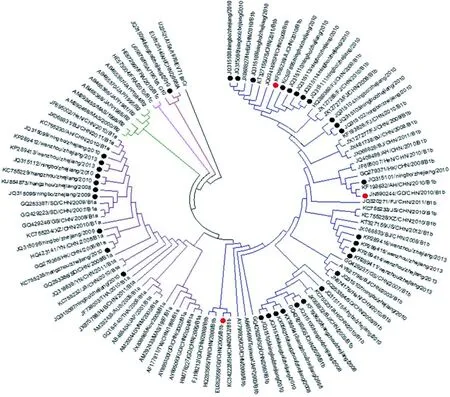
注:●,浙江省CA16流行株;,CA16疫苗候选株[8, 10-14]。
图1 CA16VP1全基因进化树
2.2 CA16 VP1氨基酸序列同源性分析 浙江省CA16流行株与原型株(U05876)氨基酸同源性为90.9%~98.3%。浙江A型宁波株(JQ315094)与原型株(U05876)及安徽阜阳株(EU81251)氨基酸同源性分别为98.3%和99.6%,其他34株B型流行株氨基酸同源性为97.6%~100%,其中B1b亚型组内氨基酸同源性为97.6%~100%,B1a亚型组内氨基酸同源性为98.6%~100%。浙江省CA16流行株与疫苗候选株[8, 10-14](KF055238、JN590244、EU262658)VP1氨基酸同源性分别为90.2%~99.6%、90.5%~100%、90.5%~100%。
2.3 CA16各基因亚型VP1氨基酸变异分析 浙江CA16流行株与疫苗候选株(KF055238)相比,有多个氨基酸变异位点,绝大多数流行株均在第1位和285位氨基酸出现变异。B1b流行株氨基酸变异位点有10个,为G1W/R、N14S、L23M、Q48R、N108Y、L113F、M230V、R285K、T287S、T295P;B1a流行株有5个氨基酸变异位点,为 R1G/W、M7I、R18P、R285K、T240I;A流行株(JQ315094)与安徽阜阳株(EU81251)相比变异为C1G,与原型株(U05876)相比变异为C1G、Q101R、N102D、E145Q、P148S。2个疫苗候选株(EU262658和JN590244)VP1氨基酸序列完全一致,大部分浙江流行株VP1氨基酸序列与其相同,但也有几个流行株出现氨基酸变异,变异表现为:W1G、M7I、N14S、R18P、L23M、Q48R、N108Y、L113F、M230V、T240I、T287S、T295P,而A型宁波株(JQ315094)与疫苗候选株(EU262658和JN590244)则出现多个变异位点,表现为W1G、T11A、N14S、Q101R、N102D、L119M、E145Q、P148S、E213A、L215P、A217S、L220A。见表3-5。

表3 浙江CA16 B1b 流行株VP1蛋白氨基酸变异情况
注:●,为疫苗候选株[8,10-14];▲,为强毒株;▼,为弱毒株[15];以疫苗候选株(KF055238)氨基酸序列为参比序列,序列相同的以“.”表示,若有变异则以相应的氨基酸表示。

表4 浙江CA16 B1a流行株VP1蛋白氨基酸变异情况
注:●,为疫苗候选株[8,10-14];▲,为强毒株;▼,为弱毒株[15];以疫苗候选株(KF055238)氨基酸序列为参比序列,序列相同的以“.”表示,若有变异则以相应的氨基酸表示。
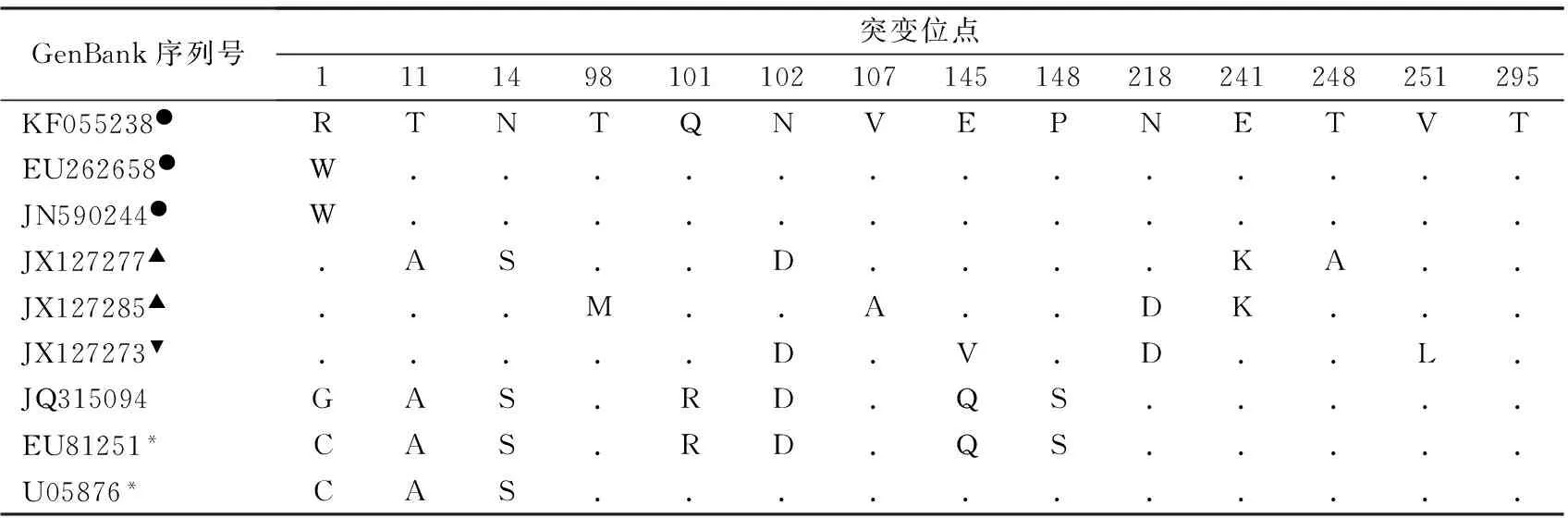
表5 浙江CA16 A型流行株VP1蛋白氨基酸变异情况
注:●,为疫苗候选株[8,10-14];▲,为强毒株;▼,为弱毒株[15];*,为CA16 A型株;以疫苗候选株(KF055238)氨基酸序列为参比序列,序列相同的以“.”表示,若有变异则以相应的氨基酸表示。
2.4 CA16 VP1结构蛋白B淋巴细胞表位预测 挑选与其他株氨基酸同源性最高的宁波株(JQ315113)进行研究,用DNA Star中的Protean对其VP1氨基酸序列进行B淋巴细胞抗原表位预测。结合Gamier-Robson方法和Chou-Fasman方法预测发现VP1蛋白中存在丰富的β折叠,较多的β转角,无规则卷曲结构较少,α螺旋区很少。根据DNA Star软件Protean模块对VP1蛋白的亲水性、柔韧性、抗原性指数和表面可能性的预测结果,见图2。 选取亲水性高(指数≥0)、柔韧性好、可及性大(指数≥1)和抗原性强(指数≥0)的区域,同时参考VP1蛋白二级结构的预测结果,选取包含无规则卷曲和/或β转角区域,VP1蛋白中获得13个可能的B细胞抗原表位(氨基酸肽段),分别为:10-20,30-38,57-62,73-79,98-106,118-123,159-168,173-177,184-189,240-246,265-273,274-284,289-295。见表6。
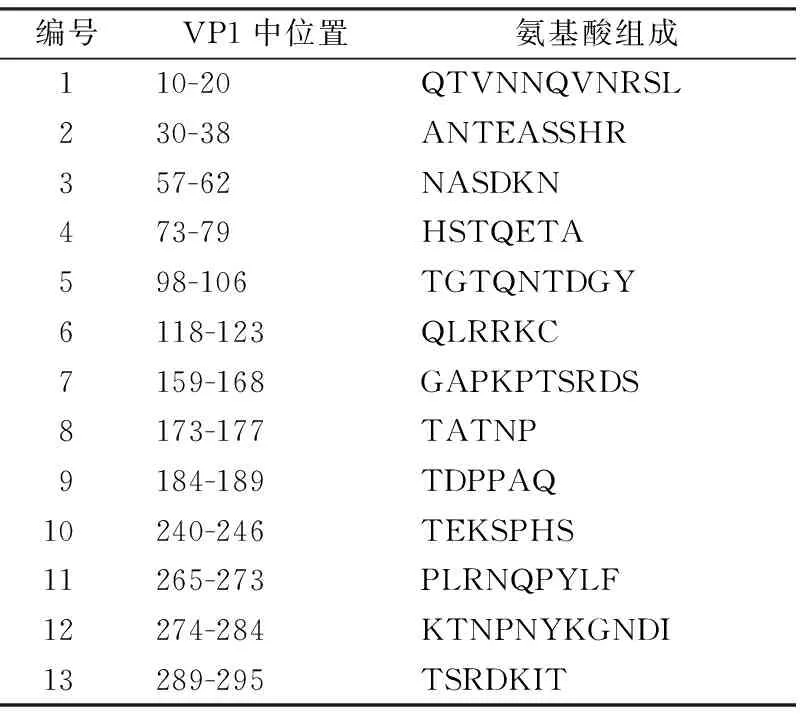
表6 CA16 VP1蛋白可能的B细胞抗原表位
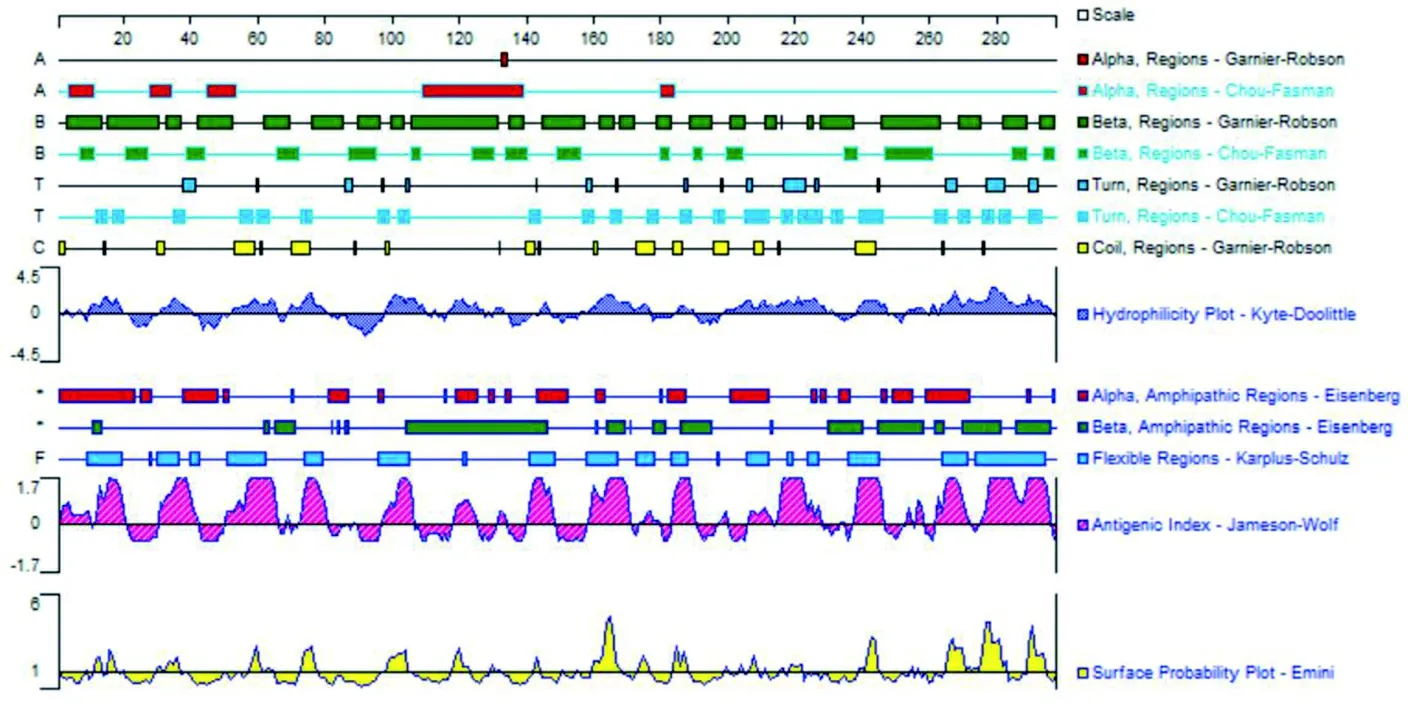
图2 CA16 VP1蛋白的亲水性、柔韧性、抗原指数、表面可及性的预测结果
3 讨论
本研究选用VP1基因序列进行系统进化分析,发现浙江CA16流行株VP1序列与其原型株相比发生了变化,已进化为A和B 2个基因型。浙江CA16流行株存在多个传播链,主要为B1b和B1a 2个亚型,也有少数为A型,与中国整体CA16流行情况一致[6,16],但与葛琼等[17]报道的结果有所不同。2008年曾在安徽阜阳首次发现CA16 A型株(EU812514),2010年在浙江省再次检出CA16 A型宁波株(JQ315094)。浙江B1b和B1a流行株分别与江苏株(KT327155)和安徽株(KC755230)亲缘关系较近,说明浙江省CA16流行株已经与邻近省份的CA16流行株存在共同进化和循环。
CA16进化速率相对于EV71相对缓慢[9],但作为RNA病毒,其本身的变异频率不低。VP1中包含主要的中和抗原决定簇和毒力相关位点及大量宿主细胞受体结合位点[6-8, 13-14],因此对CA16 VP1氨基酸序列变异的研究尤为重要。浙江省CA16流行株VP1氨基酸序列出现多个变异位点,各基因亚型变异情况有所不同。温州CA16流行株均出现了L23M改变,其致病性和毒力可能发生改变,从而引起HFMD暴发。Shi等[18]曾在VP1上发现了6个高度保守的中和线性抗原表位,浙江省大部分CA16流行株在这些抗原表位上未见突变,但KC507895株出现G1W、Q48R、M230V、T287S变异,KP289415株变异表现为G1W、N14S、Q23M、N108Y、L113F,JQ315094株表现为Q101R、N102D、L119M、E213A、L215P、A217S、L220A变异,这些氨基酸变异是否直接影响病毒抗原性,有待进一步研究。有文献报道VP1上存在多个与毒力和致病性相关的位点,这些位点发生变异(R51K、K52R、T98M、N102D、T103A、E145V、N218D、E241K、T248A和T/H295A)可使病毒毒力减弱,其中N102D和E241K氨基酸发生改变毒力明显降低[6-8,13-14]。A型宁波株(JQ315094)在102和145位发生了氨基酸改变,宁波株(JQ315108)在295位发生了氨基酸改变,其他浙江流行株在以上几个毒力位点未发现改变。推测近几年浙江省由CA16引起HFMD的临床症状较轻,可能与其致病性和毒力未发生较大改变有关。VP1第94-108位氨基酸肽段是一个保守型线性中和抗原表位,其发生N102D突变可以使该CTL抗原表位的亲和力下降[13],A型宁波流行株(JQ315094)在该抗原表位上发了N102D突变,属于中性氨基酸突变为酸性氨基酸,其毒力和致病性减弱。浙江省CA16流行株与3个疫苗候选株(KF055238、JN590244、EU262658)[8,10-12]相比,有多个位点氨基酸发生变异,因此在选择CA16疫苗株时,要考虑不同地区各基因型中氨基酸变异情况。
目前尚无针对CA16病毒的特效药物,接种疫苗是控制该病毒最有效的手段,但CA16疫苗还处在临床前研究阶段[8,10-14]。中和表位确定是疫苗研制的重要基础,而表位筛选是确定抗原表位的主要手段。本研究对GenBank上浙江省所有CA16病毒VP1基因序列进行比较,通过进化树、同源性和氨基酸变异的分析,发现浙江省除A型宁波株外,其他34株流行株VP1氨基酸同源性在97.6%以上,提示浙江省CA16流行株VP1区高度保守,VP1的抗原性可能无明显变化,这对疫苗研制十分重要。通过生物分析软件成功预测了宁波株(JQ315100)VP1蛋白有13个潜在的B淋巴细胞抗原表位(氨酸肽段),分别为:10-20、30-38、57-62、73-79、98-106、118-123、159-168、173-177、184-189、240-246、265-273、274-284和289-295。通过序列比对发现这些B淋巴细胞抗原表位在浙江省CA16不同基因亚型流行株高度保守,与石金平和高孟等[18-19]发现的VP1抗原表位有所不同。这些高度保守的CA16 B淋巴细胞抗原表位的发现为HFMD疫情防控和CA16疫苗研发提供科学依据。GenBank中浙江省CA16流行株VP1基因序列较少,本研究中浙江省35个CA16流行株仅来自杭州、宁波和温州3个地方,尚存在着一定的局限性,提示我们在今后的HFMD防控工作中,应进一步扩大研究范围,加强对CA16病毒基因型及变异的监测,以便做更全面准确的分析。
[1]李兰娟. 手足口病[M]. 第1版. 杭州: 浙江科学技术出版社, 2008: 25-33.
[2]Astrup BS, Johnsen IB, Engsbro AL. The role of Coxsackievirus A16 in a case of sudden unexplained death in an infant-A SUDI case[J]. Forensic Sci Int, 2015, 259: e9-13.
[3]Zhou HT, Wang B, Che XY. Nephrotic syndrome in hand, foot and mouth disease caused by coxsackievirus A16: a case report[J]. Int J Infect Dis, 2014, 28: 1-2.
[4]夏时畅. 2014年浙江省疾病预防控制技术报告[M]. 第1版. 杭州:浙江科学技术出版社, 2015: 15-16.
[5]吴晨, 吴昊澄, 丁哲渊, 等. 2008-2015年浙江省手足口病流行特征分析[J]. 疾病监测, 2016, 31(10): 831-837.
[6]刘杨, 郭春艳, 张西嫔, 等. 柯萨奇病毒A16型VP1基因和病毒生物物理学分析[J]. 中华实验和临床感染病杂志电子版, 2015, 9(2): 28-32.
[7]张高博. 柯萨奇病毒A组16型感染性cDNA构建及应用[D]. 武汉:武汉生物制品研究所, 2015: 1-91.
[8]姜广菊. 柯萨奇病毒A组16型减毒疫苗候选株的筛选[D]. 北京:北京协和医学院, 2014: 1-62.
[9]Zhang Y, Wang D, Yan D,etal. Molecular evidence of persistent epidemic and evolution of subgenotype B1 coxsackievirus A16-associated hand, foot, and mouth disease in China[J]. J Clin Microbiol, 2010, 48(2): 619-622.
[10]陈祥鹏, 檀晓娟, 张勇, 等. 柯萨奇病毒A组16型灭活抗原对小鼠免疫保护作用的研究[J]. 病毒学报, 2014, 30(3): 226-232.
[11]Ku Z, Liu Q, Ye X,etal. A virus-like particle based bivalent vaccine confers dual protection against enterovirus 71 and coxsackievirus A16 infections in mice[J]. Vaccine, 2014, 32(34): 4296-4303.
[12]Li J, Chang J, Liu X,etal. Protection from lethal challenge in a neonatal mouse model by circulating recombinant form Coxsackievirus A16 vaccine candidates[J]. J Gen Virol, 2014, 95(Pt 5):1083-1093.
[13]Li J, Liu G, Liu X,etal. Optimization and characterization of candidate strain for Coxsackievirus A16 inactivated vaccine[J]. Viruses, 2015, 7(7): 3891-3909.
[14]谢振锋. 四株CoxA16病毒免疫原性及毒株间交叉保护的比较分析[D]. 北京:北京协和医学院, 2013: 1-62.
[15]李志群. 肠道病毒71型(EV71)与柯萨奇病毒A组16型(CA16)单克隆抗体治疗的可行性评价[D]. 厦门: 厦门大学, 2014: 1-89.
[16]Zhao G, Xun Z, Wang C,etal. Characterization of VP1 sequence of Coxsackievirus A16 isolates by Bayesian evolutionary method[J]. Virol J, 2016, 13(1):130-140.
[17]葛琼, 龚黎明, 茅海燕, 等. 2008-2013年浙江省柯萨奇病毒A组16型VP1区基因特征分析[J]. 疾病监测, 2015, 30(4): 280-283.
[18]Shi J, Huang X, Liu Q,etal. Identification of conserved neutralizing linear epitopes within the VP1 protein of Coxsackievirus A16[J].Vaccine, 2013, 31(17):2130-2136.
[19]高孟, 倪红霞, 朱莲, 等. 柯萨奇病毒A16型衣壳蛋白VP1~VP3的B淋巴细胞线性抗原表位预测与确定[J]. 中华临床感染病杂志, 2015, 8(6): 543-548.
(本文编辑:周万青,刘群)
Analysis for characteristics ofCoxsaekievirusA16VP1 gene and prediction of B lymphocyte antigen epitopes in Zhejiang province, China
XULi1,2,3,CUIDa-wei1,2,DAIYu-zhu3,WANGLei1,2,3,YANGXian-zhi1,2,XIEGuo-liang1,2,ZHENGShu-fa1,2,SUNChang-gui3,CHENGJun3,CHENYu1,2
(1.DepartmentofLaboratoryMedicine,theFirstAffiliatedHospital,CollegeofMedicine,ZhejiangUniversity,Hangzhou310003,Zhejiang; 2.KeyLaboratoryofClinicalinvitroDiagnosticTechniquesofZhejiangProvince,Hangzhou310003,Zhejiang; 3.DepartmentofLaboratoryMedicine,the117thHospitalofPLA,Hangzhou310013,Zhejiang,China)
Objective To understand the genetic characteristics and the variation pattern of theVP1 gene among the Coxsackievirus A16 (CA16) strains isolated in Zhejiang province, and predict the possible B lymphocyte antigen epitopes in the VP1 protein. Methods All theVP1 gene sequences of 35 CA16 strains isolated in Zhejiang and 69 genotyped reference strains were retrieved from GenBank. MEGA6.0 software was used to compare these sequences and constructed phylogenetic tree to determine the genotypes of the CA16 strains isolated in Zhejiang, and the analysis of homology consistency of nucleotide and mutation of amino acid were performed. DNA Star Protean module was used to predict the possible B lymphocyte antigen epitopes in the VP1 protein. Results There were 2 genotypes among the CA16 strains in Zhejiang province, i.e., B1 genotype (34 strains) and A genotype (1 strain). B1b subtype (24 strains) dominated in B1 genotype, followed by B1a subtype (10 strains). The homology consistency of nucleotide and amino acid of VP1among all the CA16 strains in Zhejiang were 75.5% to 100% and 89.5% to 100% respectively. The amino acid sequences of VP1 among the CA16 strains in Zhejiang were highly conserved, but there were also some variations among them. There were 13 possible B lymphocyte antigen epitopes (amino acid peptides) in the VP1 protein, i.e., 10-20, 30-38, 57-62, 73-79, 98-106, 118-123, 159-168, 173-177, 184-189, 240-246, 265-273, 274-284 and 289-295. Conclusion Two genotypes, A and B1, in CA16 strains were isolated in Zhejiang. B1b and B1a were the major subtypes. The amino acid mutation degree of VP1 protein of CA16 strains in Zhejiang was quite low. The prediction of 13 B lymphocyte antigen epitopes in the VP1 protein could provide scientific reference foundation for the development of the vaccine against CA16 strain.
CoxsaekievirusA16; VP1; genetic characteristics; amino acid variations; B lymphocyte antigen epitope
10.13602/j.cnki.jcls.2017.01.18
国家科技重大专项“传染病监测技术平台”项目(2012ZX10004-210)。
徐莉,1987年生,女,硕士研究生,从事分子病毒学研究,E-mail:xuli1112@126.com。
陈瑜,主任医师,博士研究生导师,E-mail:chenyu-zy@163.com。
R512.5
A
2016-11-04)
