Xpert艰难梭菌检测系统的临床应用评价*
2017-03-29黄旭刘成成徐婷唐晨杰夏文颖倪芳王芳刘根焰
黄旭,刘成成,徐婷,唐晨杰,夏文颖,倪芳,王芳,刘根焰
(南京医科大学第一附属医院检验学部,南京 210029)
Xpert艰难梭菌检测系统的临床应用评价*
黄旭,刘成成,徐婷,唐晨杰,夏文颖,倪芳,王芳,刘根焰
(南京医科大学第一附属医院检验学部,南京 210029)
目的 评估Xpert艰难梭菌检测系统的临床应用价值。方法 选取43份腹泻粪便标本,采用厌氧培养法、VIDAS检测A/B毒素法和Xpert艰难梭菌检测系统检测艰难梭菌,以产毒培养法作为金标准对检测方法进行评价,并比较不同检测方法对临床标本检测结果的一致性。通过自配027型标准菌株模拟粪便标本,验证Xpert艰难梭菌检测系统筛选027型流行株的能力。结果 以产毒培养法为金标准,Xpert艰难梭菌检测系统的敏感性和特异性分别为90.9%和93.8%,阳性和阴性预测值分别为 83.3%和96.8%。与产毒培养法结果一致性检验Kappa值为0.822(P<0.05),与VIDAS检测A/B毒素法结果一致性检验Kappa值为0.419(P<0.05);027型标准菌株模拟粪便标本检测结果阳性并报告为027型。结论 Xpert艰难梭菌检测系统能够快速准确地检测粪便标本中的艰难梭菌相关基因,且能准确报告027型高产毒力菌株。
艰难梭菌;Xpert艰难梭菌检测系统;产毒培养
艰难梭菌(Clostridiumdifficile)是一种专性厌氧的革兰阳性粗大芽胞杆菌,属肠道条件致病菌,其感染可以导致轻中度腹泻、伪膜性肠炎(pseudomembranous colitis,PMC)甚至中毒性巨结肠[1]。近年来,我国艰难梭菌的感染率逐年上升,院内感染相关腹泻患者平均感染率为14%,部分地区高达23%,且欧美地区流行的027型高产毒力菌株也在国内多个地区被发现[2]。因此,积极开展艰难梭菌检测新技术非常重要。
艰难梭菌感染的实验诊断方法主要有厌氧培养法、毒素的免疫法检测和基于相关毒素基因的分子检测。Xpert艰难梭菌检测系统(XpertC.difficileAssay)是基于荧光定量PCR技术的一站式粪便标本快速检测技术,能同时检测tcdB、二元毒素(binary toxin,cdtA和cdtB)和缺失ntΔ117的tcdC3种基因,且可以推测菌株是否为027/NAP1/BI型高产毒流行株。国外研究认为其可以快速直接检测粪便标本中的产毒艰难梭菌,具有高敏感性和高特异性[3-4]。国内少数实验室近年来也陆续引入Xpert艰难梭菌检测系统,其中瑞金医院微生物室还与传统培养法进行了比较研究,但没有与产毒培养法进行比较和评估,也未评估其检测027/NAP1/BI型高产毒流行株的性能[5]。本研究以产毒培养(toxigenic culture)法为参比方法,评估Xpert艰难梭菌检测系统的敏感性和特异性,并以027/NAP1/BI标准菌株的模拟粪便标本验证其预测027型高产毒力菌株的能力,同时还分析比较了Xpert艰难梭菌检测系统与现有检测方法的优缺点。
1 材料和方法
1.1 标本收集 收集2016年3月至7月南京医科大学第一附属医院门诊及住院患者腹泻粪便标本43份,包括32份冻存标本和11份新鲜标本。实验室自配ATCC BAA-1870(核糖体分型为027型)标准菌株(广州医科大学吴爱武教授惠赠)的菌液及模拟粪便标本。
1.2 主要仪器与试剂 GeneXpert荧光定量检测系统和XpertC.difficile检测试剂盒(美国Cepheid公司);哥伦比亚血平板、GENbag厌氧产气袋、梅里埃Vitek 2 Compact全自动细菌鉴定系统、ANC卡、VIDAS全自动免疫分析仪和艰难梭菌毒素A/B(CDAB)检测试剂盒(法国生物梅里埃公司);2720型基因扩增仪(美国Applied Biosystems公司);GelDoc XR 凝胶成像系统(美国Bio-Rad公司);细菌基因组DNA提取试剂盒(北京天根公司);2×PCR Master Mix、RNA-free water(TaKaRa公司);PCR引物由南京金斯瑞生物科技公司合成。
1.3 Xpert艰难梭菌检测 严格按照艰难梭菌检测试剂盒说明书进行稀便标本的前处理,然后按照GeneXpert仪器操作说明书进行荧光定量PCR,检测标本中艰难梭菌的tcdB、二元毒素和缺失型tcdC基因。临床样本及模拟粪便样本的检测均按照以上流程进行。模拟粪便标本制备:挑取黄豆大小正常粪便标本于1.5 mL EP管中,加1 mL生理盐水稀释,用10 μL接种环挑取0.5麦氏浊度单位027型标准菌株菌悬液于粪便稀释液中(约相当于106菌量),震荡混匀,制成模拟粪便标本。
1.4 艰难梭菌产毒培养法 根据美国医疗保健流行病学学会(SHEA)和美国感染病学会(IDSA)指南[6],选择艰难梭菌产毒培养作为Xpert方法评估的金标准,艰难梭菌培养阳性并且其tcdA和(或)tcdB基因阳性定义为产毒培养阳性。培养时将收集的稀便标本接种2块哥伦比亚血琼脂平板,其中一块平板和厌氧指示剂同时放入厌氧袋内,置于35 ℃、5% CO2培养48 h;另一块直接置于35 ℃、5% CO2培养48 h。细菌鉴定采用生物梅里埃公司的Vitek 2 Compact仪器和配套的ANC厌氧菌鉴定卡,并按说明书进行操作。菌株的毒素基因鉴定采用实验室自建tcdA和tcdB基因PCR检测技术[7]。
1.5 A/B毒素酶联荧光免疫检测 采用生物梅里埃公司的VIDAS系统和CDAB试剂盒,并按说明书进行操作。
1.6 统计学分析 以产毒培养为金标准,用SPSS 21软件计算敏感性、特异性、阳性预测值和阴性预测值。并将Xpert艰难梭菌检测结果与产毒培养法、VIDAS检测A/B毒素法检测结果分别作一致性检验。以P<0.05为有统计学意义。
2 结果
2.1 不同检测方法比较 43例标本共分离培养艰难梭菌11株,且产毒培养法鉴定均为A/B毒素基因双阳性产毒株,其余32例培养阴性。Xpert艰难梭菌检测法结果为12例阳性,31例阴性,未发现027/NAP1/BI型高产毒流行株,见表1。以产毒培养法为金标准,Xpert艰难梭菌检测法的敏感性、特异性、阳性预测值和阴性预测值分别为90.9%、93.8%、83.3%和96.8%。Xpert艰难梭菌检测法和产毒培养法比较,一致性检验Kappa值为0.822(P<0.05)。

表1 Xpert艰难梭菌检测法结果
43例标本经VIDAS系统CDAB试剂盒定量检测艰难梭菌A/B毒素,结果4例阳性,39例阴性,和Xpert艰难梭菌检测法比较,一致性检验结果为Kappa值为0.419(P<0.05),见表2。
表2 Xpert艰难梭菌检测法与VIDAS系统CDAB检测法一致性检验

Xpert艰难梭菌检测法VIDAS系统A/B毒素法阳性阴性总数阳性4812阴性03131总数43943
2.2 模拟粪便标本检测结果 Xpert检测系统检测实验室自配ATCC BAA-1870模拟粪便标本,报告结果为tcdB、tcdC和Binary Toxin基因阳性,统计过程控制(statistical process control, SPC)显示在控,并预测该菌株为027型高产毒力菌株,见图1。
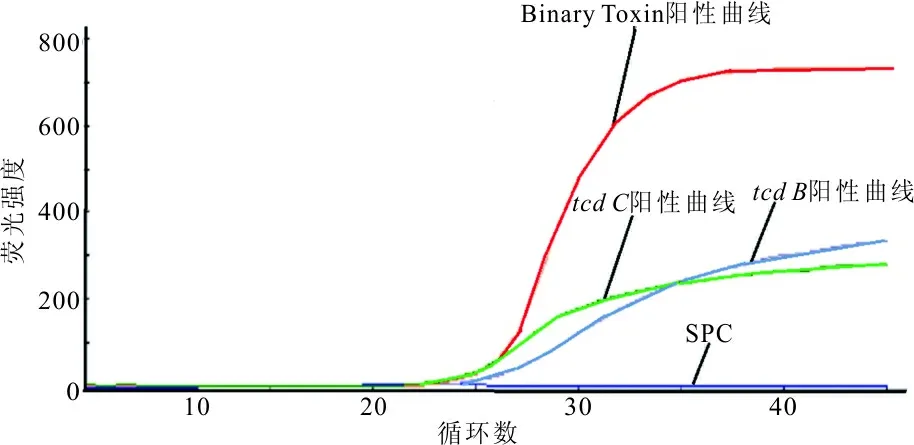
图1 Xpert艰难梭菌检测系统鉴定027型艰难梭菌的阳性曲线
3 讨论
艰难梭菌是院内感染性腹泻最常见的病原菌,快速检测是临床诊治和感染控制的关键。尽管产毒培养法敏感性和特异性都很高,但厌氧培养和细菌鉴定设备和技术要求高,且报告周期长(48~72 h),临床推广使用困难[1]。本研究所评价的Xpert艰难梭菌商品化检测系统直接检测临床粪便标本,除5 min左右的样本前处理操作外,其余检测均一站式解决,耗时只需要45 min。研究结果显示,Xpert艰难梭菌检测系统和产毒培养法比较的敏感性和特异性均高于90%,2种方法存在较高的一致性,与国外研究结果一致[3-4]。当与VIDAS免疫法毒素检测系统比较时,2种方法的结果一致性差(Kappa=0.419),这与免疫法检测A/B毒素的敏感性和特异性显著低于毒素基因的分子检测技术有关。因此建议免疫法检测艰难梭菌A/B毒素应和高敏感性谷氨酸脱氢酶(glutamate dehydrogenase,GDH)试验结合,实现毒素定量检测的同时,降低毒素免疫学检测的假阴性[8]。本研究通过模拟标本验证了Xpert艰难梭菌系统检测027型高产毒株的性能,该性能有助于实验室常规监测027/NAP1/BI型高产毒株,提升医院感染控制和预防高产毒株暴发流行的能力[4,9]。
本研究标本量偏少,11例阳性分离株均为产毒株,未分离到非产毒株,对于评价Xpert艰难梭菌系统在产毒株鉴别方面尚存不足。而临床不产毒艰难梭菌在成人和儿童肠道定植菌中均有存在,有报道2岁以下儿童不产毒艰难梭菌定植率高达26.5%[10]。Xpert艰难梭菌系统主要通过检测tcdB
基因来诊断产毒艰难梭菌感染,临床产毒株的毒素基因型绝大部分是tcdA+tcdB+型,少数表现为tcdA-tcdB+,尚未发现tcdA+tcdB-型艰难梭菌。因此,Xpert艰难梭菌系统的检测模式符合临床需求,可以用于临床艰难梭菌感染的快速诊断,且可以预警027型高产毒株的流行。
[1]赵建宏, 杨靖. 艰难梭菌感染流行病学特征、实验室诊断与治疗的研究进展[J]. 临床检验杂志, 2013, 31(1): 40-43.
[2]Tang C, Cui L, Xu Y,etal. The incidence and drug resistance ofClostridiumdifficileinfection in Mainland China: a systematic review and meta-analysis[J]. Sci Rep, 2016, 6: e37865.
[3]Babady NE, Stiles J, Ruggiero P,etal. Evaluation of the Cepheid XpertClostridiumdifficileEpi assay for diagnosis ofClostridiumdifficileinfection and typing of the NAP1 strain at a cancer hospital[J]. J Clin Microbiol, 2010, 48(12): 4519-4524.
[4]Shin BM, Yoo SM, Shin WC. Evaluation of XpertC.difficile, BD MAX Cdiff, IMDxC.difficilefor Abbott m2000, and IllumigeneC.difficileassays for direct detection of toxigenicClostridiumdifficilein stool specimens[J]. Ann Lab Med, 2016, 36(2): 131-137.
[5]陈旭, 董丹凤, 韩立中, 等. GeneXpert实时荧光定量PCR快速检测艰难梭菌的临床评估[J]. 检验医学, 2014, 29(6): 590-593.
[6]Cohen SH, Gerding DN, Johnson S,etal. Clinical practice guidelines forClostridiumdifficileinfection in adults: 2010 update by the society for healthcare epidemiology of America (SHEA) and the infectious diseases society of America (IDSA)[J]. Infect Control Hosp Epidemiol, 2010, 31(5): 431-455.
[7]谢乐, 许雨乔, 刘成成, 等. 实时荧光定量PCR直接检测粪便标本艰难梭菌tcdB基因[J]. 临床检验杂志, 2016, 34(3): 211-214.
[8]Chapin KC, Dickenson RA, Wu F,etal. Comparison of five assays for detection ofClostridiumdifficiletoxin[J]. J Mol Diagn,2011, 13(4): 395-400.
[9]Lessa FC, Mu Y, Bamberg WM,etal. Burden ofClostridiumdifficileinfection in the United States[J]. N Engl J Med, 2015, 372(9): 825-834.
[10]Rousseau C, Lemee L, Le Monnier A,etal. Prevalence and diversity ofClostridiumdifficilestrains in infants[J]. J Med Microbiol, 2011, 60(Pt 8): 1112-1118.
(本文编辑:周万青,刘群)
Clinical application evaluation of Xpert detection system ofClostridiumdifficile
HUANGXu,LIUCheng-cheng,XUTing,TANGChen-jie,XIAWen-ying,NIFang,WANGFang,LIUGen-yan
(DepartmentofLaboratoryMedicine,theFirstAffiliatedHospitalofNanjingMedicalUniversity,Nanjing210029,Jiangsu,China)
Objective To evaluate the clinical application value of Xpert detection system ofClostridiumdifficile(C.difficile). Methods A total of 43 stool specimens from the patients with diarrhea were collected, andC.difficilein stool specimens were detected by the Xpert detection system, the toxigenic culture method, and the toxin detection method which detected the toxin ofC.difficileby VIDAS automatic analyzer after anaerobic culture, respectively. The analytic performance of Xpert detection system was evaluted based on the toxigenic culture method as the gold standard. Meanwhile, the consistency of the results from different detection methods was compared. The ribotype 027 strain (ATCC BAA-1870) simulating the stool specimen was further used to verify the Xpert detection system. Results Based on the gold standard of the toxigenic culture method, the sensitivity, specificity, positive predictive value and negative predictive value of the Xpert detection system were 90.9%, 93.8%, 83.3% and 96.8%, respectively. The Kappa values for the consistency between the Xpert detection system and the toxigenic culture method or the toxin detection method were 0.822 (P<0.05) and 0.419 (P<0.05), respectively. Moreover, the ribotype 027 strain simulating the stool specimen was verified by the Xpert detection system successfully. Conclusion The Xpert detection system may rapidly and accurately detect theC.difficilein stool specimens, especially the ribotype 027 strain with high toxicity.
Clostridiumdifficile; Xpert detection system ofClostridiumdifficile; toxigenic culture
10.13602/j.cnki.jcls.2017.01.09
江苏省“兴卫工程”实验诊断学重点实验室(XK201114);卫生部肠道病重点实验室(EM201401)。
黄旭,1991年生,女,硕士研究生,主要从事临床微生物的分子诊断研究。
刘根焰,副主任医师,副教授,硕士研究生导师,E-mail:liugenyan@njmu.edu.cn。
R446.5
A
2016-11-31)
