湿片封片技术在临床微生物镜检中的应用
2017-03-29陈东科
陈东科
(北京医院检验科,北京 100730)
湿片封片技术在临床微生物镜检中的应用
陈东科
(北京医院检验科,北京 100730)
目的 寻找一种简单实用可长期保存各类湿片的方法。方法 采用双层套封片法和改良Huber聚乙烯醇封片法进行封片,观察封片效果。结果 经长达14年的持续观察,采用双层套封片法保存的湿片,染液、菌体以及镜检效果与初制时无异,但只能在低倍和高倍镜下观察,不能用油镜;改良Huber聚乙烯醇封片法封片后可以进行油镜观察,经固定的真菌结构可保存不变。结论 两种封片方法的封片效果相当。双层套封片法适用范围更广。改良Huber聚乙烯醇封片法保存丝状真菌的效果最好,但进口试剂价格昂贵,短期内普及使用尚有困难。
湿片镜检;封片;形态学
形态学检验对微生物鉴定具有导航作用,是每一位微生物检验技术人员必须掌握的技能。在实际工作中经常需要保存涂片标本,以供复检、备检、交流、温习及教学等。革兰染色、抗酸染色、瑞氏染色等涂片通常用封片胶(中性树脂)直接封片保存。此封片方法同病理片封片法,但只适用于干片的封片,对于湿片(指压片制片镜检后的片子,如墨汁染色、碘染找原虫及虫卵、丝状真菌乳酸酚棉蓝染色等)就无法应用。笔者经过多年的研究和工作探索,总结出一种简单实用的湿片封片方法,可长期保存各类湿片,十多年后复检效果如初。本文介绍具体的操作方法。
1 材料与方法
1.1 试剂 超净高级封片胶(不含二甲苯,BA-7004,珠海贝索公司),一得阁墨汁(北京一得阁墨业公司),生理盐水、卢戈氏碘液、乳酸酚棉兰染液、10%中性福尔马林固定液均自配[1],改良Huber聚乙烯醇封固剂MYCO-PERM BLUE(美国Scientific Device Laboratory公司)。
1.2 耗材 一次性滴管,载玻片(一端为毛玻璃),盖玻片(22 mm×22 mm和20 mm×20 mm)。
1.3 双层套封片法
1.3.1 乳酸酚棉蓝染色片 (1)准备载玻片,在毛玻璃端用铅笔记录标本及培养等信息(或贴条码标签),信息面朝上;(2)在载玻片上滴加20 μL乳酸酚棉兰染液(如果用18 mm×18 mm盖玻片只需加15 μL),取20 mm×20 mm小培养盖玻片轻盖于染液上;(3)在20 mm×20 mm盖玻片上滴加4滴封片胶;(4)取一片22 mm×22 mm盖玻片轻盖于封片胶之上(避免压出气泡);(5)拿起载玻片控制其处于水平位置(或用接种环等控制大盖玻片位置),使封片胶均匀覆盖于20 mm×20 mm盖玻片四周;(6)将载玻片静置于水平台面晾干,使封片胶凝固。见图1。

图1 乳酸酚棉蓝染色的双层套封片法流程
1.3.2 墨汁染色片 取阳性脑脊液等标本,离心弃上清,沉淀加30 μL的10%中性福尔马林固定液混匀,再加10 μL墨汁混匀;将载玻片的信息面朝上,加20 μL混合液,取一片20 mm×20 mm盖玻片轻盖于混合液上(避免压出气泡);后续操作同1.3.1的步骤(3)~(6)。
1.3.3 碘染片 取阳性标本30 μL,加30 μL碘液混匀;将载玻片的信息面朝上,加20 μL混合液,取一片20 mm×20 mm盖玻片轻盖于混合液上(避免压出气泡);后续操作同1.3.1的步骤(3)~(6)。
1.3.4 不染色涂片 取阳性标本30 μL,加30 μL的10%中性福尔马林固定液混匀;将载玻片的信息面朝上,加20 μL混合液,取一片20 mm×20 mm盖玻片轻盖于混合液上(避免压出气泡);后续操作同1.3.1的步骤(3)~(6)。
1.4 改良Huber聚乙烯醇封片法 加1滴MYCO-PERM BLUE(PVA封固剂)到涂有真菌的玻片上,盖上盖玻片。如为小培养盖玻片,可直接将封固剂滴在盖玻片上,再反扣至载玻片上,见图2。有些菌丝生长丰富的真菌用此法封片会产生很多气泡,为避免此现象发生,封片前在小培养的盖玻片上可滴加酒精,使菌丝伏在盖玻片上,再加封固液。将封固后的玻片放置于水平位置晾干2~4 d。所有暴露真菌孢子及菌丝的开放式操作过程均在生物安全柜中进行。

图2 小培养标本的改良Huber聚乙烯醇封片法流程
1.5 玻片归档 充分晾干后的真菌片子可以先行消毒剂浸泡消毒后再归档。玻片归档前应检查玻片信息标注是否完整。湿片封固后最好平放(但平放占地较大,管理较困难),长时间竖放后大颗粒成分(如细胞、虫卵、孢子等)位置会下沉,但不影响镜检效果。应隔开一定间隙摆放,不可叠放。玻片尽量避光保存,以减缓褪色时间。标本量大的单位可专门设计智能玻片保存柜进行管理,调取方便快捷。
2 结果
2.1 双层套封片法封片直接镜检及保存后镜检的效果观察 乳酸酚棉蓝染色片双层套封片法封片后直接镜检效果良好,见图3。归档后定期镜检观察封固效果,发现染液未干涸,菌体未褪色,虫体(及卵)细胞未发生固缩、碎裂、溶解等。部分镜检结果见图4~6。
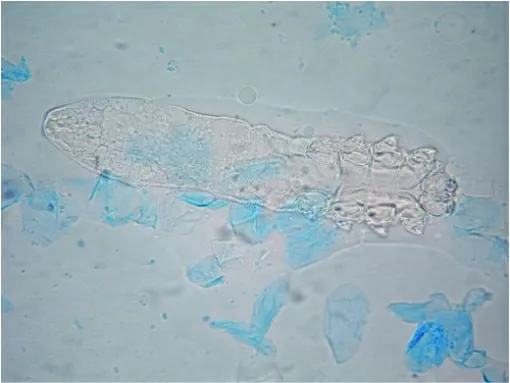
图3 毛囊分泌物乳酸酚棉蓝染色双层套封片法封片后毛囊蠕形螨的镜检结果(×400)

图4 脑脊液墨汁染色封片14年后隐球菌镜检效果(×400)

图5 便涂片碘染封片5年后十二指肠钩虫卵镜检效果(×400)

图6 胆汁标本不染色封片5年后华支睾吸虫卵镜检效果(×400)
2.2 改良Huber聚乙烯醇封片法封片直接镜检及保存后镜检的效果观察 标本直接涂片经干燥热固定后用PVA封固剂直接封染后的镜检效果见图7。改良Huber聚乙烯醇封片法直接封片可用油镜观察,见图8。封片前滴加酒精处理,可避免气泡产生,见图9。

图7 痰涂片改良Huber聚乙烯醇封片法直接封片后曲霉菌菌丝形态(×1 000)

图8 改良Huber聚乙烯醇封片法2个月后球形毛壳菌产孢镜检效果

图9 改良Huber聚乙烯醇封片法酒精处理前后镜检效果比较(×400)
3 讨论
采用双层套封片法封片可长期保存湿片,对于保存少见或难培养的病原形态,提供了一个较为实用的方法。笔者最长观察了14年,染液、菌体以及镜检效果均与初制时无异。影响保存质量最大的因素是封片时封片胶在第一层小盖玻片四周的密封程度,建议初学者使用18 mm×18 mm盖玻片与22 mm×22 mm盖玻片搭配,这样可以增加封边的宽度,但对于真菌小培养,18 mm×18 mm盖玻片有时会影响培养效果,因此技术熟练的操作者可以使用20 mm×20 mm盖玻片与22 mm×22 mm盖玻片搭配,以满足某些菌株培养的需要。封片加胶量应根据滴管口粗细而定,太少封不住,太多会溢出而在保存时粘连片盒。
用双层套封片法制出来的片子因双层盖玻片太厚,只能在低倍和高倍镜下观察,不能用油镜,这是该方法的不足之处。有些真菌产生的孢子较小,高倍镜下看不清楚,或是要观察某些细微结构就必须使用油镜。为解决这一问题,笔者查阅文献找到了改良Huber聚乙烯醇封片法[2],封片后可以进行油镜观察,经固定的真菌结构可保存数年不变。由于MYCO-PERM BLUE试剂为进口试剂,价格昂贵,笔者正在进行国产化试验,希望国内同行能在短期内使用到国产改良Huber聚乙烯醇封固剂。
[1]陈东科,孙长贵.实用临床微生物学检验与图谱[M]. 北京:人民卫生出版社,2011:77-85.
[2]Davise H. Larone. Medically important fungi: a guide to identification[M]. 5th Ed. Washington,DC:ASM press, 2011: 371-372.
(本文编辑:刘群)
10.13602/j.cnki.jcls.2017.01.11
陈东科,1961年生,男,副主任技师,研究方向:病原菌的分离与鉴定,细菌耐药机制,E-mail:c-d-k@263.net。
R446.5
A
2016-11-25)
