BCB和Zebularine对绵羊体细胞核移植胚胎发育效果的影响
2017-03-29李俊杰郝永兰刘爱菊李文瑞魏巧莉田树军孙树春
曹 慧,李俊杰,2*,郝永兰,刘爱菊,李文瑞,魏巧莉,田树军,2,孙树春,2
(1.河北农业大学动物科技学院,河北保定 071000;2.河北省牛羊胚胎工程技术研究中心,河北保定 071000)
BCB和Zebularine对绵羊体细胞核移植胚胎发育效果的影响
曹 慧1,李俊杰1,2*,郝永兰1,刘爱菊1,李文瑞1,魏巧莉1,田树军1,2,孙树春1,2
(1.河北农业大学动物科技学院,河北保定 071000;2.河北省牛羊胚胎工程技术研究中心,河北保定 071000)
为探究亮甲酚蓝(BCB)染色选择的卵母细胞是否有利于体细胞核移植胚胎的体外发育,本实验将卵丘-卵母细胞复合体(COCs)放入含有BCB的PBS中染色,根据细胞质颜色可将卵母细胞分成BCB+组和BCB-组,并以未经BCB处理的COCs作为对照组,然后将卵母细胞进行体外成熟,统计卵母细胞的成熟率。将成熟后的卵母细胞进行体细胞核移植,其中,部分BCB+组卵母细胞所需的供体细胞利用Zebularine处理,统计体细胞核移植的卵裂率、桑椹胚率和囊胚率。结果表明:BCB+组卵母细胞的成熟率显著高于对照组和BCB-组(71.15% vs 65.38%,53.52%,P<0.05); BCB+组核移植胚胎的卵裂率(87.91% vs 56.83%)、桑椹胚率(37.41% vs 21.73%)和囊胚率(21.48% vs 6.82%)均显著高于BCB-组(P<0.05);与对照组相比,BCB+组卵裂率(87.91% vs 83.23%)和囊胚率(21.48% vs 14.89%)也显著升高(P<0.05)。BCB+组供体细胞经Zebularine处理后,胚胎发育能力进一步提高,其中囊胚率显著高于BCB+组、对照组和BCB-组(29.25% vs 21.48%,14.89%,6.82%,P<0.05)。
BCB染色;Zebularine;绵羊;体细胞核移植
卵母细胞的质量直接影响着体细胞核移植效率,现阶段卵母细胞大多来源于屠宰场卵巢,其质量和所处发育阶段差别较大。前期研究表明,使用亮甲酚蓝(Brilliant Cresyl Blue, BCB)对猪[1]、牛[2]、山羊[3]、绵羊[4]、小鼠[5]等动物卵母细胞进行染色,能够筛选出具有更高发育潜能的卵母细胞。另有研究表明,在哺乳动物体细胞核移植过程中,降低DNA甲基化水平有利于体细胞核移植重编程的进行[6]。近年来在小鼠[7]、兔[8]、牛[9]、猪[10]上的研究表明,使用DNA甲基转移酶抑制剂处理供体细胞或重构胚能够降低供体细胞或重构胚的DNA甲基化水平,从而提高克隆胚胎的发育能力。Zebularine作为一种DNA甲基转移酶抑制剂,具有毒性低、稳定性强、半衰期长等特点[11-13]。使用Zebularine处理供体细胞或重构胚,获得了理想的体细胞核移植效果[14-16]。鉴于Zebularine与BCB共同应用于绵羊体细胞核移植的研究未见报道,为优化绵羊体细胞核移植技术程序,本实验拟在前期研究的基础上,使用BCB染色筛选卵母细胞,进而选用Zebularine处理绵羊供体细胞,研究BCB和Zebularine对绵羊体细胞核移植胚胎发育效果的影响。
1 材料与方法
1.1 主要化学试剂 本实验所用试剂除非特殊说明外均购自Sigma公司。采卵液:TCM199+5 mmol/L NaHCO3+10 mmol/L HEPES+10 mmol/L HEPESNa+20 mL/L FBS+0.04 g/L 肝素钠+0.05 g/L 青霉素+0.05 g/L 链霉素;卵母细胞成熟培养液:TCM199+1 mmol/L L-Glutamine+10 mg/L FSH+10 mg/L LH+20 ng/mL EGF+10% FBS(v/v)+1 mg/L E2;卵丘细胞培养液:DMEM+10% FBS;电融合液:0.3 mol/L D-甘露醇+0.1 mmol/L MgSO4+0.05 mmol/L CaCl2+0.5 mmol/L HEPES+0.1% BSA(w/v);离子霉素激活液:DPBS+ 2% FBS+ 5 μmol/L 离子霉素;6-DMAP激活液:DPBS+ 2% FBS+2 mmol/L 6-DMAP。
1.2 卵巢和卵母细胞的采集 从保定唐县绵羊定点屠宰场采集新鲜绵羊卵巢,立即放入盛有38℃左右灭菌生理盐水(含双抗)的保温瓶中,3~4 h内带回实验室。用刀片划破卵巢表面直径2~6 mm的卵泡,在体视显微镜下挑选胞质均匀、带有3层及3层以上完整致密卵丘细胞的卵丘-卵母细胞复合体(COCs)用于实验。
1.3 COCs的染色及体外成熟 将挑取合格的COCs分成两组,对照组COCs放入平衡好的mPBS(mPBS是在PBS中添加了1 g/L 葡萄糖、36 mg/L 丙酮酸钠、0.5 g/L BSA、0.05 g/L 庆大霉素[4])中作用90 min,实验组COCs放入含有26 μmol/L BCB的mPBS中,在38.5℃、5%CO2、饱和湿度环境中染色90 min[17],根据细胞质着色情况将卵母细胞分成两组:细胞质呈蓝色的卵母细胞为BCB+组,细胞质未着色的卵母细胞为BCB-组。然后将各组卵母细胞在成熟液中洗涤3~5次,移入经平衡的成熟液微滴中,10~20枚/100 μL,培养条件为38.5℃、5%CO2、饱和湿度,培养时间为19 h。体外成熟19 h后,取出COCs置于含0.1%透明质酸酶的操作液中用口径略大于卵母细胞直径的玻璃管反复吹打除去周围的卵丘细胞,在体视显微镜下挑选具有完整第一极体的卵母细胞,并以排出第一极体作为成熟的标志,统计卵母细胞成熟率。
1.4 绵羊卵丘细胞的培养 收集脱落的卵丘细胞于1.5 mL离心管中,加入含有10% FBS的DMEM培养液并离心,弃上清后加入相同的培养液吹打均匀,接种于培养皿中38.5℃、5%CO2、饱和湿度条件下培养。当卵丘细胞生长达到90%左右汇合时进行传代。本实验采用第3~4代对数生长期细胞进行不同处理。
1.5 供体细胞的准备 生长至对数生长期(汇合度为80%左右)的卵丘细胞,血清饥饿2 d,然后根据本实验室前期研究结果,实验组卵丘细胞经含有5 nmol/L Zebularine的卵丘培养液培养12 h[16],对照组卵丘细胞经常规卵丘细胞培养液培养12 h。实验前去除培养液,用0.25%胰蛋白酶消化处理2 min,用移液器吹打成单个细胞备用。
1.6 卵母细胞的去核和注核 将所获得的具有完整第一极体的BCB+组卵母细胞移入到含0.5 μg/mL秋水仙胺的操作液中处理 30 min 后,选择具有胞质突起的卵母细胞置于操作液中[18],在显微操作仪下进行显微操作。用去核针去除第一极体及突起的胞质。将体细胞注入到胞质质膜与透明带夹角处,使供体细胞膜与受体胞质质膜紧密接触以利于融合。BCB-组和对照组卵母细胞与BCB+组卵母细胞处理方法相同。
1.7 重构胚的融合与激活 将重构胚放入电融合液中平衡1~2 min,移入到电融合槽中,使卵丘细胞与去核卵母细胞胞质接触面与电流方向垂直。融合条件为1.25 kV/cm、30 μs、n=2。采用离子酶素+6-DMAP联合激活法。
1.8 重构胚的体外培养 各组重构胚在常规发育液中培养。胚胎培养过程中每48 h半量换液,48 h后统计卵裂率,第7天统计囊胚率。
1.9 统计分析 本实验中每组实验至少重复3次,实验数据使用SPSS21.0进行One-Way ANOVA差异显著性检验,P<0.05表示差异显著,结果均以平均值±标准误表示。
2 结果与分析
2.1 BCB染色情况 如图1所示,卵母细胞经BCB染色90 min,根据细胞质颜色可将卵母细胞分成两组,卵巢内生长完全的卵母细胞因缺乏葡萄糖-6-磷酸脱氢酶(G6PDH)而呈现蓝色(BCB+),处于卵巢内生长期的卵母细胞因含有大量的G6PDH而呈现无色(BCB-)[4,17]。
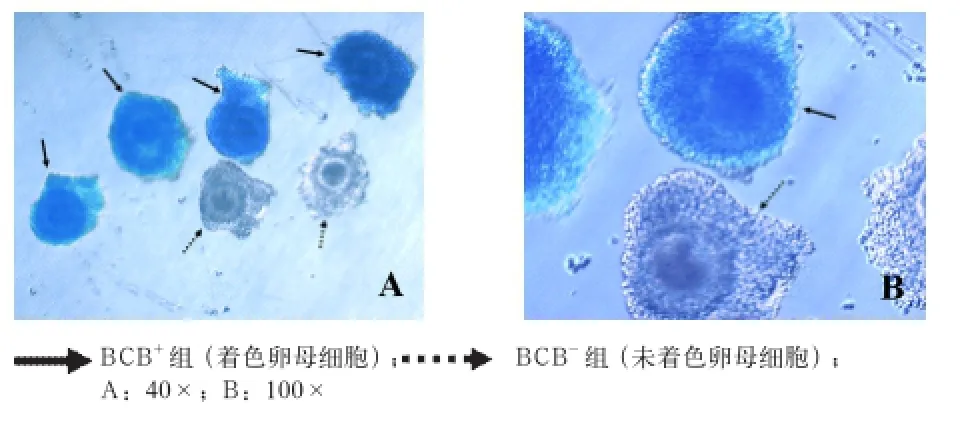
图1 BCB染色的卵丘-卵母细胞复合体
2.2 卵母细胞的体外成熟情况 经BCB染色后,卵母细胞着色与否对卵母细胞成熟率的影响见表1。BCB+组卵母细胞的成熟率显著高于对照组和BCB-组(71.15% vs 65.38%,53.52%,P<0.05),对照组卵母细胞的成熟率显著高于BCB-组(65.38% vs 53.52%,P<0.05)。

表1 BCB对绵羊卵母细胞体外成熟的影响
2.3 BCB染色及Zebularine处理供体细胞对绵羊体细胞核移植胚胎发育情况的影响 如表2所示,Zeb+BCB+组(卵母细胞经BCB染色胞质呈蓝色且供体卵丘细胞经Zebularine处理)和BCB+组核移植胚胎的卵裂率显著高于对照组和BCB-组(88.24%,87.91% vs 83.23%,56.83%,P<0.05),且对照组卵裂率也显著高于BCB-组(83.23% vs 56.83%,P<0.05),而Zeb+BCB+组和BCB+组核移植胚胎的卵裂率差异不显著。Zeb+BCB+组、BCB+组和对照组核移植胚胎的桑椹胚率显著高于BCB-组(39.41%,37.41%,35.63% vs 21.73%,P<0.05),而三组之间桑椹胚率差异均不显著。Zeb+BCB+组囊胚率最高,达29.25%,显著高于BCB+组、对照组和BCB-组(29.25% vs 21.48%,14.89%,6.82%,P<0.05)。
3 讨 论
在体细胞核移植过程中,卵母细胞的发育潜能(质量)是制约该技术成功率的主要因素之一。来自屠宰场卵巢的卵母细胞的质量和发育潜能存在较大的差异性。通常情况下,用观察卵母细胞周围卵丘细胞层的数量和紧密度以及卵母细胞胞质的均一性等形态学标准来选择卵母细胞,该种方法选择的卵母细胞发育潜能存在较大的差异性[19]。因此,寻找一种更科学更公正的卵母细胞选择方法就显得尤为重要。
通常认为, G6PDH在生长期卵母细胞中非常活跃,随着生长期的结束,其活性逐渐减弱直至消失。G6PDH活性的缺失是检测已经结束卵巢内生长的完全成熟的卵母细胞的一个间接方法。G6PDH能够降解BCB,因此,完成生长阶段的卵母细胞因缺乏G6PDH而呈现蓝色(BCB+),而处于生长期的卵母细胞则由细胞内的G6PDH降解BCB呈现无色(BCB-)。BCB染色不能提高第二次减数分裂中期(MⅡ期)卵母细胞的成熟率和体外受精率,但有助于筛选体外成熟前具有发育活性的卵母细胞。
本实验中,BCB+组卵母细胞的成熟率显著高于对照组和BCB-组,这个研究结果与之前在猪、牛、山羊、绵羊、小鼠等动物的体外成熟实验中利用BCB染色法筛选高质量卵母细胞的结果一致。经过体外发育实验,本实验中BCB+组和对照组核移植胚胎的卵裂率和桑椹胚率显著高于BCB-组。BCB+组核移植胚胎的囊胚率明显高于对照组和BCB-组。这些结果进一步证明了使用BCB染色卵母细胞能够有效筛选出发育能力强的卵母细胞,从而提高克隆效率。
然而,在体细胞核移植过程中,即使选择了发育潜能高、发育潜能均一的高质量卵母细胞,异常的表观遗传修饰依然存在,即高的DNA甲基化水平和低的组蛋白乙酰化水平[20-21]。有研究表明,使用浓度为5 nmol/L的5-aza-dC和Zebularine处理核移植重构胚,5-aza-dC实验组和Zebularine实验组的卵裂率分别为92.6%和93.3%,显著高于对照组的87.2%,并且Zebularine实验组的囊胚率为60.9%,显著高于5-aza-dC实验组的囊胚率(53.5%)[15]。Diao等[21]的实验结果表明,Zebularine处理供体细胞进行核移植后,囊胚率显著高于对照组和5-azadC处理组。本实验研究结果与前人结果相似,用Zebularine处理绵羊供体卵丘细胞,提高了囊胚发育率(29.25%)。并且在都选用BCB+卵母细胞作为受体细胞的情况下,加入Zebularine的处理组囊胚率显著升高(29.25% vs 21.48%)。这些研究结果表明,Zebularine作为一种DNA甲基转移酶抑制剂,很可能是降低了供体核的DNA甲基化水平,从而提高了核移植效率。

表2 BCB染色及Zebularine对绵羊体细胞核移植胚胎体外发育的影响
4 结 论
本实验结果表明,COCs体外成熟培养前以BCB染色筛选为依据,所得BCB+卵母细胞作为受体进行体细胞核移植,可以提高囊胚发育率;并且使用5 nmol/L Zebularine处理供体卵丘细胞,能够进一步提高BCB+卵母细胞核移植胚胎的发育能力,从而获得更高的囊胚发育率。
[1] Ⅰshizaki C, Watanabe H, Bhuiyan M M U,et al. Developmental competence of porcine oocytes selected by brilliant cresyl blue and matured individually in a chemically defined culture medium[J]. Theriogenology, 2009, 72: 72-80.
[2] Bhojwani S, Alm H, Torner H,et al. Selection of developmentally competent oocytes through brilliant cresyl blue stain enhances blastocyst development rate after bovine nuclear transfer[J]. Theriogenology, 2007, 67: 341-345.
[3] Rodriguez G E, Lopez B M, Velilla E,et al. Selection of prepubertal goat oocytes using the brilliant cresyl blue test[J]. Theriogenology, 2002, 57: 1397-1409.
[4] Catalá MG, Ⅰzquierdo D, Uzbekova S,et al. Brilliant Cresyl Blue stain selects largest oocytes with highest mitochondrial activity, maturation-promoting factor activity and embryo developmental competence in prepubertal sheep[J]. Reproduction, 2011, 142(4): 517-527.
[5] Wu Y G, Liu Y, Zhou P,et al. Selection of oocytes for in vitro maturation by brilliant cresyl blue staining: a study using the mouse model[J]. Cell Research, 2007, 17(8): 722-731.
[6] Wee G, Shim J J, Koo D B,et al. Epigenetic alteration of the donor cells does not recapitulate the reprogramming of DNA methylation in cloned embryos[J]. Reproduction, 2007, 134(6): 781-787.
[7] Kishigami S, Mizutani E, Ohta H,et al. Significant improvement of mouse cloning technique by treatment with trichostatin A after somatic nuclear transfer[J]. Biochem Biophys Res Commun, 2006, 340: 183-189.
[8] Shi L H, Miao Y L, Ouyang Y C,et al. Trichostatin A (TSA) improves the development of rabbit-rabbit intraspecies cloned embryos, but not rabbit-human interspecies cloned embryos[J]. Dev Dyn, 2008, 237: 640-648.
[9] Enright B P, Kubota C, Yang X,et al. Epigenetic characteristics and development of embryos cloned from donor cells treated by trichostatin A or 5-aza-2'-deoxycytidine[J]. Biol Reprod, 2003, 69: 896-901.
[10] Miyoshi K, Mori H, Mizobe Y,et al. Valproic acid enhances in vitro development and Oct-3/4 expression of miniature pig somatic cell nuclear transfer embryos[J]. Cell Reprogram, 2010, 12: 67–74.
[11] Yoo C B, Cheng J C, Jones P A. Zebularine: a new drug for epigenetic therapy[J]. Biochem Soc Trans, 2004, 32: 910-912.
[12] Cheng J C, Matsen C B, Gonzales F A,et al. Ⅰnhibition of DNA methylation and reactivation of silenced genes by zebularine[J]. J Natl Cancer Ⅰnst, 2003, 95(5): 399-409.
[13] Zhou L, Cheng X, Connolly B A,et al. Zebularine: a novel DNA methylation inhibitor that forms a covalent complex with DNA methyltransferases[J]. J Mol Biol, 2002, 321(4): 591-599.
[14] Jin D Ⅰ, Kenji N, Han R X,et al. Treatment of porcine fetal fibroblasts with DNA methylation inhibitors or histone deacetylation inhibitors improves development of nuclear transfer embryos[J]. Reprod Fert Develop, 2009, 21(1): 118.
[15] Saha A, Selokar N L, Panda S K,et al. Effect of DNA methylation inhibitors on the developmental competence of cloned buf f alo (bubalus bubalis) embryos [J]. Biol Reprod, 2011, 85: 781.
[16] 苏文龙,李璐,孟娜娜,等. Zebularine处理绵羊核供体卵丘细胞对其细胞周期和核移植胚胎发育效果的影响[J].中国畜牧杂志, 2014, 50(23):18-21.
[17] Mohammadi-Sangcheshmeh A, Veshkini A, Hajarizadeh A,et al. Association of glucose-6-phosphate dehydrogenase activity with oocyte cytoplasmic lipid content, develpomental competence, and expression of candidate genes in a sheep model[J]. J Assist Reprod Genet, 2014, 31(8): 1089-1098.
[18] 李俊杰, 李俊, 孙洁, 等. 提高山羊卵丘细胞核移植效果的研究[J]. 中国农业科学, 2009, 42(6): 2142-2148. [19] Su J, Wang Y, Li R,et al. Oocytes selected using BCB staining enhance nuclear reprogramming and the in vivo development of SCNT embryos in cattle[J]. PLoS One, 2012, 7(4): e36181.
[20] Wen B Q, Li J, Li J J,et al. The histone deacetylase inhibitor Scriptaid improves in vitro developmental competence of ovine somatic cell nuclear transferred embryos[J]. Theriogenology, 2014, 81(2): 332-339.
[21] Diao Y F, Naruse K J, Han R X,et al. Treatment of fetal fi broblasts with DNA methylation inhibitors and/or histone deacetylase inhibitors improves the develop of porcine nuclear transfer-derived embryos[J]. Anim Reprod Sci, 2013, 141(3-4): 164-171.
Ef f ect of Brilliant Cresyl Blue Staining and Zebularine on Development of Somatic Cell Nuclear Transfer Embryos in Sheep
CAO Hui1, LⅠ Jun-jie1,2*, HAO Yong-lan1, LⅠU Ai-ju1, LⅠ Wen-rui1, WEⅠ Qiao-li1, TⅠAO Shu-jun1,2, SUN Shu-chun1,2
(1. College of Animal Science and Technology, Agricultural Univesity of Hebei, Hebei Baoding 071000, China; 2. Research Cencer of Cattle and Sheep Embryo Engineering Technique of Hebei, Hebei Baoding 071000, China)
To investigate whether oocytes selecting were favorable for the development of somatic cell nuclear transfer embryosin vitroby brilliant cresyl blue (BCB) staining, the cumulus-oocyte complexes (COCs) were stained in PBS containing BCB. According to the color of cytoplasm, the oocytes were divided into two groups: BCB+group and BCB-group. The COCs without BCB treatment were used as the control group, then the oocytes were maturatedin vitroand the maturation rate of oocytes was counted. The matured oocytes were then subjected to somatic cell nuclear transfer. The cumulus cells treated with Zebularine were used as the donor cells of some BCB+oocytes. The cleavage rate, morula rate and blastocyst rate were counted. Results showed that the maturation rate of BCB+group was signif i cantly higher than that of control group and BCB-group (71.15% vs 65.38%, 53.52%,P<0.05); after somatic cell nuclear transfer, the development level of cloned embryos was evaluated, there is signif i cant dif f erence in the cleavage rate (87.91% vs 56.83%), morula rate (37.41% vs 21.73%) and blastocyst rate (21.48% vs 6.82%) between BCB+group and BCB-group (P<0.05). Compared with the control group, the cleavage rate (87.91% vs 83.23%) and blastocyst rate (21.48% vs 14.89%) of BCB+group were also signif i cantly higher (P<0.05). When donor cells were treated with Zebularine, the blastocyst rate of the BCB+group (Zeb+BCB+group) was further increased, it was signif i cantly higher than that of BCB+ group, control group and BCB-group (29.25% vs 21.48%, 14.89%, 6.82%,P<0.05).
Brilliant cresyl blue (BCB) staining; Zebularine; Sheep; Somatic cell nuclear transfer
S826.3
A
10.19556/j.0258-7033.2017-03-058
2016-10-08;
2016-11-11
河北省自然科学基金(C2014204119);河北省高等学校科学技术研究项目(ZD2014002)
曹慧(1989-),女,河北正定人,在读硕士研究生,主要从事动物繁殖与胚胎工程研究,E-mail: caohui8529@163.com
*通讯作者:李俊杰,男,博士,教授,E-mail: lijunjie816@163.com
