猪IGFBP2基因多态性及其与胴体、肉质性状的关联分析
2017-03-29杨华,徐珍,左波*
杨 华,徐 珍,左 波*
(1. 湖北省生猪健康养殖协同创新中心,农业部动物遗传育种与繁殖教育部重点实验室,农业部猪遗传育种重点实验室,华中农业大学,湖北武汉 430070;2.湖北省畜禽育种中心,湖北武汉 430070)
猪IGFBP2基因多态性及其与胴体、肉质性状的关联分析
杨 华1,2,徐 珍1,左 波1*
(1. 湖北省生猪健康养殖协同创新中心,农业部动物遗传育种与繁殖教育部重点实验室,农业部猪遗传育种重点实验室,华中农业大学,湖北武汉 430070;2.湖北省畜禽育种中心,湖北武汉 430070)
本研究旨在调查猪胰岛素样生长因子结合蛋白2基因(IGFBP2)潜在的变异与胴体性状和肉质性状之间的关系。IGFBP2是IGFBPs家族的一员,定位在猪15号染色体上。本研究利用PCR-MspⅠ-RFLP方法对该基因第二内含子g.171C>T(GenBank Accession No. BV727778)进行了单核苷酸多态性(SNP)检测,在382头大白×梅山猪F2代猪群体中关联分析。结果发现该位点与背膘厚、眼肌高、眼肌宽、骨率等性状呈极显著相关(P<0.01),与眼肌面积、肥肉率、瘦肥比、花油、色值(LD)和色值(BF)等性状呈显著相关(P<0.05)。结果表明IGFBP2基因型与胴体和肉质性能存在一定程度的显著关联,是潜在的影响猪胴体和肉质性状的候选基因。
IGFBP2;多态性;胴体性状;肉质性状;关联分析;猪
随着城乡居民生活水平的提高,猪肉消费已经从量的需求向质的方向转变,高品质肉质需求已成为生产者和育种者追求的重要目标之一。分子标记辅助选择在猪育种中得到越来越广泛的应用,发掘并鉴定与猪胴体和肉质等重要经济性状的分子标记是实现分子标记辅助选择的前提和基础。
IGFBP2是 IGFBPs 家族的重要成员之一,具有广泛的生物学功能 ,它能调节IGFs、TGFβ等生长因子的生物活性, 还可能拥有自己的特异性受体直接发挥调节作用[1]。有关研究报道,家畜的IGFBP2基因与一些胴体和身体组成性状有关联[2-4]。猪15号染色体上IGBFP2基因所在区域内存在一些显著影响肉质性状的QTL位点[5-6]。Ewards等[7]在MSU杜洛克×皮特兰F2代资源群体中也发现了影响肉色和嫩度的几个重要的QTL位点在15号染色体上。Wang等[4]通过PCR-SSCP方法分析IGFBP2基因多态性与猪生产性能的关系,结果表明在蓝塘猪和长白猪杂交群体中,IGFBP2基因型与宰前体重、臀部背膘、骨率、肋骨数和体长等性状关联,不同IGFBP2单倍型与肉色和大理石花纹有关。在杂交野猪×大白猪中有一个重要的QTL位点在15号染色体上影响日增重等性状[8],Prasongsook等[9]在密歇根州立大学杜洛克和皮特兰F2代猪资源群体中研究发现,IGFBP2基因多态性与生长、胴体和肉质性状的相关性。因此,将IGFBP2作为候选基因研究其多态性与性状的相关性有重要的意义。
1 材料与方法
1.1 实验猪群及性状测定 实验样品采集于2000年、2003年和2004年大白×梅山猪F2代猪群。基因组DNA由农业部猪遗传育种重点实验室提取,于-20℃保存,猪群性状测定方法屠宰后根据《种猪测定原理与方法》进行。
1.2 引物设计及PCR扩增 根据已发表的IGFBP2基因的序列 (GenBank Accession No.BV727778), 采用Primer 5.0 设计 1 对引物,引物由上海生物工程技术服务有限公司合成,目的片段大小为 245 bp。 引物( P1) 序列为F:5′- GGTCTGATTGGAGGGGTGT -3′;R :5′-AGCCAAGGAGAAATGTGAAGG -3′。
PCR扩增反应总体积为10.0 μL:DNA模板0.5 μL,2×Taq PCR Mix 5.0 μL,ddH2O 4.0 μL,正、反向引物(10 μmol/L)各0.25 μL 。
PCR反应程序:94℃预变性4 min;94℃变性40 s,56.1℃退火25 s,72℃延伸30 s,共35个循环;最后72℃延伸10 min。PCR产物于1.5%琼脂糖凝胶电泳检测,以3 μL DNA Marker DL2000作为参照。电泳结束后,利用凝胶成像系统观察扩增结果。1.3 PCR-RFLP检测方法进行多态性验证 首先利用设计好的分型引物进行PCR,然后利用限制性内切酶进行酶切。PCR产物酶切反应体积为20 μL,其中1×Buffer 2 μL,限制性内切酶1 μL(5 U),ddH2O 7 μL,PCR产物10 μL,将样品混匀后离心,37℃酶切20 min。酶切产物用2.5%琼脂糖凝胶电泳检测,凝胶成像系统成像,记录基因型。
1.4 统计分析
1.4.1 数据校正 校正方法参照王林云[10]方法执行。校正公式为:
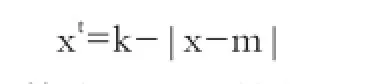
其中,x为观察值,m为该性状的最优值,k为常数,xt为校正值。如猪肉的pH正常在6.1~6.4,可设m= 6.25,k=10。
1.4.2 统计分析 采用SAS 统计软件(SAS Institute Inc,Version 8.0)GLM 程序对大梅群体2000年、2003年和2004年F2代个体进行单标记方差分析,同时采用REG 程序计算基因加性效应和显性效应,并进行显著性检验,所采用模型为:
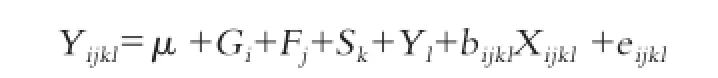
其中,Yijkl为性状表型值,μ为平均值,Gi为基因型效应(包括基因加性效应和显性效应;加性效应用-1、0 和1 分别代表纯合子AA、杂合子AG和纯合子GG基因型,显性效应用1和-1分别代表纯合子AA和GG、杂合子AG基因型);Sk、Yl、Fj为固定效应,分别为性别、年度、家系效应,bijkl为分析性状对屠宰体重的回归系数,Xijkl为屠宰体重,eijkl为残差效应。实验结果表示为平均值±标准误。
2 结 果
2.1 猪IGFBP2基因内含子2位点g.171C>T的MspⅠ-RFLP分型 猪IGFBP2基因内含子2存在1个C-T碱基突变,并引起了MspⅠ酶切位点的改变,其中AA基因型有245 bp1条带,GG基因型有190 bp和55 bp2条带,AG基因型有245 bp、190 bp和55 bp3条带,酶切分型结果见图1。
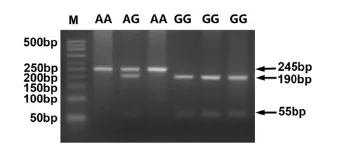
图1 IGFBP2基因MspⅠ-RFLP酶切分型结果
2.2IGFBP2基因型频率的检测结果 利用PCRMspⅠ-RFLP 技术对IGFBP2基因多态性进行检测,在大梅F2代猪群中检测到3种基因型,对各基因型频率进行统计,结果如表1 所示。
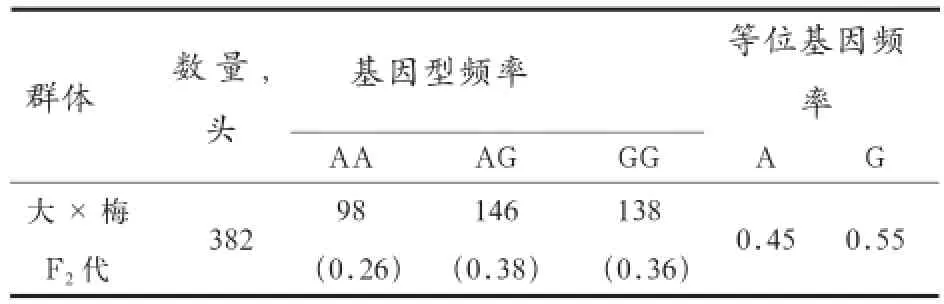
表1 IGFBP2基因内含子2MspⅠ酶切位点在大白×梅山F2代群体中的多态性
2.3 猪IGFBP2基因型与胴体和肉质性状的关联分析 如表2所示,IGFBP2基因与胴体性状平均背膘厚、眼肌高、眼肌宽和骨率等呈极显著相关(P<0.01),与眼肌面积、肥肉率、瘦肥比和花油等胴体性状呈显著相关(P<0.05),且在平均背膘厚中加性效应和显性效应达到极显著水平(P<0.01),在瘦肉率中加性效应达到显著水平(P<0.05),在骨率、板油和花油中显性效应达到显著水平(P<0.05)。
如表3所示,在肉质性状关联分析中IGFBP2与色值(LD)和色值(BF)呈显著相关(P<0.05),其中色值(LD)、大理石评分(LD)、大理石评分(BF)、肌内脂肪和pH(SC)加性效应达到显著水平(P<0.05),在失水率、系水力和大理石评分(BF)的显性效应达到显著水平(P<0.05),pH(BF)和pH(SC)显性效应达到极显著水平(P<0.01)。

表2 IGFBP2基因内含子2MspⅠ酶切位点的多态性与胴体性状关联分析

表3 IGFBP2基因内含子2MspⅠ酶切位点的多态性与与肉质性状的关联分析
3 讨 论
本研究通过RCR-MspⅠ-RFLP方法在383头大梅F2代猪群体中检测了IGFBP2内含子2位点g.171C>T位点,关联分析结果显示IGFBP2基因与胴体性状和肉质性状呈显著相关。这与Wang等[4]在蓝塘猪和长白猪杂交群体的IGFBP2基因型与胴体性状相关的结果一致,但与密歇根州立大学杜洛克和皮特兰杂交猪群体资源的IGFBP2基因型与肉质性状相关、与胴体性状不相关[9]的结果不一致,主要原因可能是:一是试验猪种不同,3组研究所用的实验猪种差异较大,没有共同猪种;二是实验群体数的差异以及群体是否具有代表性都会引起统计学结果的改变,蓝塘猪和长白猪杂交群体样本数是113头,杜洛克和皮特兰杂交猪群体样本数是408头;三是测定性状不同,3组研究测定的胴体性状指标均不同,赋值标准不一,可比性减弱;四是测定指标方面存在差异,本研究和Wang等[4]研究在国内现行性能测定上是统一标准,也在某种程度上表明了中外在测定方式方法、操作以及仪器设备等方面可能存在一些差异。
对胴体性状来说,AG基因型个体的平均背膘厚、眼肌面积、眼肌高、瘦肥比均极显著高于AA和GG基因型个体,而眼肌宽、肥肉率和花油显著低于AA和GG基因型个体;GG基因型的骨率显著高于AA和AG基因型个体,因此AG基因型是优势基因型。对肉质性状来说,AA基因型个体的色值显著高于AG和GG基因型个体, AA基因型是优势基因型。综合以上分析,可以初步推断IGFBP2基因可作为胴体和肉质性状的候选基因进行研究。
4 结 论
本实验对IGFBP2基因内含子2在大梅F2代资源群体的多态性及其与胴体性状和肉质性状分析,结果显示多个胴体和肉质性状在不同基因型间均存在显著差异。因此,可以认为IGFBP2基因是影响猪胴体和肉质的潜在候选基因,育种者和生产者可以根据群体的选择目标来筛选其等位基因。
[1] Slootweg M C, Ohlsson C, Salles J P,et al. Ⅰnsulinlike growth factor binding proteins-2 and -3 stimulate growth hormone receptor binding and mitogenesis in rat osteosarcoma cells[J]. Endocrinology, 1995, 136(10): 4210-4217.
[2] Li Z H, Li H, Zhang H,et al. Ⅰdentification of a single nucleotide polymorphism of the insulin-like growth factor binding protein 2 gene and its association with growth and body composition traits in the chicken[J]. J Anim Sci, 2006, 84(11): 2902-2906.
[3] Pagan M J. Evaluation of serum insulin-like growth factor binding proteins and the insulin-like growth factor binding protein-2 locus for potential associations with growth, carcass merit and meat quality in beef cattle[D]. PhD Diss. East Lansing, USA: Michigan State University, 2002.
[4] Wang W, Meng Q, Hu X,et al. Chromosome location and association of haplotypes of insulin-like growth factor binding protein-2 with production performance in swine[J]. Biochem Genet, 2008, 46(7-8): 381-391.
[5] Malek M, Dekkers J C, Lee H K,et al. A molecular genome scan analysis to identify chromosomal regions inf l uencing economic traits in the pig. ⅠⅠ. Meat and muscle composition[J]. Mamm Genome, 2001, 12(8): 637-645.
[6] Rohrer G A, Thallman R M, Shackelford S,et al. A genome scan for loci af f ecting pork quality in a Duroc-Landrace F population[J]. Anim Genet, 2006, 37(1): 17-27.
[7] Edwards D B, Ernst C W, Raney N E,et al. Quantitative trait locus mapping in an F2 Duroc × Pietrain resource population: ⅠⅠ. Carcass and meat quality traits[J]. J Anim Sci, 2008, 86(2): 254-266.
[8] Knott S A, Marklund L, Haley C S,et al. Multiple marker mapping of quantitative trait loci in a cross between outbred wild boar and large white pigs[J]. Genetics, 1998, 149(2): 1069-1080.
[9] Prasongsook S, Choi Ⅰ, Bates R O,et al. Association ofⅠnsulin-like growth factor binding protein 2 genotypes with growth, carcass and meat quality traits in pigs[J]. J Anim Sci Technol, 2015, 57:31.
[10] 王林云. 某些肉质性状观察值的校正方法[J]. 畜牧与兽医, 1995, 27(1):19.
Polymorphism ofΙGFBP2Gene and Ιts Association with Carcass and Meat Quality Traits in Pigs
YANG Hua1,2, XU Zhen1, ZUO Bo1*
(1. The Cooperative Ⅰnnovation Center for Sustainable Pig Production of Hubei Province, Key Laboratory of Swine Genetics and Breeding, Ministry of Agriculture & Key Laboratory of Agricultural Animal Genetics, Breeding and Reproduction, Ministry of Education, College of Animal Science and Veterinary Medicine, Huazhong Agricultural University, Hubei Wuhan 430070, China; 2. Livestock and Poultry Breeding Center of Hubei Province, Hubei Wuhan 430070, China)
This study was conducted to investigate the potential association of variation in the insulin-like growth factor binding protein 2 (ⅠGFBP2) gene with carcass and meat quality traits in pigs.ⅠGFBP2is a member of ⅠGFBP family, maps to chromosome 15. PCR-MspⅠ - RFLP method was used to detect the SNP g.171C>T (GenBank Accession No. BV727778) at the second intron in Large White × Mei Shan F2population (n=382). This SNP was significantly associated with back fat thickness, loin eye height, eye muscle width, bone percentage, and other traits (P<0.01), and was signif i cantly associated with eye muscle area, fat percentage and the ratios of fat to lean, fl ower fat, color value (LD) and color value (BF) (P<0.05). These results suggested thatⅠGFBP2as a potential candidate gene af f ects on carcass and meat traits.
ⅠGFBP2; Polymorphism; Carcass traits; Meat quality traits;Association analysis; Pig
S828.2
A
10.19556/j.0258-7033.2017-03-025
2016-10-25;
2016-11-02
国家科技支撑计划资助(2014BAD20B01);湖北省农业科技创新中心创新团队资助
杨华(1983-),女,河南南阳人,硕士,主要从事家畜品种改良技术推广应用以及饲草料研究,E-mail: yanghua_1983@163.com
* 通讯作者:左波(1978-),男,山东邹平人,博士生导师,主要研究方向为猪遗传育种,E-mail: zuobo@mail.hzau.edu.cn
