饲草型小黑麦苗期抗旱指标的筛选
2017-03-27田新会杜文华
李 雪,田新会,杜文华
(甘肃农业大学草业学院,草业生态系统教育部重点实验室,甘肃省草业工程实验室,中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
饲草型小黑麦苗期抗旱指标的筛选
李 雪,田新会,杜文华
(甘肃农业大学草业学院,草业生态系统教育部重点实验室,甘肃省草业工程实验室,中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
本试验采用高渗溶液聚乙二醇(PEG-6000)模拟生理干旱,通过测定饲草型小黑麦(×TriticaleWittmack)苗期叶片的含水量、相对含水量、相对电导率、丙二醛含量、叶绿素a和b含量、类胡萝卜素含量、可溶性糖及游离脯氨酸含量,研究干旱胁迫对饲草型小黑麦生理指标的影响,并筛选饲草型小黑麦苗期抗旱性鉴定的最佳模拟条件。结果表明,1)适宜于饲草型小黑麦苗期抗旱性鉴定的生理指标为叶片含水量、相对含水量、丙二醛含量、游离脯氨酸含量、叶绿素b含量;2)饲草型小黑麦苗期抗旱性鉴定的最佳模拟条件为:用30% PEG-6000胁迫28 d,此时大部分生理生化指标与对照差异显著(P<0.05);3)干旱胁迫处理后,饲草型小黑麦幼苗生长缓慢,叶片含水量、相对含水量、叶绿素含量降低,叶片的游离脯氨酸含量和丙二醛含量增加。饲草型小黑麦苗期抗旱性鉴定的最佳模拟条件为,30% PEG胁迫28 d。适宜于饲草型小黑麦抗旱性评价的生理指标为叶片含水量、相对含水量、丙二醛、游离脯氨酸和叶绿素b。
饲草型小黑麦;PEG浓度;生理生化指标;干旱胁迫;模拟条件;抗旱鉴定;指标筛选
干旱的频繁发生已成为全球最为严峻的环境问题之一,引起国际社会高度重视[1]。因此,种植抗旱、稳产、高效的作物及品种,是当前农业结构调整中急需解决的问题。
小黑麦(×TriticaleWittmack)为禾本科一年生草本植物,由黑麦(Secale)和小麦(Triticum)经属间有性杂交和杂种染色体加倍而成的新物种,不仅表现了小麦的丰产性和籽粒的优良品质,还保持了黑麦抗逆性强和赖氨酸含量高的特点,是一种性状优良的粮饲兼用型作物[2-4]。甘肃省属于典型的内陆干旱型气候,是我国较干旱的地区之一。筛选抗旱性强、草产量和籽粒产量高的饲草型小黑麦材料,将在甘肃及西北地区具有一定的推广应用价值。
鉴定植物的抗旱指标,有形态学及产量等农艺性状,如株高、根系、叶片形态、分蘖、产量;还有生理生化性状,如气孔导度、种子萌发、水分生理、光合速率、丙二醛(MDA)含量、超氧化物歧止酶(SOD)、过氧化氢酶(POD)活性等,生理生化指标可以反映植物对干旱胁迫适应的程度,并最终决定产量的形成[5-7]。植物的抗旱性与叶片相对含水量、含水量、叶绿素a、叶绿素b,相对电导率、丙二醛、类胡萝卜素、可溶性糖和游离脯氨酸等指标有关,但不同植物受干旱胁迫时,各指标有不同的变化[5]。目前国内外对小黑麦抗旱性的研究主要有小黑麦光合特性受干旱胁迫的影响[8-9]、在大田条件下小黑麦旗叶光合和籽粒产量受干旱胁迫的影响[10]、干旱胁迫下小黑麦开花期响应机理[11]、小黑麦可溶性蛋白在干旱胁迫的变化等方面[12-14]。用聚乙二醇(PEG-6000,以下简称PEG)模拟干旱胁迫对8个小黑麦基因型的幼苗进行处理,测定了净光合速率、蒸腾速率、气孔导度、胞间CO2体积比以及水分利用率[15]。截至目前,尚未有小黑麦苗期抗旱性指标筛选方面的研究。本研究拟采用不同浓度的PEG-6000模拟生理干旱,以研究干旱胁迫时间和程度对饲草型小黑麦苗期不同生理指标的影响,筛选适宜于饲草型小黑麦苗期抗旱性研究的模拟条件和生理生化指标,为饲草型小黑麦抗旱性研究奠定基础。
1 材料与方法
1.1 试验材料
试验材料为甘肃农业大学草业学院选育的饲草型小黑麦新品系P2种子。
1.2 试验设计
将花卉土与大田土以1∶1混合,装入花盆(直径20 cm,深度15 cm)中,用水浇透,3~4 d后每个花盆中种植饲草型小黑麦种子45粒。每隔7 d浇一次水。饲草型小黑麦进入三叶期时采用PEG模拟水分干旱胁迫。PEG浓度(A因素)设5个水平,A1(0,CK),A2(10%),A3(20%),A4(30%),A5(40%),干旱胁迫天数(B因素)设4个水平,B1(7 d),B2(14 d),B3(21 d),B4(28 d)。每个处理设4次重复,共80盆,用于采集测定生理生化指标的样品。
试验开始时,A2、A3、A4和A5处理的花盆分别用相应浓度的PEG溶液浇透,对照(CK)浇水200 mL,并称重。之后每隔7 d从不同PEG浓度处理的花盆中分别剪取叶片用于测定生理生化指标,并用恒重法补充各个处理蒸发的水分,CK每次补充200 mL水。将剪取的样品带回实验室,测定叶片含水量、相对含水量、丙二醛、叶绿素a、叶绿素b、类胡萝卜素、可溶性糖和游离脯氨酸含量[16]。
1.3 测定方法
叶片含水量采用烘干法测定,相对含水量采用浸泡法测定,MDA含量采用硫代巴比妥酸法测定,游离脯氨酸含量采用水合茚三酮法测定,可溶性糖含量采用蒽酮比色法测定,叶绿素含量利用分光光度法测定[17-20]。以上指标均重复测定4次,取平均值。
1.4 数据分析
用SPSS 19.0软件中二因素随机区组试验设计的统计方法,分别分析小黑麦在不同PEG浓度和干旱胁迫天数下叶片的含水量、相对含水量、相对电导率、丙二醛含量、叶绿素a、b含量、类胡萝卜素含量、可溶性糖含量和游离脯氨酸含量的差异显著性。如果差异显著,分别用Duncan法进行多重比较。用Excel进行数据整理和作图。
2 结果与分析
2.1 饲草型小黑麦苗期抗旱性评价指标的筛选
PEG浓度对饲草型小黑麦苗期叶片含水量、相对含水量、叶绿素b含量、游离脯氨酸含量和丙二醛含量有极显著影响(P<0.01)(表1),而对叶片的相对电导率、可溶性糖含量、叶绿素a和类胡萝卜素含量无显著影响(P>0.05)。这说明叶片的相对电导率、可溶性糖含量、叶绿素a和类胡萝卜素含量不适宜作为饲草型小黑麦苗期抗旱性评价的指标。干旱胁迫天数对叶片的相对电导率和类胡萝卜素含量无显著影响,说明不能用这两个指标筛选饲草型小黑麦苗期抗旱性评价的干旱胁迫天数。PEG浓度与干旱胁迫天数的交互作用对饲草型小黑麦苗期叶片相对含水量,相对电导率无显著影响,结合PEG浓度和干旱胁迫天数方差分析的结果,相对电导率、叶绿素a、类胡萝卜素和可溶性糖不作为抗旱性评价指标。
2.2 饲草型小黑麦苗期抗旱性评价PEG浓度的筛选
随着PEG浓度增加,饲草型小黑麦叶片含水量呈下降趋势,30%和40%PEG胁迫下的叶片含水量和对照(CK)差异显著(P<0.05)(表2),30%PEG胁迫下叶片含水量显著高于40%PEG胁迫。随着PEG浓度增加,相对含水量亦下降,浓度为30%和40%时,和CK有显著差异(P<0.05),40%PEG胁迫下相对含水量显著低于20%PEG胁迫。40%PEG胁迫下饲草型小黑麦叶片叶绿素b含量显著低于CK和10%、20%及30%PEG胁迫(P<0.05),与CK相比下降了25.81%。除20%PEG外随着PEG浓度增加,饲草型小黑麦叶片丙二醛含量逐渐增加,40%PEG处理的丙二醛含量最高,显著高于CK和10%、20%及30%PEG胁迫(P<0.05)。随着PEG浓度增加,饲草型小黑麦叶片游离脯氨酸含量逐渐增加,PEG浓度≥20%时和CK存在显著差异(P<0.05)。从不同浓度PEG处理下各生理指标与CK的差异显著性可知,30%PEG为饲草型小黑麦苗期抗旱性评价的适宜浓度。
2.3 饲草型小黑麦苗期干旱胁迫天数的筛选
随着干旱胁迫天数的增加(除21 d外),饲草型小黑麦叶片含水量呈下降趋势(表3),14和28 d干旱胁迫下的叶片含水量与CK有显著差异(P<0.05)。随着干旱胁迫天数增加(除21 d外),相对含水量亦下降,干旱胁迫28 d时与CK有显著差异,下降了26.59%。干旱胁迫14、21、28 d时饲草型小黑麦叶片叶绿素b的含量显著低于CK。随着干旱胁迫时间的延长(除7 d外),饲草型小黑麦叶片丙二醛的含量逐渐增加,干旱胁迫14、21、28 d的丙二醛含量和CK差异显著。随着干旱胁迫时间延长,饲草型小黑麦叶片游离脯氨酸含量的变化与丙二醛相似,干旱胁迫14、21、28 d显著高于CK。综合分析不同干旱胁迫天数下各生理指标与CK的差异显著性可知,28 d为饲草型小黑麦苗期抗旱性评价的适宜胁迫天数。
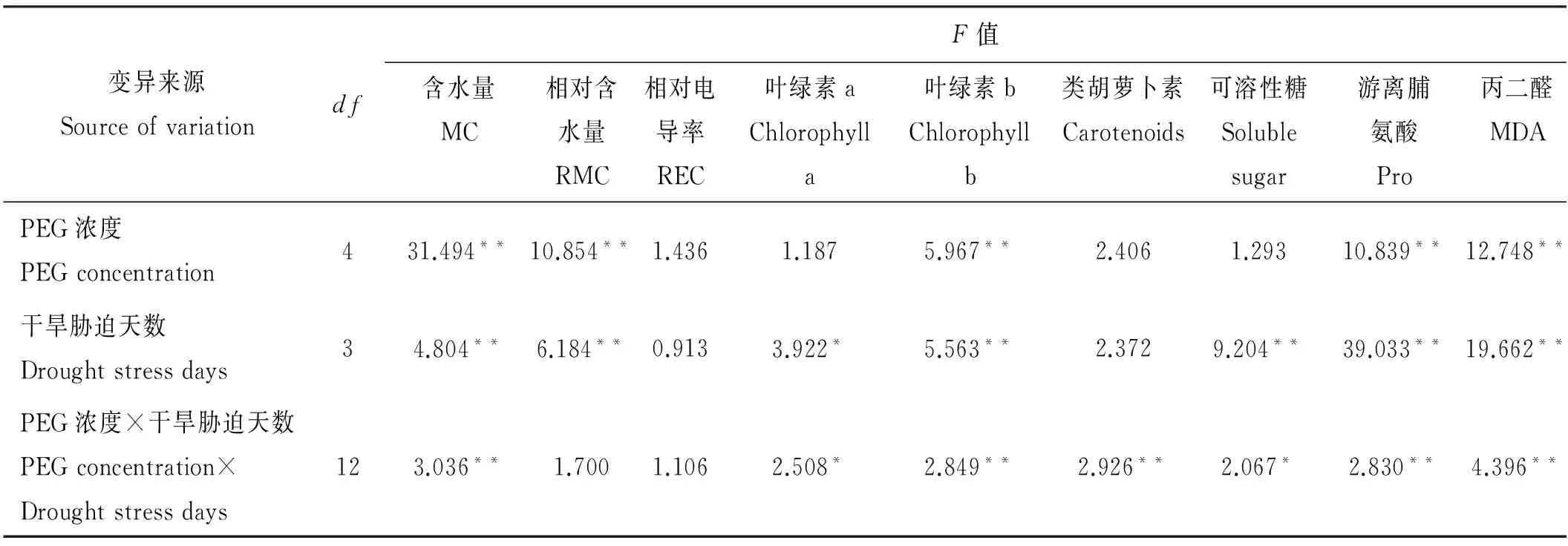
表1 饲草型小黑麦苗期生理生化指标方差分析表(F值)
注:**表示达到极显著水平(P<0.01),*表示差异显著水平(P<0.05)。
Note: ** means significant difference at the 0.01 level, * means significant difference at the 0.05 level. MC, RMC, REC, Pro and MDA indicate moisture content, relative moisture content, relative electricl conductivity, content of proline, content of malondialdehyde.
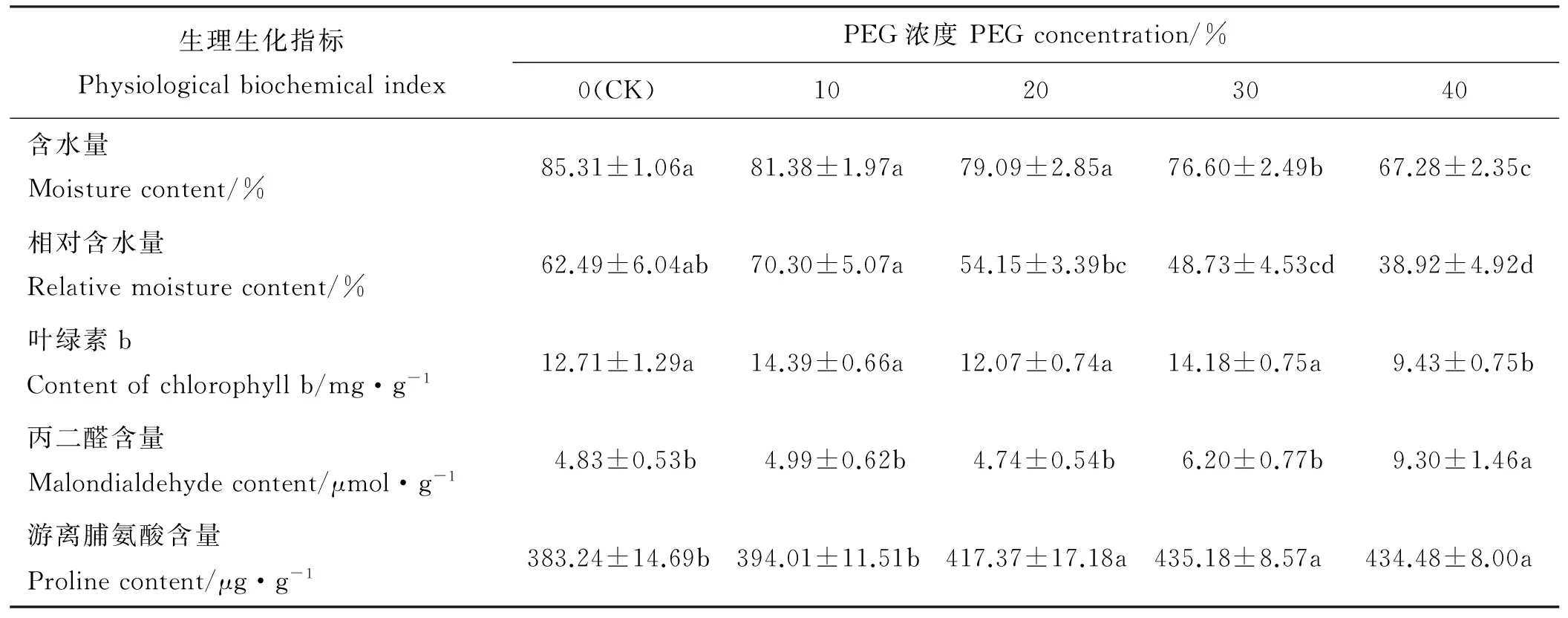
表2 PEG浓度对饲草型小黑麦生理生化指标的影响
注:同行不同字母表示不同PEG浓度间差异显著(P<0.05)。下同。
Note: Different letters within the same row mean significant differences among different PEG concentrotion at 0.05 level. The same below.
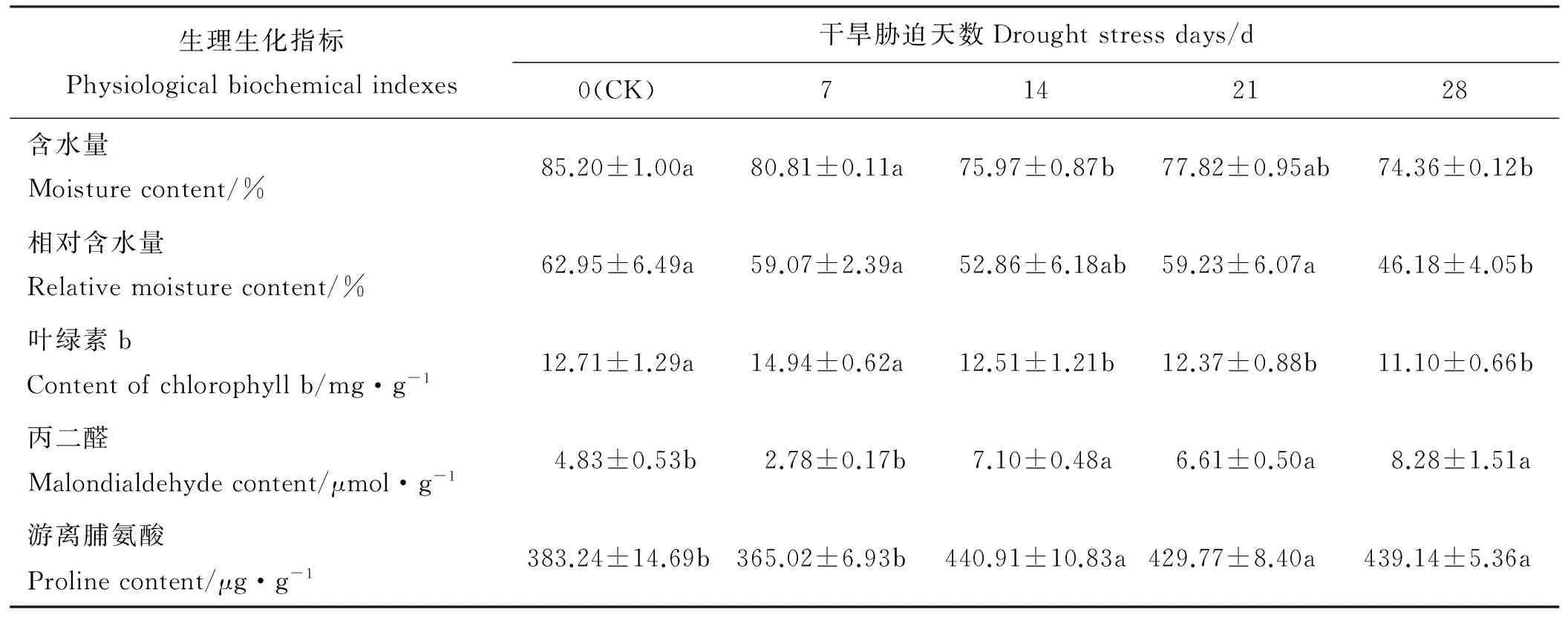
表3 干旱胁迫天数对饲草型小黑麦生理生化指标的影响
2.4 PEG干旱胁迫对饲草型小黑麦生理生化指标的影响
2.4.1 小黑麦叶片含水量 随着干旱胁迫时间延长和PEG浓度增加,叶片含水量降低(图1)。CK处理(A1B1,A1B2,A1B3,A1B4)的饲草型小黑麦在试验过程中生长正常,其叶片含水量变化不大(82.77%~87.45%)。经不同浓度PEG处理后,饲草型小黑麦叶片表现出不同程度萎蔫,萎蔫程度随胁迫强度和胁迫时间的延长而加重,甚至枯死。30%和40%PEG溶液胁迫至14 d时,植株上部叶片枯萎,叶片含水量和CK(A1B2)存在显著差异(P<0.05),干旱胁迫21和28 d时,30%和40%PEG胁迫下的叶片含水量显著低于10%PEG胁迫,说明30%和40%PEG进一步加重了饲草型小黑麦的干旱胁迫。
2.4.2 小黑麦叶片的叶绿素b含量 用不同浓度PEG对饲草型小黑麦幼苗胁迫7 d后,叶片中的叶绿素b含量(12.79~15.75 mg·g-1)与CK(A1B1)均无显著差异(P>0.05)(图2);胁迫14和21 d后,40% PEG处理(A5B2,A5B3)的叶绿素b含量和CK(A1B2,A1B3)含量相比分别下降26.07%和30.68%;胁迫28 d后,叶片叶绿素b含量随着PEG浓度的增大先增加再减小,各PEG浓度和CK(A1B4)间无显著差异。
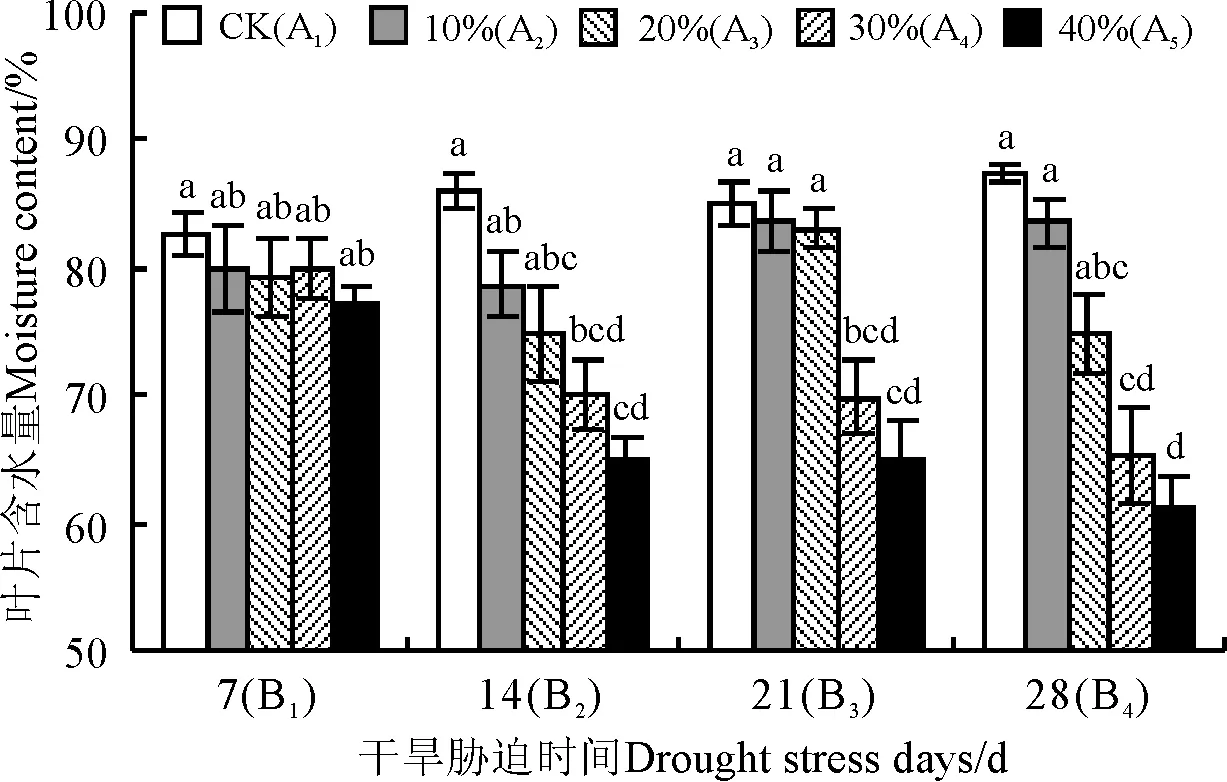
图1 干旱胁迫对饲草型小黑麦叶片含水量的影响
注:不同小写字母表示处理间差异显著(P<0.05)。下同。
Note: Different lowercase letters indicate significant difference among different treatments at the 0.05 level; similarly for the following figures.
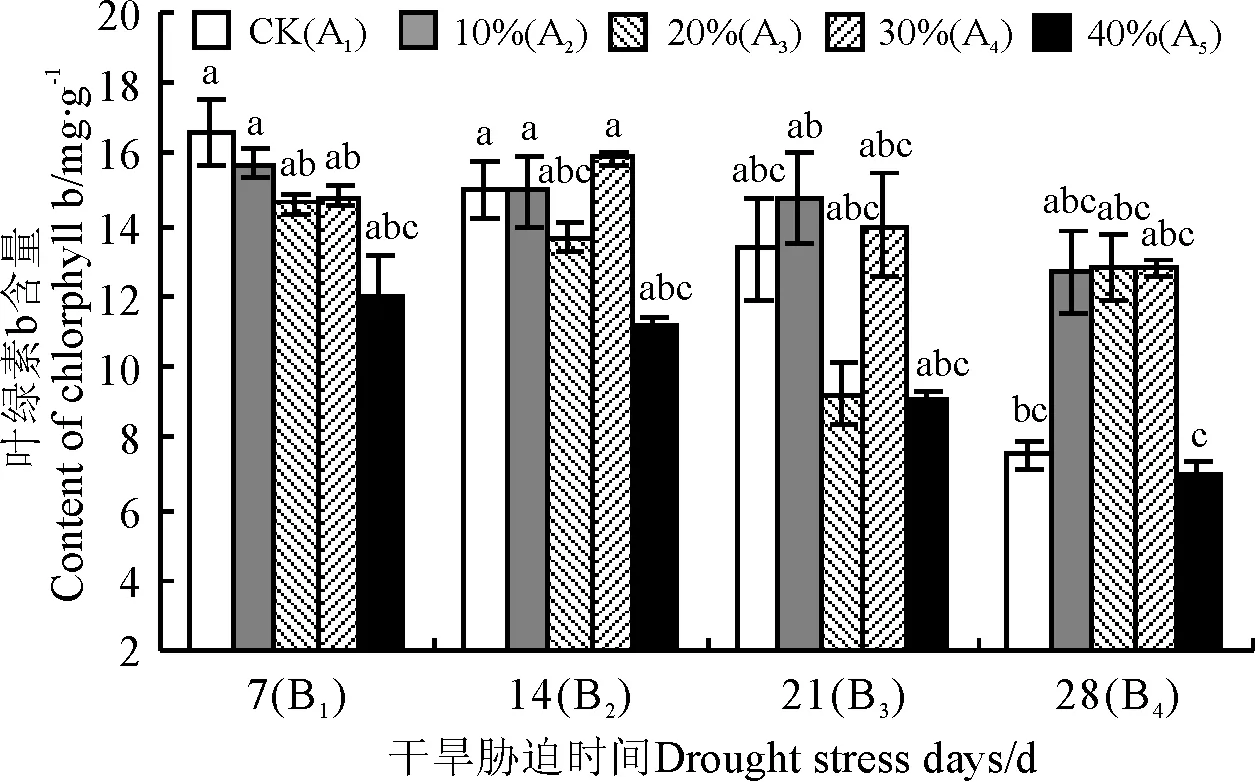
图2 干旱胁迫对饲草型小黑麦叶片叶绿素b含量的影响
2.4.3 小黑麦叶片的游离脯氨酸含量 游离脯氨酸含量随着PEG浓度的增大而增加,干旱胁迫7 d后,30%和40%PEG处理(A4B1,A5B1)叶片的游离脯氨酸含量显著高于CK(A1B1)(P<0.05)(图3);干旱胁迫14 d后,20%、30%和40%PEG处理(A3B2,A4B2,A5B2)叶片的游离脯氨酸含量显著高于CK(A1B2);干旱胁迫21 d后,40%PEG处理(A5B3)的叶片游离脯氨酸含量显著高于CK(A1B3);不同浓度PEG对饲草型小黑麦幼苗胁迫28 d后,叶片中的游离脯氨酸含量(419.52~452.27 μg·g-1)均与CK(A1B4)无显著差异(P>0.05)。
2.4.4 小黑麦叶片的丙二醛含量 不同质量浓度PEG对饲草型小黑麦胁迫7、14、21 d后,叶片中的丙二醛含量与相应CK(A1B1,A1B2,A1B3)差异均不显著(P>0.05)(图4);胁迫28 d后,40%PEG处理的叶片中丙二醛含量(17.46 μmol·g-1)显著大于CK(A1B4)(P<0.05),与CK相比,含量上升了237.17%。
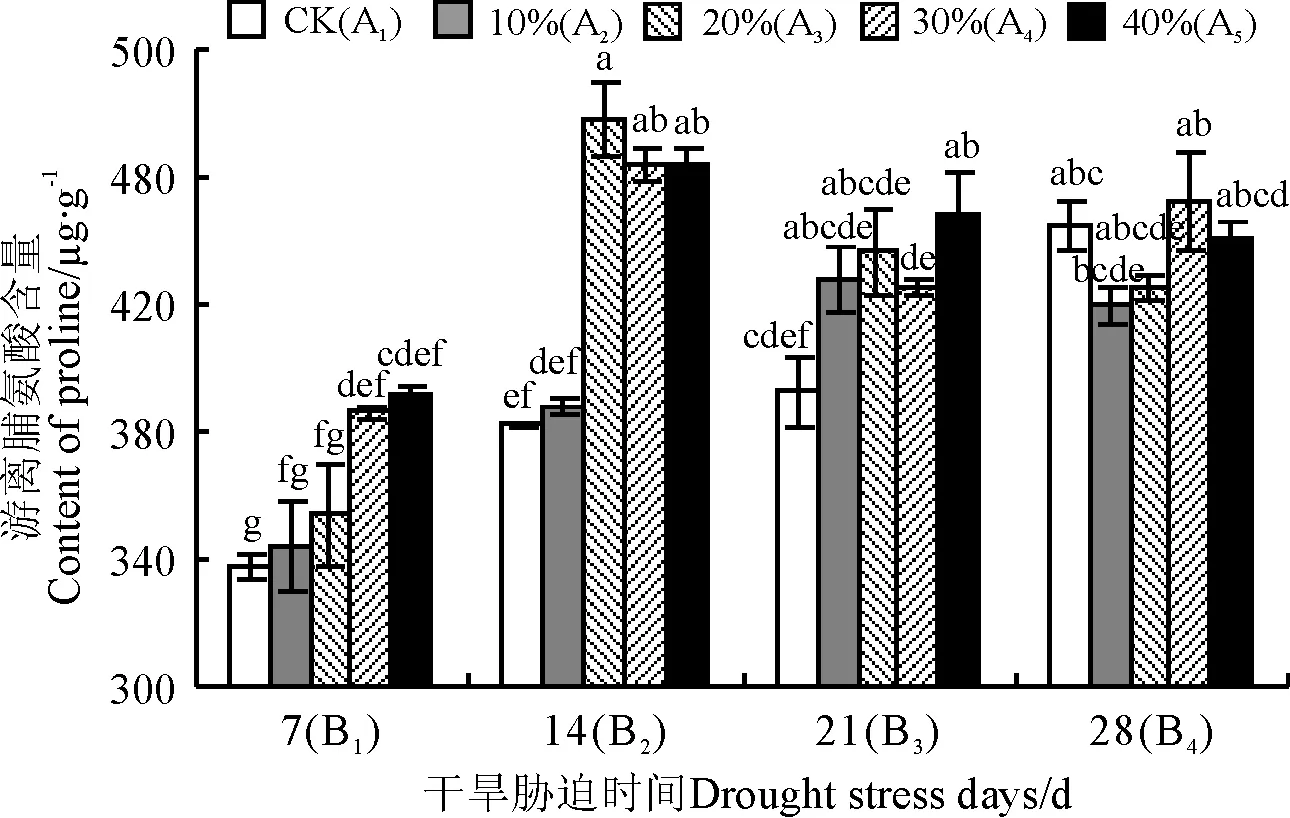
图3 干旱胁迫对饲草型小黑麦叶片游离脯氨酸含量的影响
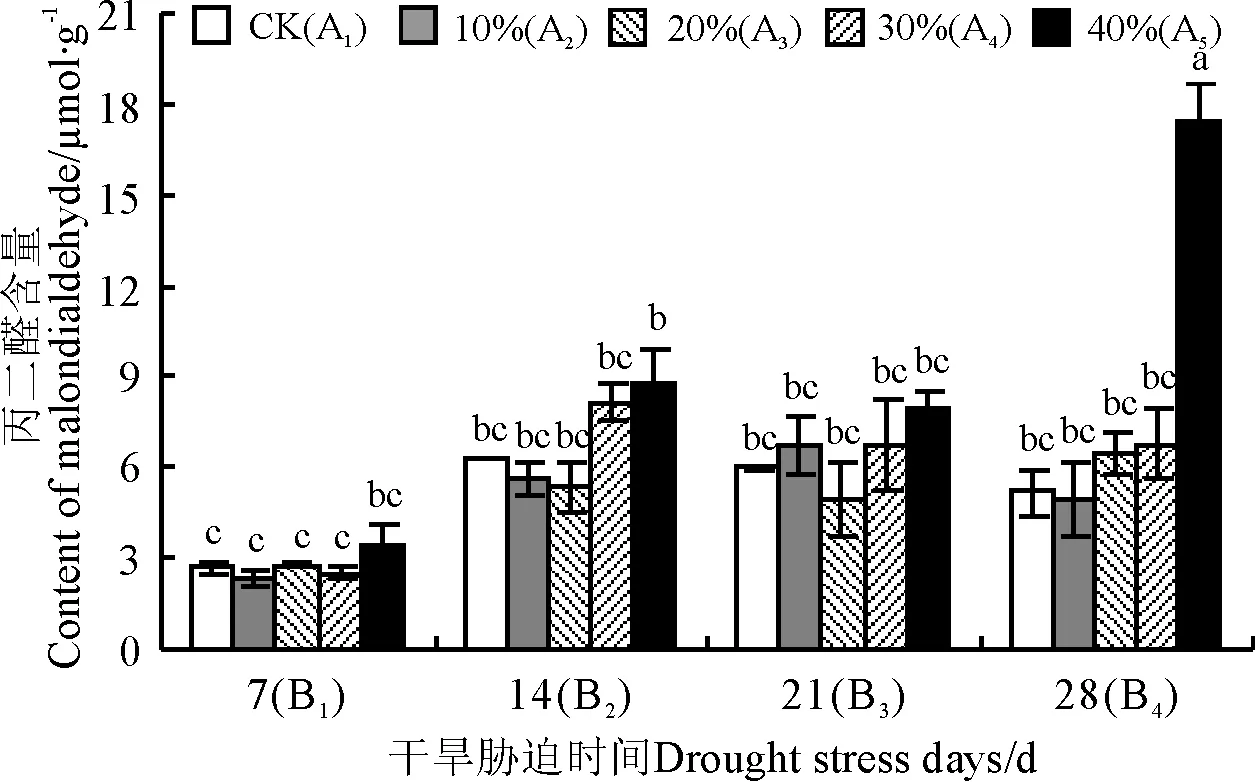
图4 干旱胁迫对饲草型小黑麦叶片丙二醛含量的影响
3 讨论
3.1 饲草型小黑麦苗期模拟干旱条件
利用PEG研究饲草型小黑麦抗旱性的关键是适宜的PEG浓度和胁迫时间。有研究表明,0.2 kg·L-1的PEG-6000胁迫8 d为最佳模拟紫斑牡丹(Paeoniarockii)的抗旱性条件[17],该模拟条件下,紫斑牡丹叶片的叶绿素a、相对电导率、游离脯氨酸含量变化较大,可作为评价紫斑牡丹抗旱性的候选指标。另有研究表明,以20%的PEG胁迫9 d可作为最佳模拟抗旱条件来研究白芷(Angelicadahurica)苗期的抗旱性[21]。本研究结果表明,饲草型小黑麦的一些生理指标在PEG浓度较低、胁迫时间较短时对干旱胁迫的响应不敏感,如20%PEG胁迫14 d时,对饲草型小黑麦叶片的含水量,丙二醛和叶绿素b含量的影响较小。反之,如果PEG浓度较高、胁迫时间较长,就会超过饲草型小黑麦的最大耐受强度,致使植株萎蔫,甚至死亡。随着胁迫时间延长,饲草型小黑麦能耐受低浓度PEG干旱胁迫,但高浓度干旱处理可对其造成严重危害,如40%PEG胁迫28 d时,叶片相对含水量较低,叶片枯萎严重。本研究还发现,用30%和40%PEG胁迫21和28 d时,饲草型小黑麦各指标的变化较明显。丙二醛是植物膜脂过氧化降解的产物,也是表征植物细胞膜受氧化伤害程度的重要指标[14]。当饲草型小黑麦干旱胁迫28 d时,丙二醛含量急剧上升,说明饲草型小黑麦可以承受一定时间限度的干旱胁迫,当超过该承受限度后,就不能充分发挥渗透调节系统的作用,细胞膜系统受到损伤,影响植株正常生长[19]。用30%PEG胁迫28 d时,大多数指标值与CK有显著差异,并且植株枯萎的较轻。综合以上各因素认为,研究饲草型小黑麦苗期抗旱性的最佳模拟条件为以30%PEG胁迫处理28 d。
3.2 饲草型小黑麦苗期抗旱指标
植物抗旱性的评价指标较多,许多研究表明,丙二醛、相对电导率和植物抗旱性有显著相关性[22-24]。在玉米(Zeamays)、小麦(Triticumaestivum)的研究中表明,不同作物品种间存在着渗透调节能力差异,抗旱性强品种的渗透调节能力比抗旱性弱品种大,其可溶性糖、游离脯氨酸等渗透调节物质的含量增加也较快[25]。小麦不耐旱品种比耐旱品种叶片的叶绿素含量更低[26]。水稻(Oryzasativa)开花期叶片的相对含水量、游离脯氨酸含量与抗旱性有显著相关性,可作为鉴定水稻开花期抗旱性的指标[27]。糜子(Panicummiliaceum)叶片中的叶绿素含量可作为鉴定其抗旱性的有效指标[28]。抗坏血酸过氧化物酶(APX)、SOD、CAT、可溶性蛋白(SPr)的相对值和油菜(Brassicacampestris)苗期抗旱性呈显著正相关关系,可作为鉴定苗期油菜的抗旱性指标[29]。本研究选取9个指标研究饲草型小黑麦苗期的抗旱性,结果表明,随着PEG胁迫程度的加剧,叶片含水量、相对含水量、丙二醛、叶绿素b和游离脯氨酸含量和CK有显著差异,可以作为饲草型小黑麦苗期抗旱性鉴定的指标。但随着PEG浓度和胁迫时间的变化,叶片的可溶性糖、相对电导率、叶绿素a和类胡萝卜素含量均无显著差异,说明以上4指标不适宜作为评价饲草型小黑麦苗期抗旱性的指标。但值得注意的是,PEG模拟的干旱胁迫和自然界中干旱情况不同,并且盆栽环境和野生环境也有些差异,因此,有必要研究饲草型小黑麦在自然条件下的抗旱性,使其真实的抗旱能力能够被充分反映,为饲草型小黑麦的实际栽培应用提供理论依据[17]。
3.3 PEG干旱胁迫对饲草型小黑麦生理生化指标的影响
幼苗期是饲草型小黑麦由营养生长向生殖生长和生态生长发展的一个重要转折点,直接关系到饲草型小黑麦的成苗率与后期作物产量[30]。干旱胁迫下油菜的游离脯氨酸含量增加132.06%~938.44%,平均增加642.50%,极显著高于对照[29]。随着干旱胁迫程度加剧,糜子叶片丙二醛含量和对照相比有不同程度提高[31],相对含水量也有不同程度降低。
本研究表明,饲草型小黑麦幼苗在干旱胁迫情况下,其生长和生理指标有明显差异,生理生化指标如叶片含水量、游离脯氨酸含量、相对含水量等在饲草型小黑麦体内呈一定变化规律,这和受胁迫的程度、胁迫时间有密切关系,这些生理生化指标和抗旱性关系明确,和前人研究结果相似[30-31]。本研究采用不同浓度PEG人工模拟生理干旱,分析饲草型小黑麦生长初期的生理生化指标,确定干旱胁迫下各指标的变化趋势和抗旱性鉴定指标以及抗旱性的最佳模拟条件,但这只是对小黑麦生长初期的研究,有关饲草型小黑麦分蘖期、灌浆期、成熟期的抗旱性鉴定指标以及抗旱性的最佳模拟条件有待进一步研究。
4 结论
饲草型小黑麦苗期抗旱性鉴定的最佳模拟条件为,30%PEG胁迫28 d。适宜于饲草型小黑麦抗旱性评价的生理指标为叶片含水量、相对含水量、丙二醛含量、游离脯氨酸含量和叶绿素b含量。
References:
[1] 王劲松,李耀辉,王润元,冯建英,赵艳霞.我国气象干旱研究进展评述.干旱气象,2012,30(4):497-508. Wang J S,Li Y H,Wang R Y,Feng J Y,Zhao Y X.Preliminary analysis on the demand and review of progress in the field of meteorological drought research.Journal of Arid Meteorology,2012,30(4):497-508.(in Chinese)
[2] 杨蕊菊.小黑麦抗旱生态适应性研究.兰州:甘肃农业大学硕士学位论文,2003. Yang R J.Studies on ecological adaptability of drought resistance inTriticale.Master Thesis.Lanzhou:Gansu Agricultural University,2003.(in Chinese)
[3] 张微,李春艳,曹连莆,钱创建,朱新在,陈军,李诚.春性小黑麦材料抗旱性的比较研究.石河子大学学报:自然科学版,2009,27(5):529-535. Zhang W,Li C Y,Cao L P,Qian C J,Zhu X Z,Chen J,Li C.Studies on drought-resistance in springTriticale.Journal of Shihezi University:Natural Science,2009,27(5):529-535.(in Chinese)
[4] 孙黛珍,周福平,王曙光,李瑞,袁斌.六倍体小黑麦灌浆期抗旱性分析.中国农学通报,2007,23(7):236-240. Sun D Z,Zhou F P,W S G,Li R,Yuan B.Drought resistance analysis of hexaploidTriticaleat grain filling stage.Chinese Agricultural Science Bulletin,2007,23(7):236-240.(in Chinese)
[5] 李春艳,李诚,艾尼瓦尔,孔广超,虎小兵,曹连莆.春性饲草型小黑麦抗旱性的综合评价.麦类作物学报,2008,28(6):1080-1085. Li C Y,Li C,Ainiwar,Kong G C,Hu X B,Cao L P.Evaluation on drought resistance of spring forageTriticale.Journal of Triticeae Crops,2008,06:1080-1085.(in Chinese)
[6] 崔兴国.新型饲草作物小黑麦利用研究.农业科技与装备,2011(4):5-6,9. Cui X G.Research of new forageTriticale.Agricultural Science &Technology and Equipment,2011(4):5-6,9.(in Chinese)
[7] 兰巨生.农作物综合抗旱性评价方法的研究.西北农业学报,1998(3):92-94. Lan J S.Comparison of evaluating methods for agronomic drought resistance in crops.Acta Agriculturae Boreali-occidentalis Sinica,1998(3):92-94.(in Chinese)
[8] Longnecker N,Kirby E J M.Robson A.Leaf emergence,tiller growth and apical development of nitrogen-deficient spring wheat.Crop Science,1993,33:154-160.
[9] Grieve C M,Francois L E,Maas E V.Salinity affects the timing of phasic development in spring wheat.Crop Science,1994,34:1544-1549.
[10] 魏亦农.水分胁迫对小黑麦旗叶光合特性的影响.种子,2004,23(8):30-31. Wei Y N.The effect to photosynthesis of theTriticaleflag leave in water stress.Seed,2004,23(8):30-31.(in Chinese)
[11] Otegui M E,Andrade F H.Suero E E.Growth,water use and kernel abortion of maize subjected to drought at silking.Field Crops Research,1995,40:87-90.
[12] Jalal Kamali M R,Boyd W J R.Quantifying the growth and development of commercial barley cuhivars over two contrasting growing seasons in Western Australia.Australian Journal of Agrieuhurai Research,2000,51:487-501.
[13] Arisnabarreta S,Miralles d J.The influence of fertilizer nitrogen application on development and number of reproductive primordial in field-grown two- and six-rowed Barleys.Australian Journal of Agricultural Research,2004,55:357-366.
[14] Salvagiotti F,Miralles d J.Wheat development as affected by nitrogen and sulfur nutrition.Australian Journal of Agricultural Research,2007,58:39-45.
[15] 时丽冉.水分胁迫对小黑麦光合性能及水分利用率的影响.衡水学院学报,2011,13(4):53-54,57. Shi L R.The effect of water stress on photosynthetic characteristics and water use efficiency of variousTriticale.Journal of Hengshui University,2011,13(4):53-54,57.(in Chinese)
[16] 张灿军,冀天会,杨子光,郭军伟,孟丽梅,张珂.小麦抗旱性鉴定方法及评价指标研究.Ⅰ.鉴定方法及评价指标.中国农学通报,2007,23(9):226-230. Zhang C J,Ji T H,Yang Z G,Guo J W,Meng L M,Zhang K.Study on resistance drought identify method and evaluation index of wheat .Ⅰ.Identify method and evaluation index.Chinese Agricultural Science Bulletin,2007,23(9):226-230.(in Chinese)
[17] 彭民贵,张继,陈学林,张吉平,张玉芳,白永兴.聚乙二醇模拟干旱胁迫下紫斑牡丹的抗旱性研究.西北农林科技大学学报:自然科学版,2014,42(4):179-186. Peng M G,Zhang J,Chen X L,Zhang J P,Zhang Y F,Bai Y X.Drought resistance ofPaeoniarockiiunder polyethylene glycol simulated drought stress.Journal of Northwest A & F University:Natural Science Edition,2014,42(4):179-186.(in Chinese)
[18] 郝建军,康宗利,于洋.植物生理学实验技术.化学工业出版社,2006. Hao J J,Kang Z L,Yu Y.Plant Physiology Experimental Technology.Beijing:Chemical Industry Press,2006.(in Chinese)
[19] 张蜀秋,李云,武维华.植物生理学实验技术教程.北京科学出版社,2011. Zhang S Q,Li Y,Wu W H.Plant Physiology and Biochemistry Experimental Guidance.Beijing:Beijing Science Press,2011.(in Chinese)
[20] 夏方山,闫慧芳,毛培胜,王明亚,郑慧敏,陈泉竹.PEG引发对燕麦老化种子萌发与幼苗生长的影响.草业科学,2015,32(5):731-737. Xia F S,Yan H F,Mao P S,Wang M Y,Zheng H M,Chen Q Z.Effects of PEG priming on germination and seedling growth of accelerated ageing oat seeds.Pratacultural Science,2015,32(5):731-737.(in Chinese)
[21] 陈郡雯,吴卫,郑有良,侯凯,徐应文,翟娟园.聚乙二醇(PEG-6000)模拟干旱条件下白芷苗期抗旱性研究.中国中药杂志,2010,35(2):149-153. Chen J W,Wu W,Zheng Y L,Hou K,Xu Y W,Zhai J Y.Drought resistance ofAngelicadahuricaduring seedling stage under polyethyleneglycol (PEG-6000) simulated drought stress.China Journal of Chinese Materia Medica,2010,35(2):149-153.(in Chinese)
[22] 杨鹏辉,李贵全,郭丽,吴慎杰.干旱胁迫对不同抗旱大豆品种花荚期质膜透性的影响.干旱地区农业研究,2003,21(3):127-130. Yang P H,Li G Q,Guo L,Wu S J.Effect of drought stress on plasma mambrane permeality of soybean varieties during flowering-poding stage.Agricultural Research in the Arid Areas,2003,21(3):127-130.(in Chinese)
[23] 于金慧,柏明娥,方伟,洪利兴.干旱胁迫对4种灌木生理生化特性的影响.浙江林学院学报,2009,26(4):485-489. Yu J H,Bai M E,Fang W,Hong L X.Physiological and biochemical substances of four shrubs with drought stress.Journal of Zhejiang Forestry College,2009,26(4):485-489.(in Chinese)
[24] 张荟荟,甄世财,张一弓,杨刚,顾祥,沙吾列·沙比汗,王玉,热娜·阿布都克力木.12份苜蓿种质材料苗期抗旱性综合评价.草业科学,2014,31(4):737-743. Zhang H H,Zhen S C,Zhang Y G,Yang G,Gui X,Shawulie·Shabihan,Wang Y,Rena·Abdukelimu.Comprehensive evaluation of drought resistance of twelve alfalfa accessions at seedling stage.Pratacultural Science,2014,31(4):737-743.(in Chinese)
[25] Harsh N.Accumulation of osmolytes and osmotic adjustment in water-stressed wheat (Triticumaestivum) and maize (Zeamays) as affected by calcium and its antagonists.Environmental and Experimental Botany,2003,50(3):253-264.
[26] Chandrasekar V,Sairam R K,Srivastava G C.Physiological and biochemical responses of hexaploid and tetraploid wheat to drought stress.Journal of Agronomy and Crop Science,2000,185(4):219-227.
[27] 王贺正,马均,李旭毅,李艳,张荣萍,刘慧远,汪仁全.水稻开花期抗旱性鉴定指标的筛选.作物学报,2005,31(11):101-105.Wang H Z,Ma J,Li X Y,Li Y,Zhang R P,Liu H Y,Wang R Q.Screening identification indexes of drought resistance at flowering stage in rice.Acta Agronomica Sinica,2005,31(11):101-105.(in Chinese)
[28] 张盼盼,冯佰利,王鹏科,高小丽,高金锋,宋慧,张小东,柴岩.PEG胁迫下糜子苗期抗旱指标鉴选研究.中国农业大学学报,2012,17(1):53-59. Zhang P P,Feng B L,Wang P K,Gao X L,Gao J F,Song H,Zhang X D,Chai Y.Study on identification of drought-resistance indexes at seedling stage in broomcorn millet under PEG stress.Journal of China Agricultural University,2012,17(1):53-59.(in Chinese)
[29] 王道杰,桂月靖,杨翠玲,张书芬,朱家成,王建平.油菜抗旱性及鉴定方法与指标 Ⅲ.油菜苗期抗旱性及鉴定指标筛选.西北农业学报,2012,21(5):108-113. Wang D J,Gui Y Q,Yang C L,Zhang S F,Zhu J C,Wang J P.Drought resistance and identification method and evaluation index in brass napusⅢ.Selection of drought resistance identification index at seedling stage.Acta Agriculture Boreali-occidentalis Sinic,2012,21(5):108-113.(in Chinese)
[30] 芦静,曹俊梅,周安定,刘联正,张新忠,黄天荣,高永红,吴新元.PEG处理下新疆冬小麦品种幼苗期生理指标的抗旱性研究.新疆农业科学,2014,51(3):393-402. Lu J,Cao J M,Zhou A D,Liu L Z,Zhang X Z,Huang T R,Gao Y H,Wu X Y.Study on drought resistance physiological mechanism under PEG water-stress of winter wheat varieties at seedling stage in Xinjiang.Xinjiang Agricultural Sciences,2014,51(3):393-402.(in Chinese)
[31] 孙碧徽,李荣全,段小春,常智慧.多年生黑麦草叶片形态与低温胁迫的生理响应.草业科学,2016,33(3):450-458. Sun B H,Li R Q,Duan X C,Chang Z H.Relationship between leaf morphology and physiological responses of perennial rye grass under cold stress.Pratacultural Science,2016,33(3):450-458.(in Chinese)
(责任编辑 张瑾)
Screening on the drought resistance index an conditions for ×TriticaleWittmack at the seedling stage
Li Xue, Tian Xin-hui, Du Wen-hua
(College of Pratacultural Science, Gansu Agricultural University; Key Laboratory of Grassland Ecosystem,Ministry of Education; Pratacultural Engineering Laboratory of Gansu Province;Sino-U.S. Centers for Grazingland Ecosystem Sustainability, Lanzhou 730070, China)
The effects of drought stress on ×TriticaleWittmack seedlings were assessed in order to the develop simulation conditions for determining drought resistance. In order to do this, the hypertonic solution polyethylene glycol (PEG-6000) was used to simulate physiological drought. Indices including water content, relative water content and conductivity, the content of malondialdehyde, chlorophyll a and b, carotenoids, soluble sugar and free proline in leaves were determined. The results showed that 30% PEG treatment for 28 days was an optimal simulation. At significant differences existed for most parameters determined in this study compared with the controls. We also found that the physiological indexes suitable for determining ×TriticaleWittmack success at the seedling stage were water content, relative water content, and levels of malondialdehyde, chlorophyll b, and proline in leaves. After drought stress, ×TriticaleWittmack seedlings grew slowly, and the contents of water, relative water and chlorophyll in leaves decreased, but the content of free proline and MDA increased
×TriticaleWittmack; PEG concentration; physiological biochemical indexes; drought stress; simulation conditions; drought resistance identification; index screening
Du Wen-hua E-mail:duwh@gsau.edu.cn
10.11829/j.issn.1001-0629.2016-0173
2016-04-01 接受日期:2016-11-02
国家自然科学基金(31360577);教育部博士点基金(20136202110005);现代农业产业技术体系建设专项资金(CARS-40-09B)
李雪(1992-),女,黑龙江肇东人,在读硕士生,研究方向为草种质资源及育种栽培。E-mail:1446526840@qq.com
杜文华(1968-),女,甘肃临洮人,教授,博导,博士,研究方向为草种质资源及育种栽培。E-mail:duwh@gsau.edu.cn
S816;S512.403.4
A
1001-0629(2017)3-0539-08*
李雪,田新会,杜文华.饲草型小黑麦苗期抗旱指标的筛选.草业科学,2017,34(3):539-546.
Li X,Tian X H,Du W H.Screening on the drought resistance index and conditions for ×TriticaleWittmack at the seedling stage.Pratacultural Science,2017,34(3):539-546.
