白颖苔草对不同浓度NaCl胁迫的响应及其耐盐阈值
2017-03-27李明娜曹世豪
张 昆,李明娜,曹世豪,孙 彦
(中国农业大学动物科技学院草业科学系 草业科学北京重点实验室,北京 100093)
白颖苔草对不同浓度NaCl胁迫的响应及其耐盐阈值
张 昆,李明娜,曹世豪,孙 彦
(中国农业大学动物科技学院草业科学系 草业科学北京重点实验室,北京 100093)
以白颖苔草(Carexrigescens)为研究材料,采用盆栽试验研究了不同浓度NaCl(0,100,200,300,400,500 mmol·L-1)处理下白颖苔草地上部生长和生理等指标的变化趋势,分析了不同浓度盐处理对白颖苔草生长的影响,并计算确定了其耐盐性的阈值。结果表明,盐处理对白颖苔草的生长产生了抑制作用。随NaCl处理浓度增加,白颖苔草的株高、叶长和叶宽均呈下降趋势,同时枯叶率显著升高(P<0.05)。白颖苔草叶片相对含水量随NaCl浓度的增加呈下降趋势,而叶片的质膜透性则呈升高趋势。但两指标在低浓度盐(NaCl为100和200 mmol·L-1)处理下较无胁迫对照无显著差异(P>0.05),当NaCl浓度超过300 mmol·L-1时,两指标发生显著变化(P<0.05)。超氧化物歧化酶(SOD)和过氧化物酶(POD)活性随NaCl浓度的增加呈先升高后降低的趋势,在300 mmol·L-1处理下均达到最大值,说明在NaCl浓度300 mmol·L-1左右可能存在白颖苔草耐盐的临界浓度。不同浓度NaCl处理对白颖苔草叶片叶绿素a,叶绿素b和叶绿素a+b均产生了不同程度的影响。随盐浓度的增加,叶绿素a和叶绿素a+b含量呈先升高后降低趋把势,叶绿素b含量呈降低趋势,而叶绿素a/b值无显著变化(P>0.05)。以白颖苔草生物量下降50%时的盐浓度来评价其耐盐性,建立回归方程确定其耐盐阈值为263 mmol·L-1。上述结果表明,白颖苔草对盐胁迫有较高的耐受性,在一定范围的盐胁迫环境中能正常生长,该结果可为后续白颖苔草耐盐机制的研究提供理论依据。
白颖苔草;盐胁迫;耐盐性;生长特性;抗氧化酶;叶绿素含量;阈值
土壤的盐渍化是一个全球性的生态问题,对农业生产和人类的生活造成了极大的影响。据不完全统计,我国盐渍土面积约3 600万hm2,盐碱化耕地760万hm2,占全国可利用土地面积的4.88%[1-2]。同时,由于人类活动对自然的影响,不合理的施肥与灌溉等使得土壤盐渍化面积正在逐年增加。因此,筛选和培育耐盐植物新品种,对提高农业生产力和盐渍化土壤的改良都有十分重要的意义。草坪草具有保持水土、美化环境的功能。近年来,随着社会的发展和人民生态意识的提高,我国草坪业发展迅速,关于草坪草耐盐方面的研究也逐渐增多。研究表明,狗牙根(Cynodondactylon)[3]、结缕草(Zoysiajaponica)[4]、高羊茅(Festucaarundinacea)[5]等均可在高浓度盐分的土壤中表现出较好的耐受性,且生长良好。我国野生草坪草种质资源丰富,蕴藏着巨大的抗逆基因库,如对这些优良品种的草坪草进行开发和利用,必将对盐碱地土壤修复和生态环境改良具有重要的促进意义。
白颖苔草(Carexrigescens)属莎草科(Cyperaceae)苔草属寸草亚种,一种多年生野生草坪草种质资源,主要分布在我国内蒙古、甘肃、北京、河北、山东等北方省(区)[6]。白颖苔草植株较矮,生长一般不超过30 cm,耐践踏性好,具有发达的地下根茎,无性繁殖能力强,有一定的地面覆盖能力。叶片纤细,绿期200 d以上,外形整齐美观,可作为观赏和装饰性草坪,也可作为人流不多的公园、游乐场所和居住区的绿化材料[7-8]。目前,国内对于白颖苔草的研究主要集中在种质资源多样性和药用价值方面[9-11]。对不同地区白颖苔草种质资源的收集发现,它在盐碱地生长较其它植物有明显优势,初步认为其具有一定的耐盐性,但目前国内外关于这方面的研究报道较少。
因此,本研究以白颖苔草为研究材料,研究不同浓度NaCl处理下其生长、叶片相对含水量、叶片质膜透性、抗氧化酶活性、叶绿素含量等变化情况并以生物量降低50%为标准计算其耐盐阈值,旨在探索白颖苔草对不同盐分胁迫的耐受情况,确定其抵抗胁迫的临界值,为后续研究其耐盐种质的筛选和耐盐生理生化及分子机制提供理论支持。
1 材料与方法
1.1 试验材料
供试白颖苔草材料取自河北省黄骅市,现保存于中国农业大学动物科技学院农业部牧草与草坪草种子质量监督检验测试中心。
1.2 试验设计
该试验于2016年2月至5月在中国农业大学动物科技学院温室中进行。温室条件为温度(23±5) ℃,光照强度7 000~8 000 lx,日照时间12 h。采用白颖苔草标准发芽试验方法[12],20% NaOH预处理白颖苔草种子,种于直径8 cm、高10 cm有孔塑料杯中,培养基质为营养土∶蛭石∶生土=1∶1∶1,每盆3株。培养两个月后,将所有材料修剪至同一高度,开始用NaCl溶液处理,浓度设置为0(CK)、100、200、300、400和500 mmol·L-1,对照用蒸馏水处理。随机区组排列,每处理设4次重复。处理开始前按照每天50 mmol·L-1浓度递增盐浓度,直至目标浓度后,再处理28 d。每天浇灌一次,每次标准为底部渗出溶液积满杯底托盘。28 d后开始各项指标的测定。
1.3 测定指标与方法
1.3.1 生长指标 用直尺测量各处理下每盆每株苔草从基部到顶端的垂直高度,取各处理均值记为株高;每株取5片正常生长的叶片测量长度,取各处理均值记为叶长;每株取5片正常生长的叶片用游标卡尺测量其最宽处,取各处理均值记为叶宽;采用观测计数法对NaCl处理的每盆白颖苔草叶片进行计数,以叶片50%枯黄作为标准,计算每盆枯黄叶片数占总叶片数的百分比,记为枯叶率[13]。
1.3.2 叶片相对含水量 剪取各处理下白颖苔草叶片0.2 g,记为Wf,将称好的叶片用蒸馏水浸泡6 h后,取出迅速吸干表面水分称其饱和鲜重(Wt),最后将叶片放入105 ℃烘箱杀青15 min,75 ℃烘干至恒重(Wd),每处理重复3次。计算公式:
叶片相对含水量=(Wf-Wd)/(Wt-Wd)×100%。
1.3.3 叶片细胞膜透性 用叶片相对电导率来表示叶片细胞膜受伤害的程度,采用电导仪法[14]测定。在玻璃试管中加入20 mL去离子水,测定电导率(S0);然后剪取白颖苔草叶片,用去离子水冲洗干净,吸干表面水分后准确称取0.2 g,剪成小段后装入加去离子水的试管中,浸泡24 h后测定试管中浸泡液的电导率(S1)。将试管加塞,置于沸水浴中30 min,冷却至室温,测定浸泡液电导率(S2)。每处理重复3次,计算公式:
相对电导率=(S1-S0)/(S2-S0)×100%。
1.3.4 叶片SOD活性 采用氮蓝四唑法[14]测定叶片SOD活性,取0.2 g白颖苔草叶片,加5 mL pH为7的磷酸缓冲液在研钵中研磨成匀浆,3 000 r·min-1离心10 min,取上清液测定酶活。测定反应体系:1.5 mL 0.05 mol·L-1磷酸缓冲液,0.3 mL 130 mmol·L-1甲硫氨酸溶液,0.3 mL 750 μmol·L-1氮蓝四唑溶液,0.3 mL 100 μmol·L-1EDTA-Na2溶液,0.3 mL 20 μmol·L-1核黄素,0.25 mL蒸馏水,0.05 mL酶液。反应体系中加入酶液后混匀,对照管置于暗处,其它管于4 000 lx日光下反应20 min,以对照作空白,560 nm波长下测定吸光度,每处理重复3次。
SOD活性=(ACK-AE)×V/1/2×ACK×W×VT。
式中,ACK为对照管的吸光度,AE为样品管的吸光度,V为样品液总体积,VT为测定样品液用量,W为样品鲜重。
1.3.5 叶片POD活性 采用愈创木酚显色法[14]测定叶片POD活性。取0.2 g白颖苔草叶片,加5 mL pH为7的磷酸缓冲液研钵中研磨成匀浆,3 000 r·min-1离心10 min,取上清液测定酶活。测定反应体系:2.9 mL 0.05 mol·L-1磷酸缓冲液,1 mL 2% H2O2,1 mL 0.05 mol·L-1愈创木酚和0.1 mL酶液。反应体系加入酶液后立即于37 ℃水浴中保温15 min,然后迅速转入冰浴中并加入2 mL 20%三氯乙酸终止反应,5 000 r·min-1离心10 min 取上清,470 nm波长下测定吸光度,每处理重复3次。
POD活性=(ΔAE×VT)/(W×VS×0.01×t)。
式中:ΔAE为反应时间内吸光度的变化,W为白颖苔草叶片重量,VT为提取酶液的总体积,VS为测定时取用酶液的体积。
1.3.6 叶绿素含量 采用乙醇浸泡法[14]测定叶绿素含量,称取0.1 g白颖苔草叶片,剪碎后放入10 mL玻璃试管中,加入95%乙醇,黑暗条件下浸提48 h,至叶片完全脱色,用分光光度计测定提取液在665和649 nm处的吸光值,按照下列公式[15]计算叶绿素a、叶绿素b和总叶绿素含量a+b及其比值叶绿素a/b。每处理重复3次。
叶绿素a=13.95A665-6.88A649;
1.3.7 单株干重及阈值计算 剪取每盆白颖苔草单株地上部,放入105 ℃烘箱中杀青30 min,75 ℃烘干至恒重,称重记为单株干重。多数植物以其植株生物量下降50%时的盐浓度作为该植物的耐盐阈值[16-17]。试验中以NaCl处理28 d时的单株干重进行分析,以不同NaCl浓度作为自变量建立回归方程,设定地上部干重比对照处理下降50%时NaCl浓度作为白颖苔草的耐盐阈值。
1.4 数据处理与统计分析
试验数据采用SPSS 19.0软件进行统计分析,采用One-way ANOVA对数据进行单因素方差分析,采用Duncan新复极差法比较不同处理间的差异,显著水平为0.05;采用Excel 2007进行图表的制作。
2 结果与分析
2.1 NaCl胁迫对白颖苔草生长的影响
盐胁迫抑制了白颖苔草的生长,随盐浓度的升高,白颖苔草的株高、叶长和叶宽均呈下降趋势(图1)。当NaCl浓度为100 mmol·L-1时,盐胁迫对白颖苔草株高的抑制不明显(P>0.05),但当NaCl浓度高于100 mmol·L-1,白颖苔草的株高显著降低(P<0.05)。NaCl浓度为500 mmol·L-1时,株高较对照下降了33.18%。盐胁迫显著抑制了白颖苔草叶片的生长,NaCl浓度为100 mmol·L-1时,叶长和叶宽较对照分别下降了4.47%和8.52%;当NaCl浓度为500 mmol·L-1时,叶长和叶宽较对照分别下降了30.21%和24.07%。枯叶率在一定程度上能反映盐处理对白颖苔草的胁迫程度,盐胁迫加速了白颖苔草叶片衰老,随盐浓度的升高,白颖苔草枯叶率显著升高(P<0.05),NaCl浓度500 mmol·L-1枯叶率为66.95%,较对照提高了255.17%(图1)。
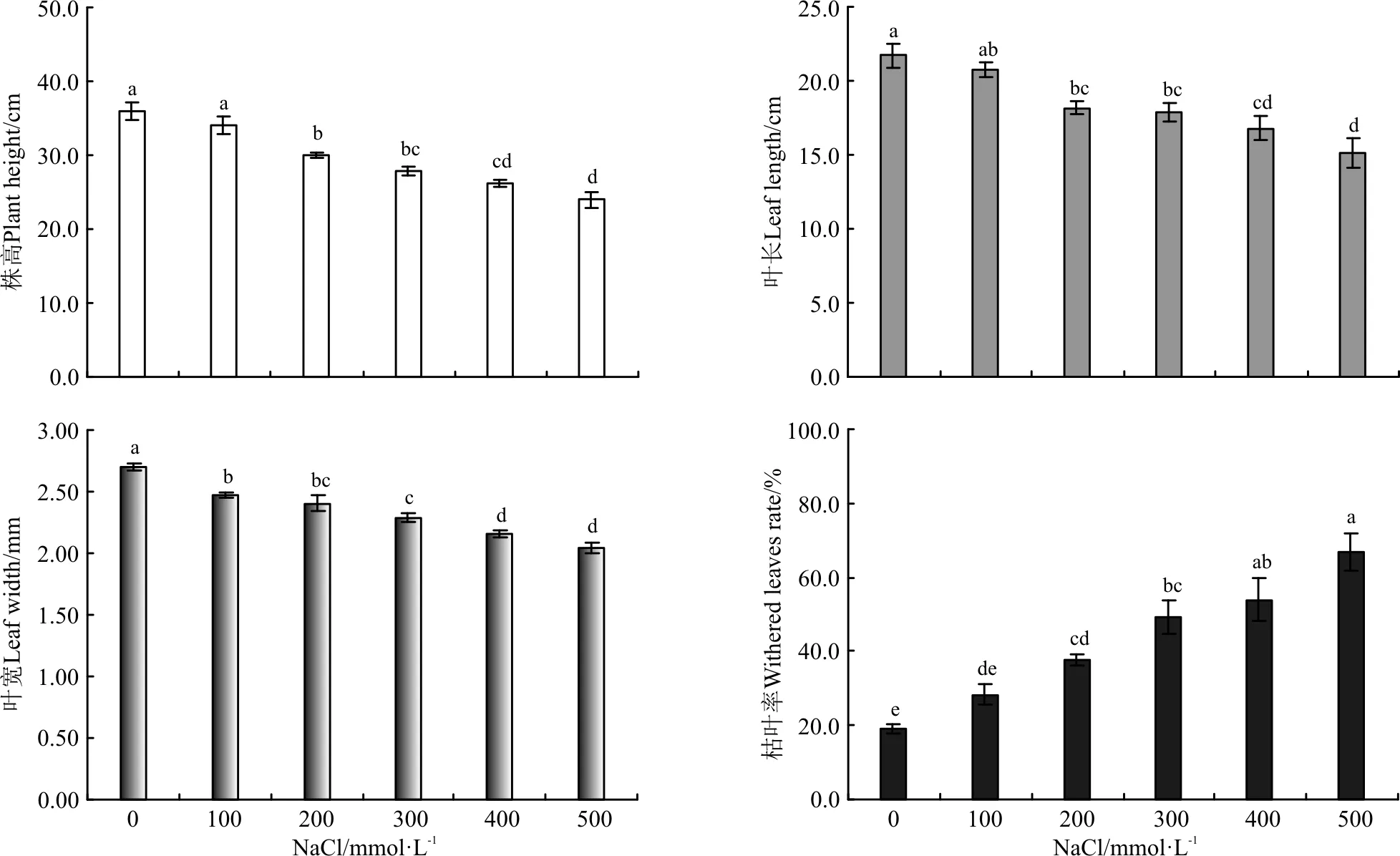
图1 NaCl胁迫对白颖苔草株高、叶长、叶宽和枯叶率的影响
注:不同小写字母表示处理间差异显著(P<0.05),下同。
Note: Different lowercase letters indicate significant difference among different treatments at the 0.05 level; similarly for the following figures.
2.2 NaCl胁迫对白颖苔草叶片相对含水量的影响
随着盐浓度的增加,白颖苔草叶片相对含水量呈逐渐下降的趋势(图2)。当NaCl浓度在100~300 mmol·L-1范围内,叶片相对含水量有小幅度的降低,但均与对照差异不显著(P>0.05)。当NaCl浓度为400和500mmol·L-1时,白颖苔草叶片相对含水量较对照分别显著降低了20.50%和22.27%(P<0.05)。
对接锁合组件的锁合原理如图5所示,主要是通过卡榫上的片簧棘爪一体式结构与钻进机构导轮支架内的圆柱孔进行锁合。

图2 NaCl胁迫对白颖苔草叶片相对含水量的影响
2.3 NaCl胁迫对白颖苔草叶片质膜透性的影响
随着NaCl浓度的增加,整体上白颖苔草叶片的相对电导率呈现出一个逐渐递增的趋势(图3)。在NaCl浓度0~200 mmol·L-1范围内,叶片的相对电导率有小幅升高,但各处理间差异不显著(P>0.05)。当NaCl浓度≥300mmol·L-1时,白颖苔草叶片的相对电导率均显著高于对照(P<0.05),分别为58.03%、65.53%和68.25%,但各处理之间差异不显著(P>0.05)。这表明NaCl浓度在200~300 mmol·L-1之间可能存在影响白颖苔草质膜透性的一个临界盐浓度。

图3 NaCl胁迫对白颖苔草叶片质膜透性的影响
2.4 不同浓度NaCl胁迫对白颖苔草叶片SOD和POD活性的影响
不同盐处理间白颖苔草叶片中的SOD活性差异显著(P<0.05)。随着盐浓度的增加,白颖苔草叶片中的SOD活性呈现先升高后降低的趋势,并且在NaCl浓度为300 mmol·L-1时达到最大值,较对照提高了229.2%(图4),推测该浓度可能是白颖苔草盐耐受能力的最大值。POD活性的变化趋势与SOD活性基本一致(图5),NaCl浓度为300 mmol·L-1处理时,白颖苔草叶片POD活性显著高于其它处理(P<0.05)。当NaCl浓度超过300 mmol·L-1时,POD活性有明显的降低,但400和500 mmol·L-1处理间差异不显著(P>0.05),说明此时白颖苔草受到的盐害加重,超过了自身的适应能力,抗氧化能力降低。

图4 NaCl胁迫对白颖苔草叶片SOD活性的影响
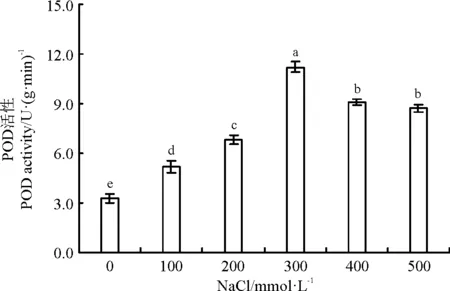
图5 NaCl胁迫对白颖苔草叶片POD活性的影响
2.5 NaCl胁迫对白颖苔草叶绿素含量的影响
各浓度NaCl处理对白颖苔草叶片叶绿素a、叶绿素b和叶绿素a+b均产生了不同程度的影响(图6)。随盐浓度的增加,白颖苔草叶绿素a的含量呈现先升高后降低的趋势,在NaCl浓度为100 mmol·L-1时达到最大值,为1.38 mg·g-1,400和500 mmol·L-1处理时显著低于其它处理(P<0.05)。叶绿素b随NaCl浓度的升高呈降低趋势,但在100~400 mmol·L-1NaCl浓度范围内差异不显著(P>0.05),500 mmol·L-1处理下白颖苔草叶绿素b含量显著低于对照(P<0.05)。不同浓度NaCl处理下白颖苔草叶绿素a+b的变化趋势与叶绿素a的变化趋势相似。随盐浓度的增加先升高后降低,NaCl浓度为100 mmol·L-1时,叶绿素a+b的含量高于其它处理,为1.82 mg·g-1。盐处理对叶绿素a/b值无明显的影响,各处理间差异不显著(P>0.05)。整体上随NaCl浓度的增加,叶绿素a/b值呈先升高后降低的趋势,在NaCl浓度为100 mmol·L-1时达到最大值。
2.6 不同浓度NaCl胁迫下白颖苔草的单株干重和阈值
随着NaCl浓度的增加,白颖苔草单株干重呈现出逐渐降低的趋势(图7)。NaCl处理浓度为500 mmol·L-1时,单株干重最低,较对照降低了75.09%。多数植物以其植株生物量下降50%时的盐浓度作为该植物的耐盐阈值。本研究中,对不同浓度NaCl处理的单株干重进行分析,以不同NaCl浓度作为自变量建立回归方程,得y=1E-06x2-0.001 9x+0.828 1(R2=0.977 2)。盐阈值设定为白颖苔草单株干重较对照下降50%时的NaCl浓度,计算可得为262.59 mmol·L-1。通过分析各指标与NaCl胁迫处理下白颖苔草单株干重之间的相关性发现(表1),株高、叶宽、叶长和叶片相对含水量与单株干重极显著相关,与叶绿素含量显著相关。因此,可以初步认为株高可以作为白颖苔草耐盐性鉴定的首选指标。
3 讨论
盐胁迫对植物的影响是多方面的,主要表现在对生长发育的影响,通常植物地上部较根部受到的抑制明显[18]。本研究中,随着盐浓度的增加,白颖苔草株高、叶长和叶宽等均呈逐渐降低的趋势。白颖苔草对低盐环境有一定的适应性,但当NaCl浓度超过200 mmol·L-1时,白颖苔草生长开始受到明显抑制。该结果与海滨雀稗(Paspalumvaginatum)[19]、结缕草[20]、高羊茅[21]等草坪草耐盐性的研究结果相似。这可能是由于随着盐处理浓度的增加,白颖苔草植株失水,生长代谢活动减弱,抑制了叶片的生长。草坪草在受到盐胁迫时叶片会出现不同程度的黄化现象,甚至出现凋萎。叶片枯叶率是对草坪草进行耐盐性筛选的一个重要的外部形态指标[22]。高浓度的盐处理下白颖苔草叶片的枯叶率超过了50%,植株严重缺水,相应的叶色和坪用质量也较差[23]。
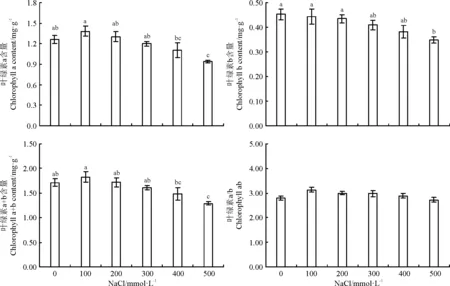
图6 NaCl胁迫对白颖苔草叶绿素含量及其比值的影响
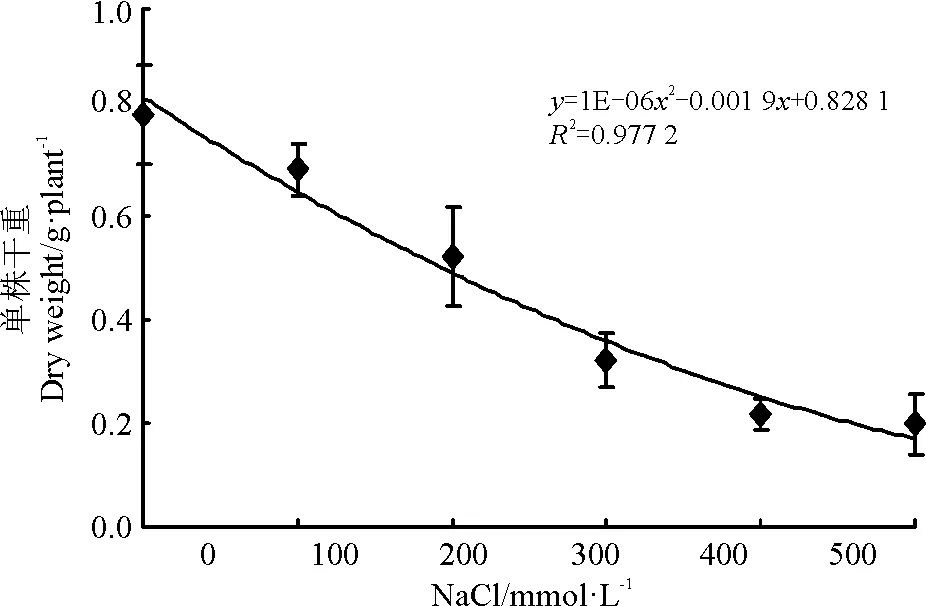
图7 NaCl胁迫对白颖苔草干重的影响
盐环境中,植物根系细胞由于内外渗透势的变化吸水能力受到限制,会造成“生理干旱”效应,地上部含水量降低[24]。本研究中,随盐浓度的增加,白颖苔草叶片相对含水量整体上呈递减的趋势。当NaCl浓度超过300 mmol·L-1时,白颖苔草受到了较严重的水分胁迫,说明此时根系的吸水及根系向地上部的水分运输开始受到明显的抑制。细胞膜是植物细胞与外界环境之间的屏障,当植物受到盐胁迫时,活性氧的产生会造成质膜的机械性损伤,透性增加[25]。盐浓度的升高会增加白颖苔草叶片的相对电导率,当NaCl浓度达到300 mmol·L-1时,该指标明显骤升,表明NaCl浓度在300 mmol·L-1左右可能是白颖苔草叶片细胞膜透性的一个临界值。当盐浓度继续升高后,白颖苔草叶片细胞膜膜脂过氧化程度加重,质膜的透性增加。这与李源[26]研究NaCl胁迫下5种暖季型草坪草生理变化和Hu等[27]对盐胁迫下两种狗牙根抗氧化酶的变化等研究结果一致。
逆境胁迫引起的植物体伤害主要与活性氧的积累有关。活性氧的增加会使细胞质膜发生过氧化,通透性丧失,最终导致细胞失水,植物体代谢紊乱。通常情况下,植物体内产生的活性氧和清除活性氧系统处于动态平衡的状态。当植物处于逆境环境时各种氧化酶(SOD、POD、CAT等)的活性会升高,以此来消除胁迫产生的活性氧,降低膜脂伤害[28],提高抗逆性。0.2%~0.5%土壤盐分胁迫处理下,假俭草(Eremochloaophiuroides)SOD活性随盐浓度的增加而增加,但

表1 NaCl胁迫下白颖苔草干重相关指标之间相关性分析
注:**表示在0.01水平(双侧)上显著相关,*表示在0.05水平(双侧)上显著相关。
Note: ** and * indicates significant correlation at the 0.01 and 0.05 level (bilateral),respectively.
在0.6%~0.9%盐分胁迫处理下随着胁迫时间的延长,SOD活性逐渐降低[29]。本研究中,白颖苔草叶片SOD和POD活性随着NaCl处理浓度的增加也呈现先升高后降低的趋势,说明在一定浓度的盐胁迫下白颖苔草能对逆境条件作出适应性的反应,表现为抗氧化酶活性增加,降低了胁迫伤害。但当盐胁迫浓度大于自身承受力时,白颖苔草叶片抗氧化酶活性会开始降低,活性氧增加,导致膜脂生理功能破坏,植物体失水枯萎甚至死亡[30]。
叶绿素是植物进行光合作用的重要物质,逆境条件下叶绿素含量是衡量植物抗逆性的重要指标[31]。目前已经有许多关于盐胁迫下植物叶绿素含量影响的研究,但不同的植物种类和盐处理得出的结论不同。本研究中,随盐浓度的增加白颖苔草叶绿素的含量表现出先升高后降低的趋势。这一结果与翁锦周等[32]研究盐胁迫下桉树(Eucalyptusrobusta)幼苗叶绿素含量的变化和邹丽娜等[33]研究盐分胁迫对紫穗槐(Amorphafruticosa)幼苗生理生化特性的影响等试验结果一致。低浓度NaCl处理下,白颖苔草叶绿素含量上升,这可能是其对盐胁迫的一种适应机制。叶片中叶绿素与叶绿素蛋白共价结合,盐处理会使得这种结合变松弛,通常低盐浓度下植物会增加叶绿素合成来减缓这种生理干扰[34]。此外,叶绿素的合成需要脯氨酸,低盐处理下植物细胞大量积累脯氨酸也有利于叶绿素的合成[35]。当NaCl浓度继续升高至400 mmol·L-1时,白颖苔草叶片细胞继续失水,叶片细胞质膜及叶绿体结构被破坏,加速了叶绿素的分解,叶绿素含量降低[36]。
植物生物量的变化是其耐盐能力的综合体现。盐胁迫下植物由于细胞失水,代谢缓慢甚至停止,有机物的合成减少,生物量降低。当NaCl浓度为500 mmol·L-1时,白颖苔草单株干重最低,较对照降低了75.09%,表明高浓度的盐对地上部的生长抑制作用显著,甚至造成了植株的死亡。
通过盐胁迫下生物量的降低可以估测植物对盐胁迫的临界浓度,通过计算,白颖苔草耐盐阈值为263 mmol·L-1,基于此,可初步认为白颖苔草在坪用草种中属耐盐品种。但是,草坪草的耐盐性受遗传背景和环境等多方面的影响[37-38],本研究中不同NaCl浓度处理对白颖苔草生长和生理指标的影响还不能全面地反映该种质的耐盐特性,应从生理生化、分子生物学和田间栽培管理等多方面出发,探索并揭示其耐盐机制。
References:
[1] 李建国,濮励杰,朱明,张润森.土壤盐渍化研究现状及未来研究热点.地理学报,2012,67(9):1233-1245. Li J G,Pu L J,Zhu M,Zhang R S.The present situation and hot issues in the salt-affected soil research.Acta Geographica Sinica,2012,67(9):1233-1245.(in Chinese)
[2] 王立艳,潘洁,杨勇,肖辉,程文娟.滨海盐碱地种植耐盐草本植物的肥土效果.草业科学,2014,31(10):1833-1839. Wang L Y,Pan J,Yang Y,Xiao H,Cheng W J.The fertility effects of salt-tolerant herbaceous plants on coastal saline soil.Pratacultural Science,2014,31(10):1833-1839.(in Chinese)
[3] 王太亮,韩兆胜,庞妙甜,董宽虎,朱慧森.NaCl胁迫对狗牙根生理生化特性的影响.草原与草坪,2015,35(1):63-67. Wang T L,Han Z S,Pang M T,Dong K H,Zhu H S.Effect of NaCl stress on physiological characteristics of bermudagrass.Grassland and Turf,2015,35(1):63-67.(in Chinese)
[4] 薛秀栋,董晓颖,段艳欣,李培环,王滨.不同盐浓度下3种结缕草的耐盐性比较研究.草业学报,2013,22(6):315-320. Xue X D,Dong X Y,Duan Y X,Li P H,Wang B.A comparison of salt resistant of three kinds ofZoysiaat different salt concentrations.Acta Prataculturae Sinica,2013,22(6):315-320.(in Chinese)
[5] 樊瑞苹,周琴,周波,江海东.盐胁迫对高羊茅生长及抗氧化系统的影响.草业学报,2012,21(1):112-117. Fan R P,Zhou Q,Zhou B,Jiang H D.Effect of salinization stress on growth and the antioxidant system of tall fescue.Acta Prataculturae Sinica,2012,21(1):112-117.(in Chinese)
[6] 贺士元,邢其华,尹祖棠.北京植物志.北京:北京出版社,1992. He S Y,Xing Q H,Yin Z T.Flora of Beijing.Beijing:Beijing Press,1992.(in Chinese)
[7] 杨学军,武菊英,滕文军,袁小环.北京薹草属植物资源调查与园林应用评价.广西植物,2014,34(5):664-669. Yang X J,Wu J Y,Teng W J,Yuan X H.Investigation and landscape application evaluation onCarexresourcesin Beijing.Guihaia,2014,34(5):664-669.(in Chinese)
[8] 冷建红,楼炉焕,魏琦,刘彬彬.薹草属植物研究进展及园林应用前景研究.北方园艺,2011(6):196-201. Leng J H,Lou L H,Wei Q,Liu B B.Research progress ofCarexand its application to landscape.Northern Horticulture,2011(6):196-201.(in Chinese)
[9] 吉文丽,朱清科,李卫忠,姚爱静.苔草植物分类,利用及物质循环研究进展.草业科学,2006,23(2):15-21. Ji W L,Zhu Q K,Li W Z,Yao A J.Review of studies on the classification,application and material cycle of plants in genusCarex.Pratacultural Science,2006,23(2):15-21.(in Chinese)
[10] 王俊强,吕会刚,方唯,李敏.苔草属种质资源的研究与应用.北京园林,2006,22(2):36-38. Wang J Q,Lyu H G,Fang W,Li M.Research and application evaluation onCarexresources.Beijing Landscape Architecture.2006,22(2):36-38.(in Chinese)
[11] 高川,容蓉,孟红,张治强,郭培俊.白颖苔草抗病毒药用价值的初步研究.山东中医药大学学报,2009,33(4):343-345. Gao C,Rong R,Meng H,Zhang Z Q,Guo P J.Investigation of the antiviral activity and medicinal value ofCarexrigescens.Journal of Shandong University of Traditional Chinese Medicine,2009,33(4):343-345.(in Chinese)
[12] 孙彦,李曼莉,毛培胜.白颖苔草标准发芽试验方法的研究.北方园艺,2011(19):68-70. Sun Y,Li M L,Mao P S.Study on standard germination test method ofCarexrigescensseed.Northern Horticulture,2011(19):68-70.(in Chinese)
[13] 张静,廖丽,白昌军,王志勇.竹节草对NaCl胁迫临界浓度的初步研究.草地学报,2014,22(3):661-664. Zhang J,Liao L,Bai C J,Wang Z Y.Critical concentration of salt stress inChrtsopogonaciculatus.Acta Agrestia Sinica,2014,22(3):661-664.(in Chinese)
[14] 李合生.植物生理生化试验原理和技术.北京:高等教育出版社,2000:134-137. Li H S.Plant Physiological Biochemistry Principle and Technology.Beijing:Higher Education Press,2000:134-137.(in Chinese)
[16] Qian Y L,Wilhelm S J,Marcum K B.Comparative responses of two Kentucky bluegrass cultivars to salinity stress.Crop Science,2001,41(6):1895-1900.
[17] Suplick-Ploense M R,Qian Y L,Read J C.Relative NaCl tolerance of Kentucky bluegrass,Texas bluegrass,and their hybrids.Crop Science,2002,42(6):2025-2030.
[18] 赵生龙,曾凡江,张波,刘波,高欢欢,罗翰林.盐分胁迫对骆驼刺幼苗叶片性状的影响.草业科学,2016,33(9):1770-1778. Zhao S L,Zeng F J,Zhang B,Liu B,Gao H H,Luo H L.Effects of salt stress on leaf traits ofAlhagisparsifolia.Pratacultural Science,2016,33(9):1770-1778.(in Chinese)
[19] 贾新平,邓衍明,孙晓波,梁丽建.盐胁迫对海滨雀稗生长和生理特性的影响.草业学报,2015,24(12):204-212. Jia X P,Deng Y M,Sun X B,Liang L J.Impacts of salt stress on the growth and physiological characteristics ofPaspalumvaginatum.Acta Prataculturae Sinica,2015,24(12):204-212.(in Chinese)
[20] 胡化广,张振铭.大穗结缕草对盐胁迫响应及临界盐浓度的研究.北方园艺,2010(3):80-83. Hu H G,Zhang Z M.Study on responses to salt stress and critical salt concentration ofZoysiamacrostachya.Northern Horticulture,2010(3):80-83.(in Chinese)
[21] 高扬帆,吕文彦,王丙丽,李俊霞.盐胁迫对高羊茅种子萌发及幼苗生长的影响.安徽农业科学,2006,34(22):5781-5781. Gao Y F,Lyu W Y,Wang B L,Li J X.Effect of salt stress on seed germination and seedling growth of tall fescue.Journal of Anhui Agricultural Sciences,2006,34(22):5781-5781.(in Chinese)
[22] 陈静波,张婷婷,阎君,郭海林,刘建秀.短期和长期盐胁迫对暖季型草坪草新选系生长的影响.草业科学,2008,25(7):109-113. Chen J B,Zhang T T,Yan J,Guo H L,Liu J X.Effects of short-term and long-term salt stresses on growth of new selections of warm season turfgrass.Pratacultural Science,2008,25(7):109-113.(in Chinese)
[23] 董丽华,姚爱兴,王宁.盐分对草坪草影响研究概述.西北林学院学报,2006,21(1):64-67. Dong L H,Yao A X,Wang N.A review on salinity tolerance of turfgrass.Journal of Northwest Forestry University,2006,21(1):64-67.(in Chinese)
[24] Lee G,Carrow R N,Duncan R R.Growth and water relation responses to salinity stress in halophytic seashore paspalum ecotypes.Scientia Horticulturae,2005,104(2):221-236.
[25] Ott T,Clarke J,Birks K,Johnson G.Regulation of the photosynthetic electron transport chain.Planta,1999,209(2):250-258.
[26] 李源.NaCl胁迫和低温胁迫对五种暖季型草坪草生长及生理指标的影响.南京:南京农业大学硕士论文,2013. Li Y.Effects of NaCl stress and cold stress on growth and physiological indexes of five warm season turfgrass.Master Thesis.Nanjing:Nanjing Agriculture University,2013.(in Chinese)
[27] Hu L,Huang Z,Liu S,Fu J M.Growth response and gene expression in antioxidant-related enzymes in two bermudagrass genotypes differing in salt tolerance.Journal of the American Society for Horticultural Science,2012,137(3):134-143.
[28] AbdElgawad H,Zinta G,Hegab M M,Pandey R,Asard H,Abuelsoud W.High salinity induces different oxidative stress and antioxidant responses in maize seedlings organs.Frontiers in Plant Science,2016:doi:10.3389/fpls.2016.00276.
[29] 周兴元,曹福亮.土壤盐分胁迫对三种暖季型草坪草保护酶活性及脂质过氧化作用的影响.林业科学研究,2005,18(3):336-341. Zhou X Y,Cao F L.Effects of soil salt stress on the activity of protective enzymes and peroxidation in three warm-season turfgrasses.Forest Research,2005,18(3):336-341.(in Chinese)
[30] Chawla S,Jain S,Jain V.Salinity induced oxidative stress and antioxidant system in salt-tolerant and salt-sensitive cultivars of rice (OryzasativaL.).Journal of Plant Biochemistry and Biotechnology,2013,22(1):27-34.
[31] Matoh T,Murata S.Sodium stimulates growth ofPanicumcoloratumthrough enhanced photosynthesis.Plant Physiology,1990,92(4):1169-1173.
[32] 翁锦周,林江波,林加耕,张梅坤,陈永快,曾日秋,吴水金.盐胁迫对桉树幼苗的生长及叶绿素含量的影响.热带作物学报,2008,28(4):15-20. Weng J Z,Lin J B,Lin J G,Zhang M K,Chen Y K,Zeng R Q,Wu S J.Effect of salt stress on the growth and the content of chlorophyll in seedling leaves ofEucalyptus.Chinese Journal of Tropical Crops,2008,28(4):15-20.(in Chinese)
[33] 邹丽娜,周志宇,颜淑云,秦彧.盐分胁迫对紫穗槐幼苗生理生化特性的影响.草业学报,2011,20(3):84-90. Zou L N,Zhou Z Y,Yan S Y,Qin Y.Effect of salt stress on physiological and biochemical characteristics ofAmorphafruticosaseedlings.Acta Prataculturae Sinica,2011,20(3):84-90.(in Chinese)
[34] 董晓霞,赵树慧,孔令安,郭洪海,刘光栋.苇状羊茅盐胁迫下生理效应的研究.草业科学,1998,15(5):10-13. Dong X H,Zhao S H,Kong L G,Guo H H,Liu G D.Physiological responses of tall fescue to salt stress.Pratacultural Science,1998,15(5):10-13.(in Chinese)
[35] 赵可夫.植物抗盐生理.北京:中国科学技术出版社,1993:230-231. Zhao K F.Plant Salt Resistance Physiology.Beijing:China Science and Technology Press,1993:230-231.(in Chinese)
[36] 安飞飞,简纯平,杨龙,陈松笔,李开绵.木薯幼苗叶绿素含量及光合特性对盐胁迫的响应.江苏农业学报,2015,31(3):500-504. An F F,Jian C P,Yang L,Chen S B,Li K M.Chlorophyll contents and photosynthetic of cassava seedlings in response to NaCl stress.Jiangsu Journal of Agricultural Sciences,2015,31(3):500-504.(in Chinese)
[37] Pardo J M,Hasegawa M,Bressan R.The dawn of plant salt tolerance genetics.Trendsin Plant Science,2000,5(8):317-319.
[38] 潘多锋,申忠宝,王建丽,高超,李道明,张瑞博.红三叶种质的耐盐性评价及对盐胁迫的生理响应.北方园艺,2015(24):46-50. Pan D F,Shen Z B,Wang J L,Gao C,Li D M,Zhang R B.Evaluation of salt tolerance and physiological response of red clover under salt stress.Northern Horticulture,2015(24):46-50.(in Chinese)
(责任编辑 武艳培)
Response ofCarexrigescensto different NaCl concentrations and its salinity threshold calculation
Zhang Kun, Li Ming-na, Cao Shi-hao, Sun Yan
(Department of Grassland Science, College of Animal Science and Technology,China Agricultural University, Key Laboratory of Grassland Science of Beijing, Beijing 100093, China)
The effect of different NaCl concentration (0, 100, 200, 300, 400, 500 mmol·L-1) treatments on the growth and physiological parameters ofCarexrigescenswere tested to determine its growth and salinity threshold under salt stress. The results showed that NaCl treatment inhibited the growth ofC.rigescens. With increasing salt concentrations, plant height, leaf length, and leaf width ofC.rigescensall decreased and the rate of withered leaves increased significantly. Leaf relative water content decreased and leaf membrane permeability increased under the same treatment condition and these two parameters had no significant change under the lower NaCl treatment (100 and 200 mmol·L-1). However, the change was significant when the NaCl concentration exceeded 300 mmol·L-1. The activity of leaf SOD (superoxide dismutase) and POD (peroxidase) increased at first and then decreased and the maximum activity occurred in the 300 mmol·L-1treatment. This implied that 300 mmol·L-1could be the critical NaCl concentration for salt tolerance ofC.rigescens. Different NaCl concentration treatments had different effects on the chlorophyll content. With the increase in NaCl concentration, chlorophyll a and chlorophyll a+b content increased at first and decreased subsequently. Chlorophyll b tended to decrease and chlorophyll a/b showed no significant change. WhenC.rigescensbiomass decreased to 50%, we considered the NaCl concentration as the threshold to evaluate the salt tolerance ofC.duriusculasubsp.rigescens. The calculated salinity threshold value ofC.rigescensin our study was 263 mmol·L-1. In conclusion,C.rigescenshad a high salt tolerance and it could grow normally in a saline environment. The results of this study provide an important theoretical basis for further research on the salt-tolerance mechanism ofC.rigescens.
Carexrigescens; salt stress; salt tolerance; growth characteristics; antioxidase; chlorophyll content; threshold
Sun Yan E-mail:ctsoffice@163.com
10.11829/j.issn.1001-0629.2016-0359
2016-07-01 接受日期:2016-12-09
国家自然科学基金项目“盐胁迫下白颖苔草蛋白组学的研究”(31472139)
张昆(1988-),男,山东青岛人,在读博士生,主要从事牧草与草坪草遗传育种研究。E-mail:zk61603@163.com
孙彦(1965-),女(蒙古族),内蒙科左中旗人,副教授,博士,主要从事草坪科学及草种子质量检验研究。E-mail:ctsoffice@163.com
Q945
A
1001-0629(2017)3-0479-09*
张昆,李明娜,曹世豪,孙彦.白颖苔草对不同浓度NaCl胁迫的响应及其耐盐阈值.草业科学,2017,34(3):479-487.
Zhang K,Li M N,Cao S H,Sun Y.Response ofCarexrigescensto different NaCl concentrations and its salinity threshold calculation.Pratacultural Science,2017,34(3):479-487.
