盐生植物四翅滨藜Actin基因片段的克隆及表达分析
2017-03-27崔彦农许香玉包爱科
郭 欢,崔彦农,吴 凡,张 乐,许香玉,包爱科
(兰州大学草地农业科技学院 草地农业生态系国家重点实验室,甘肃 兰州 730020)
植物生产层
盐生植物四翅滨藜Actin基因片段的克隆及表达分析
郭 欢,崔彦农,吴 凡,张 乐,许香玉,包爱科
(兰州大学草地农业科技学院 草地农业生态系国家重点实验室,甘肃 兰州 730020)
在研究植物功能基因表达模式中肌动蛋白(Actin)编码基因是最常用的内参基因之一。本研究根据藜科植物Actin基因编码区保守序列设计一对简并引物,以盐生植物四翅滨藜(Atriplexcanescens)4周龄幼苗叶片的总RNA为模板,采用逆转录PCR(reverse transcription PCR,RT-PCR)方法扩增出Actin基因片段并连接到pMD19-T载体上,所得阳性克隆经PCR检测后进行测序。序列分析结果表明,该基因片段长度为598 bp,编码198个氨基酸;该序列与Genbank中登录的高等植物Actin基因核苷酸序列同源性在84%以上,氨基酸序列同源性在94%以上。说明其为Actin基因片段,具有高度保守性,命名为AcACT。序列进化分析显示,AcACT与甜菜(Betavulgaris)和碱蓬(Suaedaglauca)肌动蛋白编码基因的亲缘关系最近。荧光定量PCR分析结果表明,AcACT在盐处理下各组织中的表达量恒定。表明AcACT可作为内参基因来研究四翅滨藜耐盐相关基因的表达模式。
四翅滨藜;肌动蛋白;基因克隆;RT-PCR;氨基酸;甜菜;碱蓬
目前,全球干旱、半干旱区面积正在不断扩张,而土壤水分的长期缺失会造成土壤盐渍化程度日益加重,从而造成农作物减产,农业生产力下降。然而,日益恶劣的自然环境也孕育出丰富的抗逆植物种质资源[1]。四翅滨藜(Atriplexcanescens)是藜科(Chenopodiaceae)滨藜属的一类优质抗逆种质资源,为多年生C4半常绿灌木,是一种典型的盐囊泡类盐生植物,原产自美国中西部地区,现广泛分布于世界各地干旱半干旱地区[2-4]。由于其叶片表面密布的盐囊泡具有反光作用,故又称灰毛滨藜。四翅滨藜生命力顽强,对各种逆境环境(如高盐、干旱、重金属、极端温度等)均表现出很强适应性,是防风固沙和盐碱地改良的重要物种[5-7]。除此之外,由于四翅滨藜植株无明显主干,树冠团状,加之其种子再生性强,植株竞争优势潜力大,因此该物种可作为我国西北、华北、东北干旱半干旱及荒漠盐碱地带造林绿化、水土保持和牧场改良的优良树种;同时,其植株分枝繁多,枝叶茂盛,青绿期长,体内富含胡萝卜素、粗蛋白等多种营养成分,且适口性较强,可作为大部分牲畜的优质饲草[5,8]。综上所述,四翅滨藜具有潜在的科学研究价值,并在我国北方生态环境恢复重建和畜牧业发展中具有巨大的应用前景。然而,目前对四翅滨藜这一优质种质资源的遗传背景还不清楚,对其分子生物学方面的研究也还相对薄弱。因此,需要对四翅滨藜独特的抗逆机制及其分子基础展开深入研究,而在研究其抗逆基因对逆境的响应模式过程中,需要有看家基因作为内标参照。
肌动蛋白(Actin)是细胞骨架的一个基本组分,42~45 kDa的细胞质蛋白就能够自行组装成动态丝状结构(微丝),而在细胞内被严格调控的肌动蛋白微丝是真核生物发挥细胞功能的基本组分[9]。该蛋白以聚合体、丝状体、单聚体或球状体等形式存在于真核细胞中,并在各种生理生化过程中发挥重要作用,包括细胞分裂增殖,胞内囊泡运输分子轨道构建,胞质组织构建,细胞质流,极性运动,花粉管生长[10],病原体或结瘤[11]引起的细菌信号分子响应变化等[12]。植物体内Actin是由376或377个氨基酸残基所组成,一般情况下,该蛋白会利用其分子表面与其它Actin结合蛋白发生作用,共同调控细胞内多种生命进程[13]。肌动蛋白结构与功能方面的研究属于生物学的基础性研究,随着科技的不断发展,对植物肌动蛋白的研究还有待更深层次的研究,近年来的研究重点已经转移到了在其结合蛋白调控下的功能作用的研究方面[14]。
目前,已经从许多植物中克隆到了Actin基因片段,如拟南芥(Arabidopsisthaliana,AY096397)、碱蓬(Suaedaglauca,EU429457)[15]、梭梭(Haloxylonammodendron)[16]、霸王(Zygophyllumxanthoxylum,EU019550)[17]、红砂(Reaumuriasongarica)[18]、盐生草(Halogetonglomeratus)[19]、小花碱茅(Puccinelliatenuiflora)[20]、地黄(Rehmanniaglutinosa,EU526396)[21]等。肌动蛋白普遍存在于真核细胞中,其氨基酸序列在各生物间的同源性高达70%~100%,是一种高度保守的古老蛋白,并且其基因是维护真核细胞基本功能的看家基因[22];由于其表达水平受外界环境影响很小,并在各种组织中表达恒定,因此常作为分子内标来比较样本来源不同的目的基因表达量差异[23]。
因此,本研究采用逆转录PCR(reverse transcription PCR,RT-PCR)技术,以盐生植物四翅滨藜4周龄幼苗为研究材料,克隆其Actin基因片段,并利用荧光定量PCR验证盐处理下该基因在不同组织中的表达量是否恒定。这将为深入研究四翅滨藜抗逆分子机制奠定基础,对其耐盐相关基因的表达模式提供内标参照,也可能对藜科植物抗逆功能基因的研究提供理论依据。
1 材料与方法
1.1 试验材料
本试验所采用的四翅滨藜种子采自我国半干旱地带宁夏地区。以4周龄幼苗为材料。RNAprep Pure Plant Kit购自北京天根(Tiangen),Phusion®High-Fidelity DNA Polymerase购自北京NEB,PrimeScript Ⅱ 1st strand cDNA合成试剂盒、pMD19-T载体及DNA Marker、PrimeScriptTMRT Master Mix(Perfect Real Time)反转录试剂盒、SYBR®PremixExTaqTMⅡ荧光染料均购自大连宝生物(Takara),菌株大肠杆菌(Escherichiacoli)DH5α感受态细胞购自北京全式金(TransGen Biotech),Star Prep Gel Extraction Kit购自GenStar(康润),其它常规和生化试剂均为国产分析纯或进口产品。样品测序由苏州金唯智公司(GENEWIZ)完成。
1.2 研究方法
1.2.1 材料培养 将四翅滨藜种子经物理方法(用粗砂纸将种子用力打磨,待种子上的翅被完全磨光之后过筛,选出大小基本一致的种子用于后续试验)去翅之后,再经70%(V/V)H2SO4处理,浸泡过夜(约14 h)以打破种子硬实,然后把种子冲洗干净直接点种在铺蛭石的培养皿中,上面再覆盖一层薄蛭石,黑暗条件下催芽,保持蛭石表面湿润,3~5 d发芽后移栽到盛蛭石的穴盘中,用1/2 Hoagland营养液培养4周。培养室昼温为(25±2) ℃,夜温为(23±2) ℃,光照时间为16 h·d-1,空气相对湿度为70%左右,光照强度约为800 μmol·(m2·s)-1。
1.2.2 总RNA提取 首先剪取4周龄四翅滨藜幼苗嫩叶,用蒸馏水轻轻冲洗表面,然后用滤纸吸干表面水分并快速将其剪碎装入1.5 mL RNase-free离心管中于液氮中速冻,再用研磨杵快速将组织磨至粉末状,根据RNAprep Pure Plant Kit(Tiangen)操作说明提取其叶片总RNA。最后利用NANO-DROP1000核酸蛋白检测仪检测其浓度及OD260/OD280值,浓度大于300 ng·μL-1并经凝胶电泳检测其完整性后即可用于后续实验。
1.2.3 RT-PCR扩增 按照PrimeScript Ⅱ 1st strand cDNA合成试剂盒(Takara)操作说明反转录得到cDNA第一链。然后利用DNAMAN 6.0软件,根据已登录到GenBank中的其它高等植物Actin基因核苷酸保守序列设计一对简并引物用于PCR扩增,引物序列分别为:上游,5′-GTGGTCGTACAACWGGTATTGTG-3′;下游,5′-GAHCCTCCAATCCAGACACTG-3′。
PCR反应体系:在无菌洁净的PCR管中建立50 μL扩增反应体系,ddH2O 32.5 μL,10×GC Buffer(Mg2+Plus)10 μL,2.5 mmol·L-1dNTP Mixture 4 μL,上游引物1 μL,下游引物1 μL,cDNA 1 μL,Phusion®High-Fidelity DNA Polymerase 0.5 μL。
PCR反应条件:98 ℃预变性30 s;98 ℃变性10 s,56 ℃退火30 s,72 ℃延伸30 s,30个循环;72 ℃延伸10 min。
用1%琼脂糖凝胶电泳对PCR扩增产物进行检测。有目的条带的切胶后按照StarPrep Gel Extraction Kit(GenStar)说明书进行回收和纯化。
1.2.4 阳性克隆的筛选与鉴定 按照pMD19-T载体(Takara)试剂盒操作说明,将回收产物连接到该载体上,然后转化E.ColiDH5α感受态细胞,采用蓝白斑法随机挑取10个白色单菌落于盛400 μL LB+Amp液体培养基的1.5 mL灭菌离心管中,并挑取一个蓝色菌落作为对照,180 r·min-1(37 ℃)摇菌2~3 h,待菌液浑浊后进行菌液PCR检测,同时再加400 μL LB+Amp液体培养基于原离心管中,继续180 r·min-1(37 ℃)摇菌4~6 h至菌液浑浊。最后将扩增出目的片段的优势条带所在的菌液送去苏州金唯智公司(GENEWIZ)测序。
1.2.5 生物信息学分析 利用DNAMAN 6.0生物软件进行序列的比对和翻译,并用MEGA 5.05软件构建系统进化树,在NCBI网站上进行核苷酸和氨基酸序列的BLAST比对。
1.2.6AcACT表达特性分析 利用荧光定量PCR分析四翅滨藜AcACT在盐处理下各组织中的表达水平,具体实验方案如下:用含有100 mmol·min-1NaCl的1/2 Hoagland营养液对4周龄四翅滨藜幼苗处理24 h,对照组正常浇灌1/2 Hoagland营养液,取样均分为根、茎、叶。总RNA提取同1.2.2。根据PrimeScriptTMRT Master Mix操作说明反转录合成荧光定量模板cDNA。同时根据荧光定量PCR引物设计原则设计一对引物,序列分别为:上游,5′-AAGAACTACGAGCTACCTGACGG-3′;下游,5′-GATACCAGAAGATTCCATTCCAAC-3′。然后根据SYBR®Premix Ex TaqTMⅡ操作说明于八连管中建立20 μL反应体系:ddH2O 5 μL,2×SYBR Premix Ex TaqTMⅡ 10 μL,ROX Reference Dye Ⅱ 0.4 μL,上游引物0.8 μL,下游引物0.8 μL,反转录cDNA稀释10倍后的产物3 μL。用7 500 Real-Time PCR System系统进行PCR反应。数据分析采用SPSS 16.0和WPS表格软件。
2 结果与分析
2.1 四翅滨藜叶片总RNA的质量
以4周龄四翅滨藜叶片为材料提取的总RNA,用NANO-DROP1000核酸蛋白检测仪检测其浓度为780 ng·μL-1,OD260/OD280值为1.96,再经凝胶电泳检测发现该RNA完整性良好,未发现降解,并观察到28S r RNA和18S r RNA的条带均清晰无拖尾,且两者亮度比基本呈2∶1(图1)。说明该RNA纯度高,质量好,可用于后续试验。
2.2 RT-PCR扩增
以反转录得到的cDNA第一链为模板,用设计好的一对特异性简并引物进行扩增。通过琼脂糖凝胶电泳检测扩增产物,发现在600 bp左右处有一清晰亮带(图2),这基本符合目的片段的预测长度。因此该条带很有可能是四翅滨藜AcACT基因片断,但有待进一步确定。

图1 四翅滨藜总RNA凝胶电泳

图2 AcACT基因RT-PCR产物凝胶电泳
注:M,2 000 bp DNA marker;1~3,Actin基因片段PCR产物。
Note: M, 2 000 bp DNA marker; 1~3, PCR products ofActingene fragment.
2.3 阳性克隆鉴定
将目的片段回收纯化并连接转化后,对随机挑取的白色菌落摇菌并进行PCR检测,凝胶电泳观察到这些扩增片段长度也在600 bp附近(图3),这一结果与RT-PCR结果一致,说明这些菌液呈阳性,可用于测序。
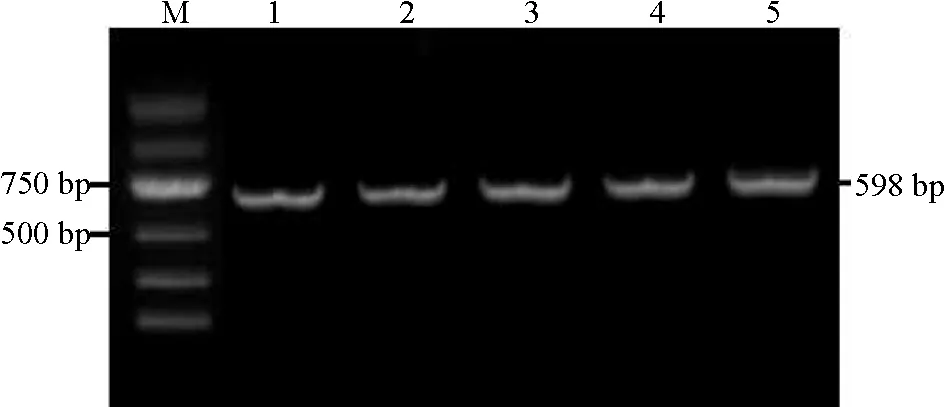
图3 阳性克隆的PCR鉴定
注:M,2 000 bp DNA Marker;1~5,阳性克隆。
Note: M, 2 000 bp DNA Marker; 1~5, Positive clones.
2.4 测序结果与分析
将鉴定后的阳性克隆送去金唯智(GENEWIZ)测序,得到的AcACT基因片段长度为598 bp,共编码198个氨基酸(图4);运用在线软件Compute PI/MW预测其氨基酸序列等电点PI为4.94,分子量为21.86 kDa;并利用DNAMAN 6.0生物软件将所测AcACT基因片段与随机挑选的8种植物的Actin基因片段进行氨基酸序列同源性比对(图5),比对结果显示,该片段非保守氨基酸仅有23个,其余氨基酸均很保守,这表明AcACT基因片段高度保守。此外,Blast比对结果显示,该Actin基因编码的氨基酸与拟南芥(Arabidopsisthaliana,AY096397)、碱蓬(Suaedaglauca,EU429457)、霸王(Zygophyllumxanthoxylum,EU019550)、甜菜(Betavulgaris,KF214784)、盐生草(Halogetonglomeratus,KF699314)、小花碱茅(Puccinelliatenuiflora, F J 545641)、地黄(Rehmanniaglutinosa,EU526396)、花生(Arachishypogaea,DQ873525)、水稻(Oryzasativa,AY212324)等GenBank中已登录的其它高等植物的Actin基因编码的氨基酸同源性均在84%以上。确定其为四翅滨藜肌动蛋白基因片段,故将其命名为AcACT。这又进一步说明肌动蛋白是一种高度保守的蛋白。

图4 AcACT基因片段的核苷酸序列及编码的氨基酸序列
核苷酸序列的多重比较及系统进化分析显示,AcACT片段与甜菜BvACT(KF214784)和碱蓬SgACT(EU429457)的氨基酸同源性最高(96%),表明AcACT片段与同科(藜科)植物的Actin基因片段亲源关系很近,同时与不同科植物AtACT(AY096397)、OsACT(AY212324)、PoACT(KM349373)、HaACT(KM886609)、GhACT(AY305732)、HgACT(KF699314)等的氨基酸同源性也在93%以上(图5、6)。

图5 AcACT氨基酸序列与其它他植物氨基酸序列的同源性比对
注:各植物Actin基因简称来源,碱蓬SgACT,陆地棉GhACT,马齿苋PoACT,拟南芥AtACT,水稻OsACT,梭梭HaACT,甜菜BvACT,盐生草HgACT。
Note: The sources ofActingene,SgACT(Suaedaglauca),GhACT(Gossypiumhirsutum),PoACT(Portulacaoleracea),AtACT(Arabidopsisthaliana),OsACT(Oryzasativa),HaACT(Haloxylonammodendron),BvACT(Betavulgaris),HgACT(Halogetonglomeratus).
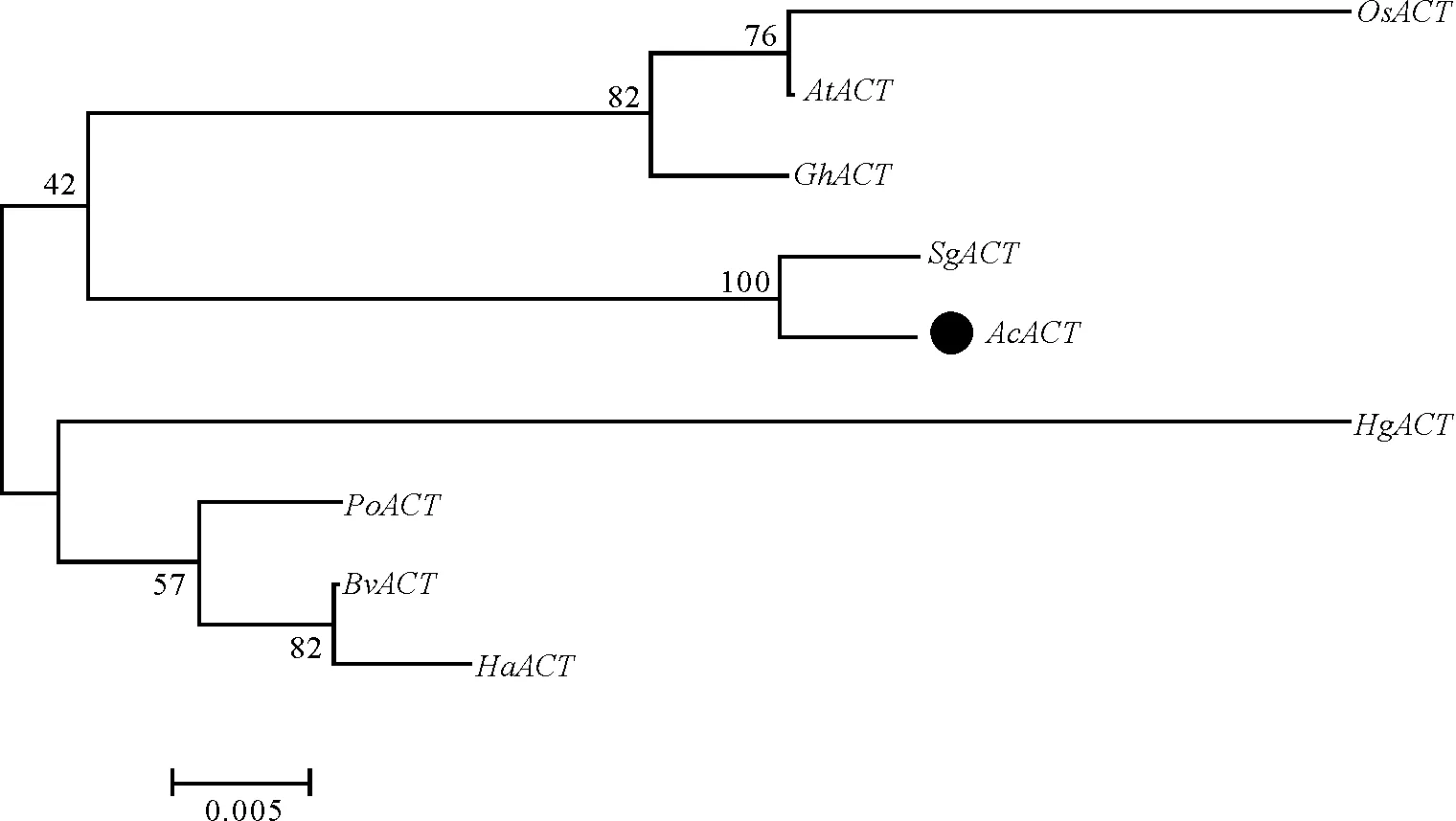
图6 AcACT与其他植物Actin基因氨基酸序列同源性分析
2.5AcACT基因的表达特性分析
利用荧光定量RT-PCR分析AcACT基因在盐处理下各组织中的表达情况,发现对照和100 mmol·L-1NaCl处理24 h后,AcACT基因在四翅滨藜幼苗的根、茎、叶中均有表达,其中叶中表达量相对较根和茎中的稍微偏高,但总体表达量恒定;值得注意的是,盐处理和对照相比表达量无显著差异(P>0.05)(图7)。这说明AcACT基因具有表达稳定性。

图7 AcACT基因的表达特性分析
注:不同小写字母表示同一器官对照与NaCl处理间差异显著(P<0.05)。
Note: Different lowercase letters for the same plant organs indicate significant difference between CK and NaCl at the 0.05 level.
3 讨论与结论
肌动蛋白骨架结构复杂、动态多变,现在公认其参与高等植物中诸多细胞活动,显著影响植物的形态建成和生长发育[24]。肌动蛋白调节物可以通过控制细胞突出物的结构和动力学特征来促进细胞运动[25],从而发挥各种细胞功能。在高等动植物中,Actin基因家族庞大,其不同成员的差异表达编码不同肌动蛋白,因而产生多种肌动蛋白异型体,如拟南芥中至少有10种肌动蛋白异型体[26]。而在细胞中不同的肌动蛋白异型体基因被表达后都可发挥功能,其结构上的多样性反映出功能上的多样性[27-28],所以在多种生理生化过程中肌动蛋白都发挥着重要作用。此外,植物信号转导途径中肌动蛋白的动力学变化是最为重要的一步反应,植物胞质中的肌动蛋白响应细胞内部或外界信号刺激,从而发生解聚或重组改变细胞的组织结构,当细胞接收到某些信号后会将其传导给其它目标,所有细胞即产生应答反应[29],发挥其功能。然而,肌动蛋白基因不仅在植物细胞生命活动中发挥重要作用,同时该蛋白基因核苷酸和氨基酸序列在进化上均具有较高的保守性和同源性,因而其作为看家基因发挥着无可替代的作用[30-31]。此外,四翅滨藜作为我国西北地区的优势种,特性优良,应用潜力巨大,但目前对其独特的抗逆分子机制还知之甚少。综上所述,要深入研究一个遗传信息和分子生物学背景不清楚的物种,首先要探究其体内某些功能基因的功能及表达特性,这就有必要对该物种的肌动蛋白基因进行克隆并分析其序列,同时还需要验证该基因的表达稳定性,以证实其可作为理想的内标参照。
本研究克隆到的AcACT基因片段长度为598 bp,满足实时定量及半定量分析基因表达量时引物设计的需要,其核苷酸序列与已登录在Genbank中的其它植物Actin基因核苷酸序列的同源性在84%以上,所编码的氨基酸序列同源性在94%以上。同时,荧光定量PCR分析结果也表明AcACT基因在盐处理下不同组织中的表达量恒定,可作为理想的内参基因。因此,该结果进一步证实了前人的结论,表明Actin基因是一种高度保守的看家基因。此外,四翅滨藜这一物种广泛分布于干旱半干旱荒漠盐碱地带,在其体内蕴藏着丰富的抗逆基因资源,深入挖掘这些资源将对于运用转基因技术来改良牧草抗逆性具有极其重要的意义。本研究克隆到AcACT片段进一步丰富了肌动蛋白基因的资料库,这为以AcACT基因作为内参基因来研究四翅滨藜其他功能基因的调控机制及表达模式奠定了基础。
References:
[1] 周璐璐,伏兵哲,许冬梅,陈丽萍,吴小娟,高雪芹.盐胁迫对沙芦草萌发特性影响及耐盐性评价.草业科学,2014,32(8):1252-1259. Zhou L L,Fu B Z,Xu D M,Chen L P,Wu X J,Gao X Q.Effects of salt stress on germination characteristics ofAgropyronmongolicumand salt-tolerance evaluation.Pratacultural Science,2014,32(8):1252-1259.(in Chinese)
[2] Glenn E P,Brown J J.Effects of soil salt levels on the growth and water use efficiency ofAtriplexcanescens(Chenopodiaceae) varieties in drying soil.American Journal of Botany,1998,85(1):10-16.
[3] Flowers T J,Colmer T D.Salinity tolerance in halophytes.New Phytologist,2008,179(4):945-963.
[4] Hao G Y,Lucero M E,Sanderson S C,Zacharias E H,Holbrook N M.Polyploidy enhances the occupation of heterogeneous environments through hydraulic related trade-offs inAtriplexcanescens(Chenopodiaceae).New Phytologist,2013,197(3):970-978.
[5] Glenn E P,Nelson S G,Ambrose B,Martinez R,Soliz D,Pabendinskas V,Hultine K.Comparison of salinity tolerance of threeAtriplexspp. in well-watered and drying soils.Environmental and Experimental Botany,2012,83(17):62-72.
[6] 孔东升.四翅滨藜形态特征及生理生态适应性.生态学杂志,2013,32(1):210-216. Kong D S.Morphological characteristics and eco-physiological adaptability ofAtriplexcanescens:A review.Chinese Journal of Ecology,2013,32(1):210-216.(in Chinese)
[7] Yu G,Li J T,Sun X H,Zhang X H,Liu J L,Pan H Y.Overexpression ofAcNIP5;1,a novel nodulin-like intrinsic protein from halophyteAtriplexcanescens,enhances sensitivity to salinity and improves drought tolerance inArabidopsis.Plant Molecular Biology Reporter,2015,33(6):1-12.
[8] 王文颖,王刚.四翅滨藜的生物-生态学特性及研究进展.草业科学,2004,21(7):18-21. Wang W Y,Wang G.Bio-ecological characteristic and research progress forAtriplexcanescen.Pratacultural Science,2004,21(7):18-21.(in Chinese)
[9] Díaz-Camino C,Villanueva M A.Actin expression is induced and three isoforms are differentially expressed during germination inZeamays.Journal of Experimental Botany,2005,56:557-565.
[10] Wasteneys G O,Galway M E.Remodeling the cytoskeleton for growth and form:An overview with some new views.Annual Review of Plant Biology,2003,54:691-722.
[11] Cárdenas L,Vidali L,Domínguez J,Pérez H,Sánchez F,Hepler P K,Quinto C.Rearrangement of actin microfilaments in plant root hairs responding toRhizobiumetlinodulation signals.Plant Physiology,1998,116(3):871-877.
[12] Dantán-González E,Rosenstein Y,Quinto C,Sánchez F.Actin monoubiquitylation is induced in plants in response to pathogens and symbionts.Molecular Plant-Microbe Interactions,2001,14(11):1267-1273.
[13] 王卓,张少斌,马镝,马冠宇.植物肌动蛋白研究进展.安徽农业科学,2007,35(10):2860-2863. Wang Z,Zhang S B,Ma D,Ma G Y.Advances in plant actin.Journal of Anhui Agricultural Sciences,2007,35(10):2860-2863.(in Chinese)
[14] 刘曦,张少斌,汪澈.植物肌动蛋白功能的研究进展.生物技术通报,2010(3):13-16. Liu X,Zhang S B,Wang C.Research progress of plant actin function.Biotechnology Bulletin,2010(3):13-16.(in Chinese)
[15] 马清,周向睿,伍国强,王锁民.盐生植物碱蓬Actin基因片段的克隆及序列分析.生物技术,2009,19(1):1-3. Ma Q,Zhou X R,Wu G Q,Wang S M.Cloning and sequence analysis ofActingene fragment from the halophyteSuaedaglauca.Biotechnology,2009,19(1):1-3.(in Chinese)
[16] 张灵,段慧荣,李静,吴永娜,张金林.旱生植物梭梭Actin基因片段的克隆及表达模式分析.基因组学与应用生物学,2014,33(3):598-603. Zhang L,Duan H R,Li J,Wu Y N,Zhang J L.Cloning and sequence analysis ofActingene from xerophyteHaloxylonammodendron.Genomics and Applied Biology,2014,33(3):598-603.(in Chinese)
[17] 伍国强,席杰军,包爱科,王锁民.多浆旱生植物霸王Actin基因片段的克隆及序列分析.生物技术通报,2008,18(2):101-104. Wu G Q,Xi J J,Bao A K,Wang S M.Cloning and sequence analysis ofActingene fragment from the succulent xerophyteZygophyllumxanthoxylum.Biotechnology Bulletin,2008,18(2):101-104.(in Chinese)
[18] 赵书艺,白天惠,包爱科,王沛,管萍萍.红砂肌动蛋白基因片段的克隆及序列分析.草业科学,2014,31(9):1707-1711. Zhao S Y,Bai T H,Bao A K,Wang P,Guan P P.Cloning and sequence analysis ofActingene fragment fromReaumuriasoongorica.Pratacultural Science,2014,31(9):1707-1711.(in Chinese)
[19] 马艳红,徐先良,汪军成,任盼荣,杨柯,孟亚雄,李葆春,马小乐,王化俊.盐生草Actin基因片段的克隆及表达.草业科学,2015,32(9):1432-1437. Ma Y H,Xu X L,Wang J C,Ren P R,Yang K,Meng Y X,Li B C,Ma X L,Wang H J.Cloning and expression analysis ofActingene fragment from halophyteHalogetonglomeratus.Pratacultural Science,2015,32(9):1432-1437.(in Chinese)
[20] 王生银,张永超,李莉,张金林,王春梅,郭强,包爱科.拒盐型盐生植物小花碱茅肌动蛋白基因片段的克隆及序列分析.基因组学与应用生物学,2009,28(4):673-677. Wang S Y,Zhang Y C,Li L,Zhang J L,Wang C M,Guo Q,Bao A K.Cloning and sequence analysis ofActingene fragment from salt-exclusion halophytePuccinelliatenuiflora.Genomics and Applied Biology,2009,28(4):673-677.(in Chinese)
[21] 孙鹏,郭玉海,祁建军,周莉丽,李先恩.地黄肌动蛋白基因片段的克隆与序列分析.安徽农业科学,2008,36(20):8470-8474. Sun P,Guo Y H,Qi J J,Zhou L L,Li X E.Cloning and sequence aAnalysis ofActingene fromRehmanniaglutinosa.Journal of Anhui Agricultural Sciences,2008,36(20):8470-8474.(in Chinese)
[22] 王洪振,程焉平.细胞核内肌动蛋白参与基因转录的研究进展.吉林师范大学学报:自然科学版,2005,26(2):34-36. Wang H Z,Cheng Y P.Advances of nuclearActininvolving in gene transcription.Jilin Normal University Journal:Science and Technology,2005,26(2):34-36.(in Chinese)
[23] Thomas C,Meyer D,Wolff M,Himber C,Alioua M,Steinmetz A.Molecular characterization and spatial expression of the sunflowerABP1 gene.Plant Molecular Biology,2003,52(5):1025-1036.
[24] Mccurdy D W,Kovar D R,Staiger C J.Actinand actin-binding proteins in higher plants.Protoplasma,2001,215(1):89-104.
[25] Bilancia C G,Winkelman J D,Tsygankov D,Nowotarski S H,Sees J A,Comber K,Evans I,Lakhani V,Wood W,Elston T C,Kovar D R,Peifer M.Enabled negatively regulates diaphanous-driven actin dynamics in vitro and in vivo.Developmental Cell,2014,28(4):394-408.
[26] Meagher R B,Mckinney E C,Kandasamy M K.Isovariant dynamics expand and buffer the responses of complex systems:The diverse plantActingene family.Plant Cell,1999,11(6):995-1006.
[27] 张少斌,任东涛,徐小静,刘国琴.豌豆肌动蛋白异型体(PEAc1)与绿色荧光蛋白融合基因的原核表达与特性分析.科学通报,2004,49(6):563-569. Zhang S B,Ren D T,Xu X J,Liu G Q.Prokaryotic expression and characterization of a pea actin isoform (PEAcl) fused to GFP.Chinese Science Bulletin,2004,49(6):563-569.(in Chinese)
[28] Allen P G,Shuster C B,Kas J,Chaponnier C,Janmey P A.Phalloidin binding and rheological differences among actin isoforms.Biochemistry,1996,35(45):14062-14069.
[29] Vantard M,Blanchoin L.Actin polymerization processes in plant cells.Current Opinion in Plant Biology,2002,5(6):502-506.
[30] 阮桢媛,陈晓鸣,杨子祥.角倍总RNA提取方法建立及Actin基因片段克隆.林业科学研究,2012,25(5):551-557. Ruan Z Y,Chen X M,Yang Z X.Extraction of total RNA from horned-gall and the cloning ofACTINgene fragment.Forest Research,2012,25(5):551-557.(in Chinese)
[31] Bhattacharya D,Aubry J,Twait E C,Jurk S.Actingene duplication and the evolution of morphological complexity in land plants.Journal of Phycology,2000,36(5):813-820.
(责任编辑 王芳)
Cloning and expression analysis of anActingene fragment from the halophyteAtriplexcanescens
Guo Huan, Cui Yan-nong, Wu Fan, Zhang Le, Xu Xiang-yu, Bao Ai-ke
(State Key Laboratory of Grassland Agro-ecosystems, College of Pastoral Agricultural Science and Technology, Lanzhou University, Lanzhou 730020, China)
TheActingene is one of the most commonly used reference genes for studying functional gene expression patterns. In this study, total RNA was extracted from the leaves of 4-week-oldAtriplexcanescensseedlings, and anActingene fragment was obtained by reverse transcription-polymerase chain reaction (RT-PCR) and linked into pMD19-T vector using primers designed based on conservedActingene sequences from similar plant species. The positive clones identified by PCR were sequenced, and the results showed that theActingene fragment ofA.canescenscontains 598 bp encoding 198 amino acids. Homology comparison withActingenes from other higher plants in GenBank indicate that this gene fragment shared more than 84% nucleotide sequence similarity and 94% amino acids sequence homology with other plants, suggesting strong conservation of this gene. Our results confirmed that the cloned gene was anActingene fragment, which we named asAcACT. Phylogenetic analysis showed a close relationship betweenAcACTand theActingenes fromBetavulgarisandSuaedaglauca. Meanwhile,AcACTexpression was constant in different tissues under salt treatment based on quantitative PCR analysis, which suggests thatAcACTcan be used as a reference gene for studying the expression patterns of salt tolerance-related genes ofA.canescens.
Atriplexcanescens; Actin; gene cloning; RT-PCR; amino acids;Betavulgaris;Suaedaglauca
Bao Ai-ke E-mail: baoaik@lzu.edu.cn
10.11829/j.issn.1001-0629.2016-0157
2016-03-25 接受日期:2016-06-17
国家自然科学基金(31372360);“本科教学工程”国家级大学生创新创业训练计划项目(201610730105);“中央高校基本科研业务费专项资金”自由探索项目(lzujbky-2015-250)
郭欢(1992-),女,甘肃靖远人,在读硕士生,主要从事植物逆境生理与分子生物学。E-mail:guoh2014@lzu.edu.cn
包爱科(1980-),男,甘肃岷县人,副教授,博士,主要从事草类逆境生理与基因工程研究。E-mail:baoaik@lzu.edu.cn
Q943.2
A
1001-0629(2017)3-0515-08*
郭欢,崔彦农,吴凡,张乐,许香玉,包爱科.盐生植物四翅滨藜Actin基因片段的克隆及表达分析.草业科学,2017,34(3):515-522.
Guo H,Cui Y N,Wu F,Zhang L,Xu X Y,Bao A K.Cloning and expression analysis of anActingene fragment from the halophyteAtriplexcanescens.Pratacultural Science,2017,34(3):515-522.
