MMP-11、CEA、CK-20、CD44 mRNA在结肠癌患者外周血中的表达及意义
2017-03-23郑宇张德进刘俊殷杰
郑宇,张德进,刘俊,殷杰
(江苏省海安县人民医院 普通外科,江苏 海安 226600)
血液循环中的肿瘤细胞是导致结肠癌转移、复发的重要原因之一[1-2]。RT-PCR的应用为外周血中肿瘤细胞的检测提供了一种具有高度敏感性和特异性的分子生物学方法[3]。相关研究[4-7]表明基质金属蛋白酶11(MMP-11)、癌胚抗原(CEA)、细胞角蛋白20(CK-20)、CD44与消化道肿瘤的发生、发展有密切的关系。本研究采用RT-PCR方法检测结肠癌患者外周血中游离肿瘤细胞及组织标本中MMP-11、CEA、CK-20、CD44 mRNA的表达情况,研究其与结肠癌发生、发展的相关性,为结肠癌的早期筛查及临床诊断提供依据。
1 资料与方法
1.1 研究对象
收集江苏省海安县人民医院结肠癌患者临床资料(初诊结肠癌患者、晚期结肠癌患者各20例)及健康体检者20例血液标本。初诊结肠癌患者20例,男13例,女7例;平均年龄(70.8±4.2)岁。晚期结肠癌患者20例,男14例,女6例;平均年龄(68.3±5.6)岁。初诊结肠癌患者高、中分化癌17例,低分化癌3例。晚期结肠癌患者高、中分化癌14例,低分化癌6例。初诊结肠癌患者Dukes分期:A期4例,B期15例,C期1例,均行根治性切除。晚期结肠癌患者根治性切除8例,姑息性切除者12例。同期健康体检者20例,其中男13例,女7例,平均年龄(67.5±6.2)岁。
1.2 分组
⑴ 试验组(40例):初诊结肠癌患者(未经放化疗、未发现转移)和晚期结肠癌患者(已发生远处转移)各20例外周血样本10 mL。⑵ 对照组(40例):阳性对照组为上述20例晚期结肠癌患者手术切除的癌组织样本;阴性对照组为健康体检者20例外周血样本10 mL,分别提取上述各组样本的总RNA,采用RT-PCR检测MMP-11、CEA、CK-20、CD44 mRNA的表达情况。
1.3 方法
1.3.1 仪器与主要试剂 主要设备:COBE外周血细胞分离机、OLYMPUS倒置显微镜、Thermofisher PCR 仪、Thermofisher超低温冰箱、Thermofisher液 氮储存箱、Eppendorf台式高速离心机、纯水仪等设备。主要试剂:Power SYBR Green PCR Master Mix(2X)(Life technologies),RevertAid First Strand cDNA Synthesis kit(Thermo scientific),Trizol Reagent(Life technologies),异丙醇(西陇化工股份有限公司),无水乙醇(无锡市晨阳化工有限公司),三氯甲烷(宜兴市第二化学试剂厂),碳酸氢钾(上海润捷化学试剂有限公司),氯化铵(江苏彤晟化学试剂有限公司),乙二胺四乙酸二钠(江苏彤晟化学试剂有限公司),氢氧化钠(江苏彤晟化学试剂有限公司),MMP-11、CEA、CK-20、CD44试剂(罗氏公司)。
1.3.2 RT-PCR操作过程 ⑴ RNA的提取:各组EDTA 抗凝血 10 mL,Trizol法提取全血 RNA,冻存于-80℃备用。癌组织块500 mg,用液氮研磨至粉状,用Trizol提取总RNA。⑵ 逆转录合成cDNA:TaKaRa公司逆转录试剂盒(反应体系:4μL 5× 逆转录 buffer,0.4 μL 下游引物(10 pmol/μL),0.5 μL dNTPs(10 mM),l μL MMLv(200 U/μL),10.1 μL DEPC 水,4μL RNA模板,总体积 20 μL,加 2 μL RNA 提取液,37℃水 浴 60 min,95 ℃ 3 min。⑶ RT-PCR:MMP-11 mRNA上、下游引物序列分别为5'-GAG AAG ACG GAC CTC ACC TAC A-3'、5'-CTC AGT AAA GGT GAG TGG CGT C-3';CEA mRNA 上、 下游引物列 5'-TCT AAC CCA TCC CCG CAG TA-3'、5'-TTA TTG CGG CCA GTA GCC AA-3';CK-20 mRNA 上、下游引物序列 5'-AAG AAC CTT CAA GAG GCC AA-3'、5'-CTA GAG TGT GCT CCA AAG ACT-3';CD44 mRNA 上、下游引物 列 5'-CAG CAA CCC TAC TGA TGA TGA CG-3'、5'-GCC AAG AGG GAT GCC AAG ATG A-3'。β-actin 上、下游引物序列分别为 5'-AGA AAA TCT GGC ACC ACA CC-3'、5'-AGA GGC GTA CAG GGA TAG CA-3'。每个反应均取PCR反应液50 μL、Tag酶2 μL、RT 反应产物 5 μL;MMP-11:反应条件:94 ℃变性 45 s,60 ℃退火 45 s,72℃延伸 60 s,扩增35个循环。CD44反应条件:94 ℃变性40 s,60 ℃退火 50 s,72 ℃延伸 60 s,扩增 40 个循环。CEA 反应条件为:93 ℃变性 30 s,55 ℃退火 45 s,72 ℃延伸45 s,共40循环;CK20反应条件为:95 ℃变性 40 s,58 ℃退火 50 s,70 ℃延伸 40 s,共38循环。
1.4 RT-PCR定量检测与相对定量
定量检测MMP-11、CEA、CK-20、CD44 mRNA表达水平,通过MMP-11、CEA、CK-20、CD44的Ct值与β-actin的Ct值得到△Ct值。通过△Ct计算2-△△Ct比较各组MMP-11、CEA、CK-20、CD44 mRNA表达的相对定量关系。
1.5 统计学处理
2 结 果
2.1 MMP-11、CEA、CK-20、CD44 mRNA表达
结肠癌患者外周血中各肿瘤标志物表达水平高于健康体检者(P<0.05);晚期结肠癌患者癌组织中各肿瘤标志物水平均高于其外周血中的肿瘤标志物水平(均P<0.05);Dukes C-D期结肠癌患者外周血中各肿瘤标志物含量均高于Dukes A-B期患者(均P<0.05);低分化结肠癌患者外周血中各肿瘤标志物含量均高于高、中分化结肠癌患者(均P<0.05)(表1)。
2.2 相对定量分析
通过△Ct计算2-△△Ct比较以上各组MMP-11,CEA,CK-20,CD44 mRNA表达的相对定量显示:结肠癌患者外周血中各肿瘤标志物水平明显高于健康体检者;晚期结肠癌患者癌组织中各肿瘤标志物水平明显高于其外周血肿瘤标志物水平;Dukes C-D期结肠癌患者外周血中各肿瘤标志物水平明显高于Dukes A-B期患者;低分化结肠癌患者外周血中各肿瘤标志物明显高于高、中分化结肠癌患者(表2)。
表1 各组MMP-11,CEA,CK-20,CD44 mRNA比较(△Ct,±s)
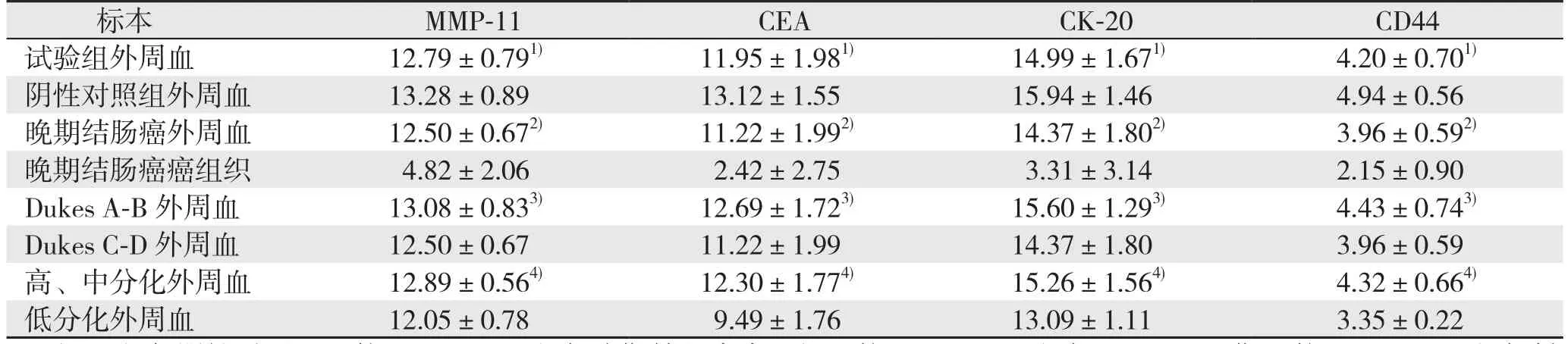
表1 各组MMP-11,CEA,CK-20,CD44 mRNA比较(△Ct,±s)
注:1)与阴性对照组比较,P<0.05;2)与晚期结肠癌癌组织比较,P<0.05;3)与Dukes C-D期比较,P<0.05;4)与低分化者比较,P<0.05
标本 MMP-11 CEA CK-20 CD44试验组外周血 12.79±0.791) 11.95±1.981) 14.99±1.671) 4.20±0.701)阴性对照组外周血 13.28±0.89 13.12±1.55 15.94±1.46 4.94±0.56晚期结肠癌外周血 12.50±0.672) 11.22±1.992) 14.37±1.802) 3.96±0.592)晚期结肠癌癌组织 4.82±2.06 2.42±2.75 3.31±3.14 2.15±0.90 Dukes A-B 外周血 13.08±0.833) 12.69±1.723) 15.60±1.293) 4.43±0.743)Dukes C-D 外周血 12.50±0.67 11.22±1.99 14.37±1.80 3.96±0.59高、中分化外周血 12.89±0.564) 12.30±1.774) 15.26±1.564) 4.32±0.664)低分化外周血 12.05±0.78 9.49±1.76 13.09±1.11 3.35±0.22
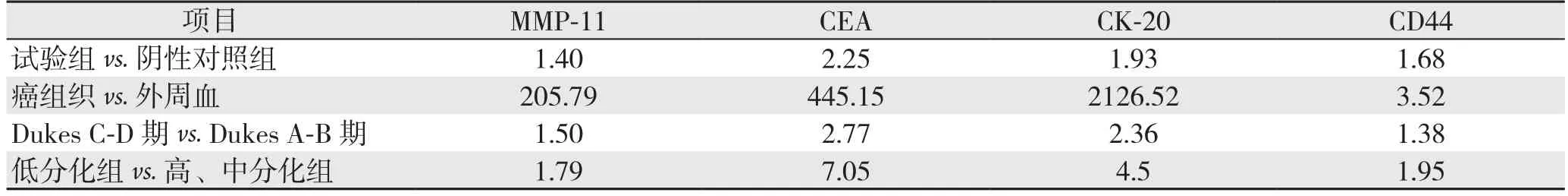
表2 各组MMP-11,CEA,CK-20,CD44 mRNA表达的相对定量关系(2-△△Ct)
3 讨 论
肿瘤标志物是由肿瘤细胞合成、释放或者是宿主对癌类反应性的一类物质,它们的存在或在血液中水平的变化可以提示肿瘤的性质,同时有助于了解肿瘤的组织发生、细胞分化及细胞功能[8]。MMP-11是基质金属蛋白酶(MMPs)家族的成员之一,其作用底物主要是基质中的蛋白多糖和糖蛋白,能降解细胞外基质和基底膜,可以导致细胞外基质代谢平衡的失调,从而引发肿瘤的浸润和转移,在人体不同实体瘤中MMP-11有不同程度的增高,与肿瘤进展及预后相关[9-10]。CEA是一种糖蛋白抗原,是常见的大肠癌肿瘤标志物,正常情况下CEA经胃肠道代谢,而肿瘤状态时CEA则进入血和淋巴循环,引起血清CEA异常增高[11-13]。细胞角蛋白20(CK-20)具有严格的上皮组织特异性,它非常局限于胃肠上皮细胞,在肿瘤组织及其血液中表达升高[14-15]。CD44是一种分布广泛的跨膜糖蛋白分子,具有激活淋巴细胞、参与信号传递、促进细胞间黏附等多种生物学功能,许多类型的恶性肿瘤存在不同程度CD44分子表达,高表达CD44分子的肿瘤细胞通过与细胞外基质中透明质酸、血管内皮细胞的黏着,赋予肿瘤细胞很强的侵袭转移能力,与肿瘤的生长、发展、转移和预后密切相关[16-17]。
本研究结果显示:结肠癌患者外周血中MMP-11、CEA、CK-20、CD44 4种肿瘤标志物水平明显高于健康体检者(P<0.05);结肠癌Dukes C-D期患者外周血中各肿瘤标志物含量明显高于Dukes A-B期患者(P<0.05);低分化结肠癌患者外周血中各肿瘤标志物明显高于高、中分化结肠癌患者(P<0.05)。本实验说明MMP-11、CEA、CK-20、CD44可作为结肠癌诊断的肿瘤标志物,且随着结肠癌恶性程度的增高和Dukes分期的进展,结肠癌患者外周血中MMP-11、CEA、CK-20、CD44 mRNA表达水平也增加,从而提示外周血中肿瘤标志物水平也逐渐增高,可为结肠癌患者的早期诊断、恶性程度的判断、及疾病分期提供有价值的信息。肿瘤标志物均存在敏感性和特异性较低的局限性,特别是单一的标志物对结肠癌的早期诊断意义有限,而多种肿瘤标志物联合检测有助于提高诊断的敏感性和准确性,目前多种肿瘤标志物联合检测已成为结肠癌早期诊断、手术方式选择、判断预后的一种重要手段[18]。联合检测上述四种肿瘤标志物可提高结肠癌诊断的敏感性和准确性,但目前尚无文献报道联合检测外周血中MMP-11、CEA、CK-20、CD44 mRNA的表达以早期筛查、诊断结肠癌。今后可进一步行联合检测结肠癌患者外周血MMP-11、CEA、CK-20、CD44 mRNA的表达及其相关性的研究。
总之,外周血中MMP-11、CEA、CK-20、CD44 mRNA表达水平的变化对于结肠癌的诊断及临床分期很有价值,为结肠癌的早期筛查提供了较准确的检查方案。
[1] Stein U, Schlag PM. Clinical, biological, and molecular aspects of metastasis in colorectal cancer[J]. Recent Results Cancer Res, 2007,176:61–80.
[2] Sanz-Garcia E, Marino D, Elez E, et al. Elucidating the molecular aspects of colorectal cancer and their clinical importance[J].Colorectal Cancer, 2016, 4(4):175–183. doi: 10.2217/crc.15.21.
[3] Huggett J, Dheda K, Bustin S, et al. Real-time RT-PCR normalisation; strategies and considerations[J]. Genes Immun,2005, 6(4):279–284.
[4] Asano T, Tada M, Cheng S, et al. Prognostic values of matrix metalloproteinase family expression in human colorectal carcinoma[J]. J Surg Res, 2008, 146(1):32–42.
[5] Pedersen G, Saermark T, Kirkegaard T, et al. Spontaneous and cytokine induced expression and activity of matrix metalloproteinases in human colonic epithelium[J]. Clin Exp Immunol, 2009, 155(2):257–265. doi: 10.1111/j.1365–2249.2008.03836.x.
[6] Prager GW, Braemswig KH, Martel A, et al. Baseline carcinoembryonic antigen (CEA) serum levels predict bevacizumabbased treatment response in metastatic colorectal cancer[J]. Cancer Sci, 2014, 105(8):996–1001. doi: 10.1111/cas.12451.
[7] Bánky B, Rásó-Barnett L, Barbai T, et al. Characteristics of CD44 alternative splice pattern in the course of human colorectal adenocarcinoma progression[J]. Mol Cancer, 2012, 11:83. doi:10.1186/1476–4598–11–83.
[8] Yamashita K, Watanabe M. Clinical signi ficance of tumor markers and an emerging perspective on colorectal cancer[J]. Cancer Sci,2009, 100(2):195–199. doi: 10.1111/j.1349–7006.2008.01022.x.
[9] González L, Eiró N, González L O, et al. Effect of the expression of matrix metalloproteases and their tissue inhibitors on survival of patients with resectable colorectal cancer[J]. Dig Dis Sci, 2012,57(8):2063–2071. doi: 10.1007/s10620–012–2154–z.
[10] Xu CJ, Xu F. MMP-11 and VEGF-C expression correlate with clinical features of colorectal adenocarcinoma[J]. Int J Clin Exp Med, 2014, 7(9):2883–2888.
[11] Parkhurst MR, Joo J, Riley JP, et al. Characterization of genetically modi fied T-cell receptors that recognize the CEA:691–699 peptide in the context of HLA-A2.1 on human colorectal cancer cells[J].Clin Cancer Res, 2009, 15(1):169–180. doi: 10.1158/1078–0432.CCR–08–1638.
[12] Bagaria B, Sood S, Sharma R, et al. Comparative study of CEA and CA19–9 in esophageal, gastric and colon cancers individually and in combination(ROC curve analysis)[J]. Cancer Biol Med, 2013,10(3):148–157. doi: 10.7497/j.issn.2095–3941.2013.03.005.
[13] 朱磊, 赵阳, 韩仕峰, 等. 术前血清CEA和CA19–9水平检测对结肠癌术后早期复发转移的预测价值[J]. 中国普通外科杂志, 2015,24(8):1170–1174. doi: 10.3978/j.issn.1005–6947.2015.08.023.Zhu L, Zhao Y, Han SF, et al. Predictive significance of preoperative serum CEA and CA19–9 determination in early recurrence/metastasis of colon cancer after operation[J]. Chinese Journal of General Surgery, 2015, 24(8):1170–1174. doi: 10.3978/j.issn.1005–6947.2015.08.023.
[14] Vlems FA, Diepstra JH, Cornelissen IM, et al. Limitations of cytokeratin 20 RT-PCR to detect disseminated tumour cells in blood and bone marrow of patients with colorectal cancer: expression in controls and downregulation in tumour tissue[J]. Mol Pathol, 2002,55(3):156–163.
[15] Teama SH, Agwa SHA. Detection of circulating tumor cells by nested RT-PCR targeting EGFR/CEA/CK20mRNAs in colorectal carcinoma patients[J]. EJMHG, 2010, 11(2):173–180.
[16] Misra S,Ghatak S,Vyas A,et al. Isothiocyanate analogs targeting CD44 receptor as an effective strategy against colon cancer[J]. Med Chem Res, 2014, 23(8):3836–3851.
[17] Ou J, Deng J, Wei X, et al. Fibronectin extra domain A (EDA)sustains CD133(+)/CD44(+) subpopulation of colorectal cancer cells[J]. Stem Cell Research, 2013, 11(2):820–833. doi: 10.1016/j.scr.2013.05.009.
[18] 王欣, 傅仲学. 结直肠癌的分子生物学研究进展[J]. 中国普通外科杂, 2010, 19(4):426–429.Wang X, Fu ZX. Research progress in molecular biology of colorectal cancer[J]. Chinese Journal of General Surgery, 2010,19(4):426–429.
